转录组分析产紫篮状菌Q2菌株抑制尖镰孢菌生长的潜在机制
2021-09-12赵洋田叶韩高克祥付学松
赵洋,田叶韩,高克祥,付学松
(山东农业大学植物保护学院,山东 泰安 271018)
尖镰孢菌(Fusarium oxysporum)包括致病型和非致病型,致病性尖镰孢菌可为害香蕉、番茄、西瓜、大豆和棉花等100多种重要的经济作物[1-3],由尖镰孢菌引起的作物枯萎病在全球范围内造成的损失逐年增加[4]。尖镰孢菌在自然界中可产生大型分生孢子、小型分生孢子和厚垣孢子。尖镰孢菌主要以休眠的厚垣孢子在土壤中生存,即使在没有宿主的情况下也可以在土壤中存活10~15年[5]。厚垣孢子可以通过土壤、水、农具和人类等媒介传播,并成为下一年的主要传染源[6]。
生物防治是一种生态无害的植物病害防治方法,被认为是控制土传病害最有潜力的措施。目前,木霉菌(Trichoderma)、链霉菌(Streptomyces)、青霉菌(Penicillium)、非致病尖镰孢菌(nonpathogenicF.oxysporum)、毛壳菌(Chaetomium)、芽孢杆菌(Bacillus)、假单胞菌(Pseudomonas)等有益微生物已经被应用于枯萎病的防治。链霉菌FJAT-31547菌株预先接种番茄后,番茄枯萎病的发病率降低80.59%,青枯病的发病率降低76.92%[7]。链霉菌CT205菌株对温室黄瓜枯萎病的防效为51.85%[8]。链霉菌IC10菌株对番茄枯萎病的防效比化学杀菌剂提高12.5%[9]。青霉菌可明显减轻尖镰孢菌侵染对芝麻植株的危害[10]。非致病性尖镰孢菌已被应用于防治番茄、黄瓜和西瓜等作物的枯萎病[11]。棘孢木霉(T.asperellum)PRR2与木霉菌NRCB3联合使用可使香蕉枯萎病的发病率下降47%[12]。贝莱斯芽孢杆菌(B.velezensis)F21在温室和田间对西瓜枯萎病的防治效果分别为80.35%和65.81%[13]。
产紫篮状菌(Talaromyces purpureogenus)Q2菌株是本实验室从苦瓜连作土壤中分离得到的一株对苦瓜枯萎病具有良好防治效果的生防真菌。篮状菌属原属于青霉属下亚属,后来通过分子种系学研究发现篮状菌与青霉差异较大,随后将篮状菌属分出单独研究[14]。前期的研究发现,菌株Q2对苦瓜枯萎病、烟草黑胫病、烟草根黑腐病和马铃薯茎基腐病等多种土传病害具有良好的防治效果,对苦瓜枯萎病的防治效果达到50%以上[15]。宏基因组和微生物多样性分析结果表明,菌株Q2可在土壤中稳定定殖,并直接抑制土壤中尖镰孢菌种群的恢复趋势。同时,菌株Q2可通过诱导植物木质素及其合成相关基因的表达,增强苦瓜植株对枯萎病的抗病性(未发表数据)。然而,我们对产紫篮状菌抑制尖镰孢菌生长的作用机理尚不清楚。本试验通过产紫篮状菌和尖镰孢菌的共培养观察尖镰孢菌菌丝形态变化,并采用转录组技术分析在尖镰孢菌诱导下产紫篮状菌的基因表达差异,从转录水平揭示产紫篮状菌抑制尖镰孢菌生长的作用机制,旨在为产紫篮状菌有效防控枯萎病提供理论基础。
1 材料与方法
1.1 试验材料
供试菌种:产紫篮状菌(Talaromyces purpureogenus)Q2菌株,保藏于中国微生物菌种保藏管理委员会普通微生物中心,编号为CGMCC NO.13165;尖镰孢菌苦瓜专化型(Fusarium oxysporumf.sp.momordicae)SG-15菌株,保藏于中国农业微生物菌种保藏管理中心,编号为ACCC 39204。
培养基:马铃薯葡萄糖琼脂培养基(PDA,去皮马铃薯200 g、葡萄糖20 g、琼脂20 g、水1 L);马铃薯葡萄糖液体培养基(PDB,去皮马铃薯200 g、葡萄糖20 g、水1 L)。
1.2 试验方法
1.2.1 菌株Q2对菌株SG-15的生长抑制作用 将0.2 mL的SG-15菌株小型分生孢子悬浮液(1×108cfu/mL)分别与0(CK)、0.01(T1)、0.10(T2)、1.00(T3)、5.00(T4)、10.00(T5)mL的Q2分生孢子悬浮液(2×107cfu/mL)混合后补充无菌水至10.2 mL,接种于100 mL PDB中。28℃、180 r/min共培养3~5 d,使用3层擦镜纸过滤,收集不同处理组的菌丝和孢子。在Nikon Eclipse 90i显微镜下观察菌丝及其分生孢子形态,并进行测量和拍照;使用血球计数板对过滤液中菌株SG-15分生孢子计数。采用PI染色法检测菌株SG-15分生孢子活性:取1 mL过滤液离心弃去上清液,收集菌株SG-15孢子于离心管底部,加入0.01 mol/L磷酸缓冲液(PBS)1 mL重悬,然后加入10μL碘化丙啶(PI)染液,室温暗处理15 min,离心后将孢子用1 mL PBS洗涤两次后再用PBS重悬,印片后于荧光显微镜下观察,PI最大激发波长和最大发射波长分别为488 nm和630 nm,此时死亡的菌株SG-15孢子会发出红色荧光。
1.2.2 菌株Q2产几丁质酶和葡聚糖酶能力 将菌株Q2(接种量2×105cfu/mL)分别接种于100 mL的PDB基础培养基(记为Q2)、含有菌株SG-15分生孢子(2×105cfu/mL)的PDB培养基(记为Q2-FOM),另设只含有菌株SG-15分生孢子(2×105cfu/mL)的PDB培养基(记为FOM)。28℃、180 r/min培养7 d,过滤菌丝,采用试剂盒(北京索莱宝科技有限公司)测定发酵液中几丁质酶和葡聚糖酶活性。
1.2.3 转录组分析菌株Q2抑制菌株SG-15生长机理 试验设置两个处理,每个处理3次重复。菌株Q2纯培养(Control):将1.0 mL菌株Q2分生孢子悬浮液(2×107cfu/mL)接种于100 mL PDB培养基中;菌株Q2与菌株SG-15共培养(FOM):0.2 mL菌株SG-15分生孢子悬浮液(1×108cfu/mL)与1.0 mL菌株Q2分生孢子悬浮液(2×107cfu/mL)接种于100 mL PDB中。28℃、180 r/min培养3 d,使用3层擦镜纸过滤,收集菌株Q2菌丝体进行转录组测序,测序服务由上海派森诺生物科技股份有限公司完成。RNA提取及转录组数据分析参照Liu等[16]的方法。
1.3 数据分析
利用SPSS 20.0和Microsoft Excel 2007软件对数据进行方差分析、显著检验并作图。
2 结果与分析
2.1 菌株Q2对尖镰孢菌SG-15生长发育的影响
显微镜下观察发现,单独培养的SG-15菌丝生长正常,产生了较多的小型分生孢子,有些孢子已经萌发(图1A);在菌株Q2与菌株SG-15共培养体系中SG-15菌丝形态发生显著变化,菌丝细胞肿胀呈圆形,菌丝细胞间缢缩,菌丝细胞内油球增多,菌丝内出现红色物质,仅产生了较少的小型分生孢子,未见孢子萌发(图1B)。在共培养试验中,菌株SG-15小型分生孢子在体系中的起始浓度约为2.0×106cfu/mL,在共培养5 d后,T1~T5共培养体系中的菌株SG-15小型分生孢子浓度显著低于对照处理(CK)(图1C)。CK处理中菌株SG-15的孢子浓度为1.20×108cfu/mL,T1、T2、T3、T4和T5处理分别为8.20×107、6.73×107、9.83×106、4.33×106cfu/mL和1.77×106cfu/mL。PI染色结果表明,与对照处理(图1D)相比,共培养体系中荧光强度显著增强(图1E),说明PI染料可以透过受损的细胞膜进入细胞,菌株SG-15分生孢子的细胞壁和细胞膜受损。
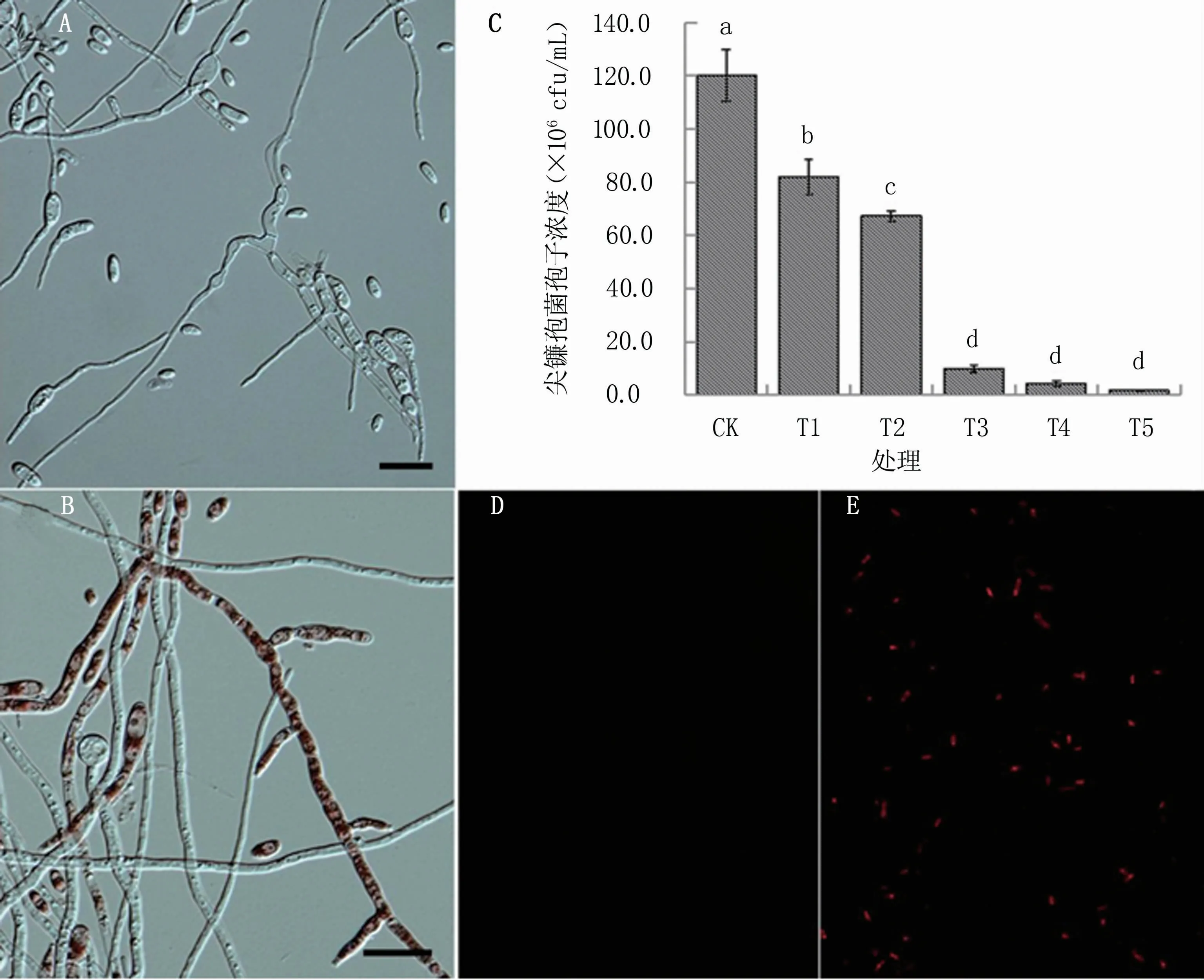
图1 菌株Q2对尖镰孢菌SG-15生长的影响
2.2 菌株Q2的转录组分析
在Control和FOM处理的6个转录组测序文库中,获得36 818万条Reads,去除带接头、低质量的Reads后,总共获得超过34 397万个高质量的Reads。所有样本的Q30值均大于92%。这些数据表明,RNA-seq获得的数据质量可用于进一步的分析。在样本Control的测序文库中,97.76%的序列比对到菌株Q2的基因组中(NCBI登录号:JABUIS000000000),每个样本中超过98%的序列被唯一地定位到基因组上。在样本FOM的测序文库中,55.45%的序列比对到菌株Q2的基因组中,每个样本中超过97%的序列被唯一地定位到基因组上。在菌株SG-15诱导下,菌株Q2的基因表达发生显著变化(图2A),共有2 664个差异表达基因,占总基因的28.14%,其中1 302个基因上调、1 362个基因下调(图2B)。
通过GO(gene ontology)分析和KEGG代谢通路分析对差异基因在注释功能中的分布状况进行了分析。GO分析将基因划分为分子功能(molecular functions)、生物过程(biological processes)和细胞成分(cellular components)(图2C)。在分子功能分类中,差异表达基因(DEGs)主要富集于氧化还原酶活性(oxidoreductase activity,238个基因上调、218个基因下调)和催化活性(monooxygenase activity,34个基因上调、59个基因下调)。在生物过程类别中,差异表达基因主要富集于氧化还原过程(oxidation-reduction process,2 155个基因上调、220个基因下调)和跨膜运输(transmembrane transport,161个基因上调、127个基因下调)。在细胞成分类别中,差异表达基因主要富集于膜固有组分(intrinsic component of membrane,164个基因上调、159个基因下调)、膜部分(membrane part,187个基因上调、162个基因下调)和膜整体组分(integral component of membrane,161个基因上调、152个基因下调)。由GO分析可知,菌株Q2氧化还原过程及氧化还原酶活性和催化活性较为活跃。
DEGs被注释到111条代谢通路中,共获得显著富集代谢通路27条(图2D),主要为酪氨酸代谢(tyrosine metabolism,17个基因上调、8个基因下调)、氧化磷酸化(oxidative phosphorylation,35个基因上调、1个基因下调)、戊糖和葡萄糖醛酸盐相互转化(pentose and glucuronate interconversions,14个基因上调、2个基因下调)、苯丙氨酸代谢(phenylalanine metabolism,11个基因上调、7个基因下调)、糖酵解/糖异生(glycolysis/gluconeogenesis,20个基因上调、3个基因下调)、柠檬酸循环(citrate cycle,13个基因上调、1个基因下调)、丙酮酸代谢(pyruvate metabolism,9个基因上调、7个基因下调)。这些结果表明,在尖镰孢菌SG-15诱导下,菌株Q2具有更加活跃的营养物质代谢和能量代谢。

图2 SG-15菌株诱导下菌株Q2表达差异显著基因的比较分析
2.3 尖镰孢菌诱导下菌株Q2几丁质酶和葡聚糖酶相关基因表达
菌株Q2基因组中共计预测和注释到9 600个编码基因,其中在碳水化合物活性酶数据库(CAZy)中注释到463个碳水化合物活性酶基因,占总基因数的4.8%,包括200个糖苷水解酶(glycoside hydrolases,GHs)、83个糖基转移酶(glycosyl transferases,GTs)、2个多糖裂解酶(polysaccharide lyases,PLs)、84个碳水化合物酯酶(carbohydrate esterases,CEs)、79个辅助活性酶(auxiliary activities,AAs)和15个碳水化合物结合酶(carbohydrate-binding modules,CBM)。在糖苷水解酶的基因中注释到30个葡聚糖酶(glucanase)基因和23个几丁质酶(chitinase)基因。结合菌株Q2基因组在SwissProt数据库的注释结果,筛选到了16个葡聚糖酶基因(图3A)和13个几丁质酶基因(图3B)。为研究菌株Q2与尖镰孢菌菌株SG-15互作过程中葡聚糖酶和几丁质酶相关基因表达差异,根据转录组数据的FPKM值作为基因的相对表达量构建了基因表达热图(图3)。在菌株SG-15诱导下,菌株Q2的几丁质酶和葡聚糖酶相关基因表现出不同的表达趋势,其中β-1,3-葡聚糖酶基因(TP1.g228、TP2.g877)和几丁质酶(TP1.g938、TP4.g281、TP4.g285、TP5.g130、TP5.g819)的表达水平上升。在菌株Q2和菌株SG-15共培养体系中,β-1,3-葡聚糖酶和几丁质酶活性分别为3.40 U/mL和1.97 U/mL,相比于菌株Q2纯培养体系中的β-1,3-葡聚糖酶活性(2.51 U/mL)和几丁质酶活性(1.79 U/mL)提高了35.46%和10.06%(图4)。
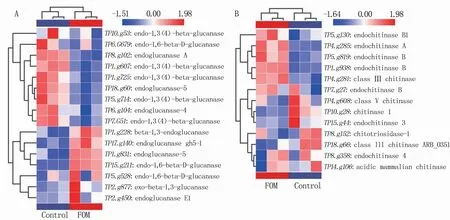
图3 基于转录组数据分析菌株SG-15诱导下菌株Q2葡聚糖酶(A)和几丁质酶(B)相关基因的表达

图4 不同条件下菌株Q2产β-1,3-葡聚糖酶和几丁质酶能力
2.4 尖镰孢菌SG-15诱导下菌株Q2的次级代谢产物相关基因的表达
基于antiSMASH数据库,在Q2基因组中预测到57个次级代谢物簇、66个核心生物合成基因(core biosynthetic genes),主要包括Ⅰ型聚酮合酶(T1PKS)、非核糖体肽合成酶(NRPS)、β-内酰胺(beta-lactone)、吲哚类(indole)、多萜(terpene)、真菌核糖体合成的和翻译后修饰的肽(fungal-RiPP)。根据FPKM值构建的基因表达热图显示,在菌株SG-15诱导下,菌株Q2的次级代谢产物相关基因表现出不同的表达趋势(图5),其 中TP1.g1012(pentalenene synthase)、TP7.g18(terpene synthase)、TP8.g157(trichodiene synthase)、TP8.g275(polyketide synthase)、TP11.g64(nonribosomal peptide synthetase)和TP17.g126(polyketide synthase)等基因的表达水平显著提高(P<0.05)。进一步对以TP17.g126为核心生物合成基因的次级代谢产物簇相关基因进行分析发现,以TP17.g126为核心的次级代谢产物簇包括13个基因,其中8个基因的表达水平在SG-15菌株诱导下显著提升,经qRT-PCR验证表明,TP17-124、TP17-125、TP17-126、TP17-127、TP17-128、TP17-129、TP17-130和TP17-131分别提高9.12、8.68、96.68、30.67、31.88、4.53、22.74、8.41倍。但尚未明确TP17.g126基因参与合成的次级代谢产物对SG-15菌株生长的影响。

图5 基于转录组数据分析菌株SG-15诱导下菌株Q2次级代谢产物相关基因的表达
3 讨论与结论
篮状菌属真菌广泛存在于土壤和空气中,是重要的工业酶及色素生产菌,有的种类可应用于植物病害的防控[14,17]。Naraghi等[18]研究表明,从番茄根际土壤分离到的黄色篮状菌(T.flavus)在室内和温室条件下对引起番茄枯萎病的大丽轮枝孢(Verticillium dahliae)具有明显的拮抗作用。本研究中所应用的产紫篮状菌Q2菌株是一株具有较大开发应用潜力的生防菌株。前期的研究表明,菌株Q2能够在平皿中抑制包括真菌和卵菌在内的12种植物病原菌的生长和繁殖;在温室条件下对苦瓜枯萎病、烟草黑胫病、烟草根黑腐病和马铃薯茎基腐病等土传病害具有明显的预防效果[15]。本研究中,菌株Q2可通过破坏SG-15菌株细胞壁和细胞膜结构抑制其生长和繁殖,随着菌株Q2接种量的增加,对SG-15生长的抑制程度增加。梁晓洁等[19]研究发现木霉菌株TkonT1和TatrT3可通过破坏尖镰孢菌菌丝体和消解细胞原生质减轻尖镰孢菌对油桐的危害。赵欣等[20]研究发现解淀粉芽孢杆菌(B.amyloliquefaciens)HRH317菌株通过破坏串珠镰孢菌(F.moniliforme)菌丝形态和细胞超微结构抑制病原菌菌丝体的生长。
β-1,3-葡聚糖和几丁质是真菌细胞壁的重要结构成分,参与了真菌细胞壁建成。尖镰孢菌细胞壁结构的完整性不仅在菌丝体生长中起着重要作用,而且还决定着其对植物的致病力[21]。真菌菌丝尖端的β-1,3-葡聚糖和几丁质暴露在表面,易受到β-1,3-葡聚糖酶和几丁质酶的胁迫[22]。许多生防微生物可通过产生β-1,3-葡聚糖酶和几丁质酶破坏病原真菌细胞壁的完整性从而抑制病原菌的生长和繁殖[9]。Ueki等[23]研究表明3株能够产生β-1,3-葡聚糖酶和几丁质酶的拜氏梭菌(Clostridiumsp.)在共培养条件下可有效抑制尖镰孢菌的生长繁殖。本研究发现菌株Q2与尖镰孢菌SG-15菌株共培养中,菌株Q2可有效抑制菌株SG-15的孢子萌发和菌丝生长,且共培养体系的β-1,3-葡聚糖酶和几丁质酶活性显著高于菌株Q2纯培养体系。转录组结果表明,在尖镰孢菌诱导下,产紫篮状菌Q2菌株的TP1.g228、TP2.g877、TP1.g938、TP4.g281、TP4.g285、TP5.g130和TP5.g819等细胞壁降解酶合成相关基因的表达水平升高。通过以上结果,我们认为产紫篮状菌Q2菌株产生的β-1,3-葡聚糖酶和几丁质酶参与了菌株Q2对尖镰孢菌孢子萌发和菌丝生长发育的抑制作用。
篮状菌大多可产生黄色和红色的无毒性色素,其主要成分为丝红素类色素和红曲红色素[14]。本研究发现,在尖镰孢菌诱导下,菌株Q2的物质代谢和能量代谢更为活跃,与Ⅰ型聚酮合酶、非核糖体肽合成酶、β-内酰胺和多萜等次级代谢产物相关的基因表达水平升高。其中以TP17.g126为核心的生物合成基因簇的基因转录水平极显著上升,包括脂肪酸合成酶、转录激活因子、聚酮合酶、短链脱氢酶、单端孢酶烯3-O-乙酰转移酶、FAD依赖性单加氧酶和FDA连接的氧化还原酶等,同源性分析表明,TP17.g126为核心的代谢产物簇与红曲红素(monascorubrin)生物合成基因簇的相关性较高。同时,我们观察到,在菌株Q2与菌株SG-15共培养中,菌株Q2产生的红色物质增多,且在菌株SG-15菌丝和分生孢子中沉淀积累。但目前我们尚不清楚菌株Q2产生的红色物质是否对尖镰孢菌具有抑制活性。
产紫篮状菌Q2菌株对尖镰孢菌生长的抑制作用是一个综合的作用机制,本试验明确了菌株Q2可通过产生β-1,3-葡聚糖酶和几丁质酶等细胞壁降解酶破坏尖镰孢菌SG-15细胞壁的完整性,抑制其生长,但对菌株Q2抑制SG-15生长的其他机制尚不明确。下一步将对菌株Q2的聚酮合酶代谢簇的代谢产物及其功能做进一步分析,明确其对尖镰孢菌生长的影响。
