怀玉山三叶青TOM2B isoform X1基因克隆和功能分析
2021-09-12尹明华胡嘉琦胡明艳胡蓉胡燕荣黄舒绮江梦芝姜梦真陈荣华蔡红
尹明华,胡嘉琦,胡明艳,胡蓉,胡燕荣,黄舒绮,江梦芝,姜梦真,陈荣华,蔡红
(1.上饶师范学院生命科学学院,江西 上饶 334001;2.上饶市药食同源植物资源保护与利用重点实验室,江西 上饶 334001;3.上饶市三叶青保育与利用技术创新中心,江西 上饶 334001;4.上饶农业技术创新研究院,江西 上饶 334001;5.上饶市红日农业开发有限公司,江西 上饶 334700)
三叶青(Tetrastigma hemsleyanumDiels et Gilg)为葡萄科崖爬藤属植物,是我国特有的珍稀药用植物,又名三叶崖爬藤、金线吊葫芦、蛇附子、石老鼠[1]。三叶青在民间素有药食两用习俗,全草均可入药,以地下块根和果实的药用效果最好,近年来临床多应用于抗癌、抗艾滋病毒、治疗血液病、肝炎及肺炎等感染性疾病[2]。药理研究表明,三叶青具有抗肿瘤、抗炎、解热镇痛、抗病毒、保肝以及免疫调节等多种药理作用,无毒无副作用,是目前公认的“植物抗生素”[3]。三叶青一般采用大棚和林下基质扦插无性繁殖,极易感染和积累烟草花叶病毒[4]。烟草花叶病毒(Tobacco mosaic virus,TMV)是对农作物危害最严重的病毒,在世界各地均有分布,能侵染茄科、葫芦科、十字花科等重要作物,给农业生产造成巨大经济损失[5]。烟草花叶病毒在宿主体内的复制和运输需要依靠一些宿主因子才能完成[6]。近年来在拟南芥(Arabidopsis thaliana)中一些宿主因子基因陆续被发现并证实支持烟草花叶病毒的复制和运输,如烟草病毒增殖蛋白1(tobamovirus multiplication 1,TOM1)、烟草病毒增殖蛋白2(tobamovirus multiplication 2,TOM2)和烟草病毒增殖蛋白3(tobamovirus multiplication 3,TOM3)[7]。烟草病毒增殖蛋白2有TOM2A和TOM2B之分,TOM2B又有TOM2B isoform X1、TOM2B isoform X2和TOM2B isoform X3等亚型[8]。因此,克隆三叶青TOM2B isoform X1基因并对其进行功能分析,对研究TOM2B isoform X1基因在三叶青中的表达和三叶青烟草花叶病毒的增殖具有重要意义。目前关于TOM2B isoform X1研究的报道较少。本研究利用RT-PCR技术克隆怀玉山三叶青TOM2B isoform X1基因,并采用生物信息学、烟草转基因技术和实时定量PCR对其进行序列、功能和组织表达分析,为揭示怀玉山三叶青TOM2B isoform X1的生物学功能提供理论依据,并为从分子水平调控怀玉山三叶青烟草花叶病毒增殖提供新思路。
1 材料与方法
1.1 试验材料
怀玉山三叶青两个栽培种‘怀玉1号’和‘怀玉2号’试管苗。
1.2 试验方法
1.2.1 总RNA的提取和cDNA第一链的合成 用Trizol试剂提取怀玉山三叶青‘怀玉2号’试管苗的总RNA,提取步骤按说明书进行,使用紫外分光光度计和琼脂糖凝胶电泳检测RNA的浓度和完整性。以提取获得的RNA为模版,按照M-MLV cDNA第一链合成试剂盒说明书合成cDNA第一链。逆转录引物用Oligo(dT)18 Primer:5′-GGCCACGCGTCGACTAGTACTTTTTT TTTTTTTTTTTT-3′,具体步骤按说明书进行。
1.2.2TOM2B isoform X1(TP2BX1)基因的克隆 利用转录组组装的Unigene序列信息(TRINITY_DN12393_c0_g1),运用Primer Premier 5.0设计引物1(F:5′-ATGGCGTCAGCTTCACATTC-3′;R:5′-GCTTGGCGCTGAGGGTTG-3′)。PCR反应体系(总体积50μL)包括17μL ddH2O、25μL 2×Phanta Max Buffer、1μL dNTP Mix(10 mmol/L each)、2μL模板DNA、2μL引物1F(10μmol/L)、2 μL引物1R(10μmol/L)、1μL Phanta Max Super-Fidelity DNA Polymease(1 U/μL)。PCR扩增条件:95℃30 s;95℃15 s,退火45~55℃15 s,延伸72℃1 min,39个循环;最后72℃延伸5 min。PCR产物经1%琼脂糖凝胶电泳检测后,将含有目的基因的条带与pMD19-T载体连接并用热激法转化到感受态细胞E.coliDH5α,经鉴定正确的阳性转化子提取质粒送往上海生工生物工程有限公司进行测序。
1.2.3TOM2B isoform X1基因的生物信息学分析 使用BioEdit软件翻译基因序列为氨基酸序列,用ProtParam预测酶的理化性质,用ProtScale预测酶的疏/亲水性。使用GOR I软件在线预测酶的二级结构。使用SWISS-MOLD在线预测酶的三级结构。采用WoLFPsort在线预测基因的亚细胞定位。通过软件DNAMAN和Bioedit进行氨基酸序列比对,利用MEGA 5.0软件进行系统进化树的构建。
1.2.4 载体构建 用BamHⅠ/KpnⅠ酶切载体pCambia2301-KY-GFP线性化,酶切反应体系包括2μL 10×K/10×L Buffer、5μL载体质粒、2 μLBamHⅠ/KpnⅠ和ddH2O(至40μL)。酶切产物纯化后与基因(去掉终止密码子TAG)的PCR产物进行重组反应(重组反应试剂盒为Vazyme公司ClonExpress-ⅡOne Step Cloning Kit)。重组连接反应体系(总体积10μL)包括4μL线性化载体、1μL插入片段、2μL 5×CEⅡBuffer、1μL ExnaseⅡ和ddH2O(补足10μL)。重组产物转化大肠杆菌DH5α细胞。挑取PCR阳性的转化子摇菌培养提取质粒送测序。PCR检测和测序引物为插入目的基因两侧的载体序列,分别为35S-F:5′-GACGCACAATCCCACTATCC-3′;GFP-JR:5′-GGGTGAGCTTGCCGTAGGTG-3′。
1.2.5 烟草叶片亚细胞定位 将构建好的载体质粒转入农杆菌GV3101,涂布卡那霉素抗性平板,挑取单克隆于YEB液体培养基在28℃摇床内小摇、大摇培养2 d,菌体4 000 r/min离心4 min,去上清后菌体用10 mmol/L MgCl2(含120μmol/L AS)悬浮液重悬,调整OD600至0.6左右;用无针头的1 mL注射器吸取农杆菌液,从烟草叶片下表皮(背面)压迫注射;将注射完成的烟草植株弱光培养2 d,即可观察;接种2 d后取注射区域的烟草叶片,制作玻片,在激光共聚焦显微镜(FLUOVIEW FV1Oi,OLYMPUS公司)下观察、拍照;同时以空载体转化的农杆菌作为对照重复上述操作。叶绿体荧光信号说明:叶绿体荧光信号激发波长为640 nm,发射波长为675 nm;GFP信号说明:绿色荧光蛋白GFP激发光488 nm,发射光510 nm。
1.2.6TOM2B isoform X1转基因株系PCR检测
烟草叶片用农杆菌侵染后均经过4次筛选/继代,诱导出抗性芽,再转入伸长培养基中。采用PCR方法对再生苗进行鉴定,得到转TOM2B isoform X1基因的烟草株系。PCR扩增体系(共20 μL)包括7μL ddH2O、10μL 2×TaqMaster Mix、1 μL模板DNA、1μL引物1F(10μmol/L)、1μL引物1R(10μmol/L)。PCR反应程序:预变性95℃5 min;变性95℃30 s,退火55℃30 s,延伸72℃60 s,35个循环;最终72℃延伸5 min。
1.2.7TOM2B isoform X1转基因株系和非转基因株系移栽苗的病毒接种和光合指标检测 培养3个月后,取含烟草花叶病毒的三叶青试管苗叶片放在研钵中,加入适量磷酸缓冲液研磨成糊状病样汁液;然后在TOM2B isoform X1转基因阳性株系和阴性株系移栽苗幼嫩的叶面上撒少许等量金刚砂,蘸取含烟草花叶病毒的烟草试管苗等量病样汁液在撒了金刚砂的叶面上轻抹3次(模拟蚜虫的病毒田间传播),之后用无菌水清洗叶面;然后放入智能人工气候室内浇灌MS液体培养基培养;2个月后采用林国卫等[4]的方法对三叶青烟草花叶病毒在TOM2B isoform X1转基因阳性株系和阴性株系的表达量进行qRT-PCR检测,同时采用Li-6400便携式光合测定仪(LI-COR公司,美国)测定TOM2B isoform X1转基因阳性株系和阴性株系移栽苗的光合参数和叶绿素荧光参数。所有数据表示为平均值±标准差,并使用SPSS19.0软件进行统计分析,应用单因素方差分析(one-way ANOVA)检验差异显著性(P<0.05)。
1.2.8TOM2B isoform X1基因的组织表达分析
分别取怀玉山三叶青两个栽培种‘怀玉1号’和‘怀玉2号’试管苗的根、茎、叶RNA 500 ng,反转录为cDNA。荧光定量PCR(qRT-PCR,SYBR Green I)检测内参基因为GAPDH,其扩增引物为:F:5′-ACACTTGGCATCTGCTCC-3′;R:5′-TCCGTTCAATCCACCTCC-3′。qRT-PCR检测采用20μL反应体系,PCR反应程序:预变性95℃10 min;变性95℃10 s,退火延伸51℃34 s,95℃15 s,40个循环。使用2-△△Ct法计算基因表达水平,重复3次。所有数据表示为平均值±标准差,并使用SPSS 19.0软件进行统计分析,应用单因素方差分析(one-way ANOVA)检验TOM2B isoform X1基因组织表达的差异显著性(P<0.05)。
2 结果与分析
2.1 怀玉山三叶青TOM2B isoform X1基因克隆
通过PCR扩增及测序(图1),怀玉山三叶青TOM2B isoform X1基因cDNA总长度为432 bp(图2),G+C含量为50.46%(图3)。

图1 怀玉山三叶青TOM2B isoform X1基因扩增

图2 怀玉山三叶青TOM2B isoform X1基因序列

图3 怀玉山三叶青TOM2B isoform X1基因各碱基的比例
2.2 怀玉山三叶青TOM2B isoform X1氨基酸序列特征
ProtParam预测(图4)显示怀玉山三叶青TOM2B isoform X1由143个氨基酸组成,分子量15 392.36 Da,等电点7.87,为亲水性蛋白。各氨基酸的数目和比例为Ala(A)14和9.8%,Arg(R)7和4.9%,Asn(N)7和4.9%,Asp(D)3和2.1%,Cys(C)2和1.4%,Gln(Q)11和7.7%,Glu(E)10和7.0%,Gly(G)4和2.8%,His(H)5和3.5%,Ile(I)4和2.8%,Leu(L)16和11.2%,Lys(K)7和4.9%,Met(M)5和3.5%,Pro(P)10和7.0%,Ser(S)21和14.7%,Thr(T)10和7.0%,Val(V)7和4.9%。带负电残基(Asp+Glu)总数为13,正电荷残基(Arg+Lys)总数为14。序列的N端为M(Met),C端为S(Ser)。失稳指数(II)为63.56,该蛋白为不稳定蛋白。

图4 怀玉山三叶青TOM2B isoform X1氨基酸序列
对蛋白亲疏水性进行分析(图5),高峰值(正值)的区域表示疏水区域,而负值的“低谷”区域是亲水区域。结果表明,最大疏水值为1.2左右,亲水峰最大值为-3.2左右,平均亲水系数为-0.537,说明该蛋白为亲水性蛋白。
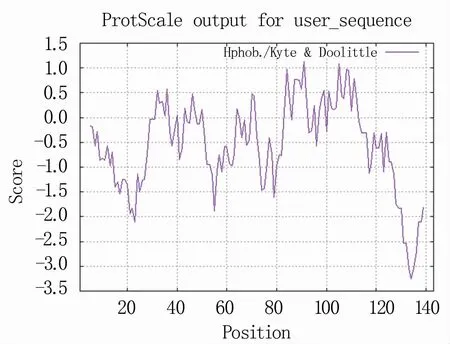
图5 怀玉山三叶青TOM2B isoform X1亲疏水值分布
2.3 怀玉山三叶青TOM2B isoform X1二级结构分析
怀玉山三叶青TOM2B isoform X1的二级结构预测显示其由α螺旋(Hh,50.35%)、β-片层(Ee,2.10%)、无规则卷曲(Cc,47.55%)构成(图6、图7)。从分布位点上来看,C端和N端含无规则卷曲、β-片层和α-螺旋。

图6 怀玉山三叶青TOM2B isoform X1二级结构

图7 怀玉山三叶青TOM2B isoform X1二级结构各部分的比例
SWISS-MODEL预测显示怀玉山三叶青TOM2B isoform X1的三级结构为单体(图8)。

图8 怀玉山三叶青TOM2B isoform X1三级结构
2.4 怀玉山三叶青TOM2B isoform X1亚细胞定位预测
采用WoLFPsort在线软件对怀玉山三叶青TOM2B isoform X1的亚细胞定位进行预测,结果(图9)显示,其定位于细胞核中的分布指数为6,细胞核_质膜中的分布指数为4.5,叶绿体中的分布指数为3,细胞质中的分布指数为2,线粒体中的分布指数为2。表明怀玉山三叶青TOM2B isoform X1主要存在于细胞核。
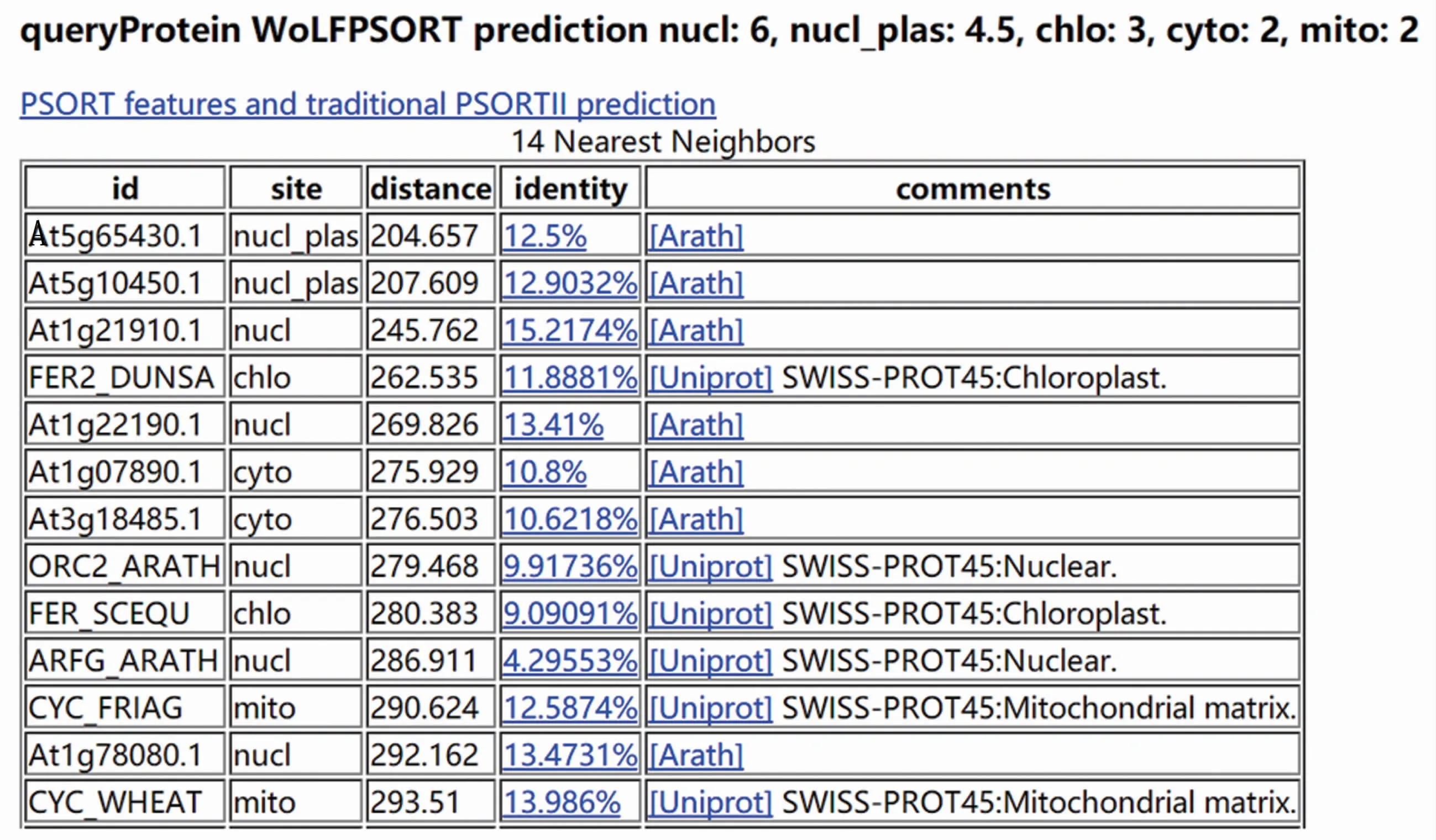
图9 怀玉山三叶青TOM2B isoform X1亚细胞定位预测
2.5 怀玉山三叶青TOM2B isoform X1系统进化分析
通过BLASTP比对,取同源性最高的前15个蛋白进行序列比对及系统进化分析。怀玉山三叶青TOM2B isoform X1同源蛋白的序列比对信息见图10。从构建的进化树(图11)可见,怀玉山三叶青与Populus trichocarpa(毛果杨)、Populus euphratica(胡杨)、Populus alba(银白杨)、Manihot esculenta(南瓜)、Hevea brasiliensis(三叶橡胶)、Prosopis alba(角豆树)、Citrus clementina(克莱门柚)、Citrussinensis(橙子)和Vitis vinifera(葡萄)在一个大分支下,这说明怀玉山三叶青TOM2B isoform X1在进化上与这些蛋白的亲缘关系较近,尤其是与Vitis vinifera(葡萄)TOM2B isoform X1(GenBank:XP_010664025.1)在进化上具有最高的亲缘关系。

图10 怀玉山三叶青TOM2B isoform X1氨基酸序列的同源性比较

图11 怀玉山三叶青TOM2B isoform X1系统进化分析
2.6 怀玉山三叶青TOM2B isoform X1基因目的片段扩增与瞬时表达载体构建
以提供的目的基因序列设计引物(去掉终止密码子TAG)进行PCR扩增,结果显示,在目标位置扩增到单一条带,大小正确(图12)。用BamHⅠ/KpnⅠ酶切载体pCambia2301-KY-GFP线性化,回收后和目的基因片段进行重组反应。重组质粒测序比对结果显示,目的基因已插入载体,表达载体构建准确(图13)。
图12 怀玉山三叶青TOM2B isoform X1 基因载体构建PCR检测

图13 载体pCambia2301-TP2BX1-GFP克隆测序结果比对
2.7 怀玉山三叶青TOM2B isoform X1亚细胞定位分析
通过烟草叶片瞬时表达,TOM2B isoform X1定位于细胞质和细胞核(图14),与WoLFPsort在线软件预测结果基本一致。

图14 怀玉山三叶青TOM2B isoform X1亚细胞定位分析
2.8 怀玉山三叶青TOM2B isoform X1转基因烟草鉴定和光合特征分析
经PCR检测(图15),获得怀玉山三叶青TOM2B isoform X1转基因阳性烟株。三叶青TMV的qRT-PCR结果(图16)表明,烟草花叶病毒侵染后,怀玉山三叶青TOM2B isoform X1转基因阳性植株根、茎、叶的TMV表达量显著高于转基因阴性烟株。光合生理的测定结果(表1)表明,与转基因阴性烟株相比,怀玉山三叶青TOM2B isoform X1转基因阳性烟草的净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)、最大光化学效率(Fv/Fm)、实际光化学量子效率(ΦPSⅡ)、光化学淬灭系数(qP)及电子传递效率(ETR)显著下降,而非光化学淬灭系数(NPQ)显著上升。

图15 怀玉山三叶青TOM2B isoform X1 转基因烟草PCR检测

图16 怀玉山三叶青TOM2B isoform X1转基因阳性植株与阴性植株的TMV基因相对表达量

表1 怀玉山三叶青TOM2B isoform X1转基因阳性植株与阴性植株光合参数和叶绿素荧光参数比较
2.9 怀玉山三叶青两个栽培种不同器官中TOM2B isoform X1基因的表达分析
实时荧光定量PCR分析结果(图17)显示,TOM2B isoform X1基因在怀玉山三叶青两个栽培种的根、茎、叶中均有表达,但在不同器官中表达量差异显著,均在叶中表达量最高。

图17 怀玉山三叶青两个栽培种不同器官中TOM2B isoform X1基因相对表达量
3 讨论与结论
烟草花叶病毒侵染宿主后,需要依靠宿主内一些病毒增殖蛋白(如TOM1、TOM2和TOM3)才能完成其自身的复制[9]。研究表明,TOM1、TOM2A、TOM2B以及TOM2B isoform X1、TOM2B isoform X2和TOM2B isoform X3同源性较高[10]。本研究结果也表明,怀玉山三叶青TOM2B isoform X1在进化上与Populus trichocarpa(毛果杨)、Populus euphratica(胡杨)、Populus alba(银白杨)、Manihot esculenta(南瓜)、Hevea brasiliensis(三叶橡胶)、Prosopis alba(角豆树)、Citrus clementina(克莱门柚)、Citrus sinensis(橙子)和Vitis vinifera(葡萄)在一个大分支下,这说明怀玉山三叶青TOM2B isoform X1在进化上与他们的亲缘关系较近,尤其是与Vitis vinifera(葡萄)TOM2B isoform X1(GenBank:XP_010664025.1)在进化上具有最高的亲缘关系。说明三叶青TOM2B isoform X1基因具有保守性,这些保守区段的发现将为其他物种新的三叶青TOM2B isoform X1基因的克隆提供序列依据。
本研究结果表明,怀玉山三叶青TOM2B isoform X1基因cDNA总长度为432 bp,G+C含量为50.46%,编码143个氨基酸,分子量15 392.36 Da,等电点7.87,为亲水性蛋白。从碱基组成和G+C含量基本平衡来看,G+C的含量越高,基因稳定性越高,三叶青TOM2B isoform X1基因基本处于稳定状态,这可能为三叶青TOM2B isoform X1基因稳定遗传与进化提供了保证。
研究表明,拟南芥TOM1、TOM2和TOM3基因均编码跨膜蛋白,主要与TMV复制蛋白中的螺旋酶相互作用,帮助复制酶复合体锚定在内质网膜或液泡膜等高密度生物膜上[11]。本试验通过软件预测怀玉山三叶青TOM2B isoform X1主要存在细胞核中;而通过烟草叶片亚细胞定位分析表明,TOM2B isoform X1定位于细胞质和细胞核中,与前人的研究结果一致。
与液泡膜相关的宿主蛋白TOM1、TOM2和TOM3是烟草病毒高效增殖所必需的[12]。本试验结果表明,在怀玉山三叶青烟草花叶病毒侵染后,怀玉山三叶青TOM2B isoform X1转基因阳性烟株根、茎、叶的TMV表达量显著高于转基因阴性烟株。表明怀玉山三叶青TOM2B isoform X1可以促进怀玉山三叶青烟草花叶病毒的增殖。
马铃薯TOM基因在马铃薯营养器官和生殖器官具有组织特异性[9]。本试验结果也表明,怀玉山三叶青TOM2B isoform X1基因在根、茎、叶中均有表达,但在不同组织器官的表达情况差异显著,‘怀玉2号’和‘怀玉1号’均在叶中表达量最高。表明怀玉山三叶青TOM2B isoform X1基因主要的表达位置在叶片。
植物感染病毒后会导致种性退化、产量下降、品质变劣,其根本原因是病毒的侵染造成植物光合效率显著下降[13]。本试验结果表明,与转基因阴性烟草相比,怀玉山三叶青TOM2B isoform X1转基因阳性烟草的净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)、最大光化学效率(Fv/Fm)、实际光化学量子效率(ΦPSⅡ)、光化学淬灭系数(qP)及电子传递效率(ETR)显著下降,而非光化学淬灭系数(NPQ)显著上升,表明怀玉山三叶青TOM2B isoform X1通过怀玉山三叶青烟草花叶病毒增殖继而影响植株的光合作用,这是植物产量下降、品质变劣的根本原因。
本研究首次从怀玉山三叶青基因组中克隆出TOM2B isoform X1基因,并对克隆的基因序列和其氨基酸序列进行了生物信息学分析、亚细胞定位以及功能和组织表达分析,为三叶青烟草花叶病毒增殖的研究补充了基础资料。
