Goodpasture综合征1例*
2021-09-12牛垚飞陈伟霞吴贺文
牛垚飞,陈伟霞,陈 宁,吴贺文△
(1.河南省人民医院感染ICU,郑州 450003;2.河南省中医院肿瘤科,郑州 450000)
Goodpasture 综合征是一种影响肾和肺毛细血管床的小血管血管炎。它是针对肾小球和肺泡基底膜的自身抗体介导的自身免疫疾病,与快速进行性肾小球肾炎和肺泡出血有关[1,2]。自1919 年Ernest Goodpasture 首次报道了1 例患者在流感后咯血、贫血而死亡的病例之后[3],陆续有相关病例报道。河南省人民医院感染ICU 于2019 年1 月27 日收治Goodpasture综合征1例,现将该例患者的诊治情况报道如下。
1 病例简介
患者,男,48岁,油田工人,体重90 kg,身高175 cm。以“咳嗽、咳痰2月,咯血1个月,加重1 d”为代主诉于2019年1月27日急诊入院。2个月前因受凉后出现咳嗽、咳黄白色痰,于当地卫生院以“上呼吸道感染”治疗,症状较前减轻;1 个月前无明显诱因出现痰中带血,色鲜红,未予重视治疗,咯血逐渐增多,夜间间断胸闷,伴双下肢水肿,活动后加重,休息后减轻,小便茶色,自觉活动耐力下降;1 d前症状逐渐加重,查胸部CT 示:双肺渗出性病变,考虑肺出血、肺水肿可能;双侧胸腔积液(图1)。急诊转送至我院,以“(1)肺部感染、呼吸衰竭;(2)咯血查因;(3)2 型糖尿病”为诊断收入我科。既往2 型糖尿病病史10 年,空腹血糖最高17 mmol/L,平素口服“二甲双胍、瑞格列奈”降糖,血糖控制可。
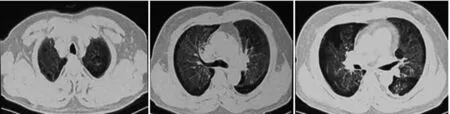
图1 院外胸部CT表现
体格检查:体温37.2 ℃,脉搏107 次/min,呼吸32次/min,血压21.1/13.7 kPa;查体:双眼睑水肿,呼吸急促,双下肺呼吸音弱,局部闻及湿啰音;双肾区叩击痛(-),双下肢轻至中度凹陷性水肿。实验室检查:血气分析:pH 7.426,PaO27.41 kPa,PaCO24.14 kPa,SB 20 mmol/L,BE-3.8 mmol/L,Lac 0.96 mmol/L;急诊血常规+CRP:白细胞6.83×109/L,中性粒细胞计数6.51×109/L,中性粒细胞百分比95.4%,淋巴细胞计数0.26×109/L,血红蛋白71.0 g/L,血小板165×109/L,C-反应蛋白130.16 mg/L;
尿常规:尿蛋白+++,隐血试验+++,尿糖++,白细胞计数101.50/μL,红细胞计数138.30/μL;血脂:甘油三酯3.06 mmol/L;肾功能:血尿素8.7 mmol/L,血清肌酐145 μmol/L。抗肾小球基底膜(GBM)抗体弱阳性,GBM抗体29.21 RU/mL。
肾活检病理:肾小球:荧光染色IgG++,C1q+,弥漫分布,呈线状沉积于血管袢,IgA+、IgM+、C3++,弥漫分布,呈颗粒状沉积于系膜区及血管袢;肾小管:IgG小管基膜沉积;血管壁:C3、C1q间质血管壁沉积;管型:阴性,见图2。光镜小结:(1)肾小球结节样病变,电镜下GBM 增厚。(2)肾小球新月体(7/29)形成,肾组织IgG 沿GBM 及少数TBM 多克隆沉积,抗GBM抗体低滴度阳性,建议随访观察GBM滴度,必要时重复活检。
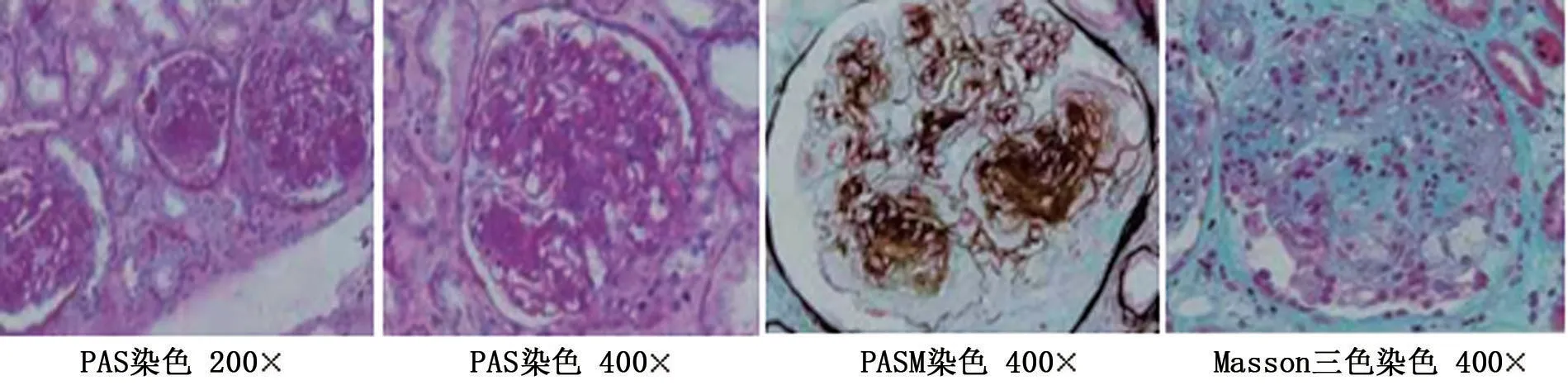
图2 肾穿刺活检病理
诊断:(1)Goodpasture综合征;(2)2型糖尿病、糖尿病肾病;(3)肺部感染、Ⅱ型呼吸衰竭;(4)高血压3级。
治疗:(1)气道管理:气管插管、呼吸机辅助、口护、雾化、气管镜检查及治疗;(2)原发病控制:血浆置换14次,每次1 500 mL 普通冰冻血浆(A型,血库血浆不足,故每次1 500 mL),并予丙种球蛋白20 g,1 次/d,静滴,连用5 d,甲泼尼龙连续冲击3 d(500 mg/d),3 d(240 mg/d),3 d(120 mg/d),3 d(80 mg/d),之后继续甲泼尼龙40 mg/d维持;(3)抗感染,容量管理,营养支持,保肝、护胃等对症处理。经过上述治疗后,生命体征平稳,一般情况明显改善,顺利脱机拔管;2019年2月17日患者出现寒战、高热,立即抽取血培养、尿培养,均提示肺炎克雷伯菌,属CRE(耐碳青霉烯类肠杆菌科细菌),考虑反复留置尿管,尿路感染后入血,根据药敏结果,更改为“复方磺胺甲噁唑片3片,3次/d,口服;替加环素100 mg,1次/12 h,静滴;磷霉素4 g,1次/8 h,静滴”抗感染治疗,后患者体温、炎性指标恢复正常,并间断行血培养、痰培养、尿培养均未见异常;2019年3月22日患者病情稳定,复查GBM抗体1.34 RU/mL,复查胸部CT 提示双肺感染性病变,较前明显吸收(图3),转至肾内科继续治疗。
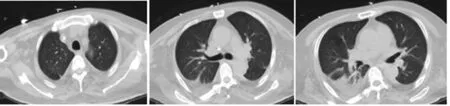
图3 治疗后胸部CT表现
2 讨论
Goodpasture综合征病因机制不明,以临床表现及实验室检查作为诊断标准,肾穿刺活检更有诊断学意义,多诱发呼吸衰竭、大咯血、急性肾衰竭等症状,后期可出现重症感染、尿毒症等,治疗策略基本相同,远期预后差。
本文患者为中年男性,长期油田工作,有吸入某些化学性物质(挥发性烃化物),如汽油、油漆等吸入史,其发病时间在冬春流感高发季节[4]。患者以咯血、咳嗽、呼吸困难、乏力,并见双下肢水肿,活动后加重为临床表现,院外影像资料提示两肺可见斑片状、片状高密度影,由肺门向肺野散布,外带未见受累,考虑肺出血、肺水肿;实验室检查提示血尿、蛋白尿。查阅相关文献,需要警惕是否患有Goodpasture 综合征,检查时更有侧重性,于是在患者入院第2 天查抗GBM 抗体弱阳性,后急查GBM抗体29.21 RU/mL;参考“肺出血+急性肾小球肾炎+抗GBM 抗体阳性和(或)肾脏活检免疫荧光检查所见的IgG 线性沉积作为Goodpasture 综合征(GS)的诊断标准[1-2]”,早期给予明确诊断。在治疗上给予行多次血浆置换,有效清除血中致病抗体缓解病情,配合应用皮质类固醇激素及人免疫球蛋白,以减少抗体生成及抑制肺、肾炎症[3-6];考虑患者炎症指标较高,未给予免疫抑制剂。经过治疗后,该患者的病情明显缓解,GBM抗体持续转阴。但患者免疫功能较差,易合并其他感染的产生,当患者出现感染后,根据药敏结果,及时采取措施,使患者逐渐度过危险期。此外,患者容量管理极为重要,此类患者肾功能未能完全恢复,常出现蛋白尿、血尿,导致低蛋白血症,引起组织水肿、器官缺血,通过补充白蛋白,血液透析,使液体负平衡是治疗的重中之重。
根据临床表现,通过早期测定抗GBM 抗体有助于诊断Goodpasture 综合征。肾或肺活检是确诊的金标准,免疫荧光显示以补体C3 与IgG 特征性的线性沉积于肾小球基底膜或肺泡壁[7-8]。致病抗原存在于肺泡壁,电镜检查可见肺泡间隔坏死断裂,出现弥漫性肺泡出血,反复出血后出现肺间质炎性细胞浸润,导致肺纤维化,发病初期多见痰中带血,病情进展后可出现大咯血,严重者窒息死亡;致病抗原存在于肾小球基底膜、肾小管基膜、肾小囊基膜,电镜检查常见GBM 断裂,从而出现线状免疫复合物性新月体肾炎[7-8],表现为蛋白尿、血尿、水肿及高血压,多数患者遗有永久性肾损害。
Goodpasture 综合征的治疗方法主要推荐强化血浆置换或免疫吸附治疗,以有效清除血中致病抗体,同时,肾上腺皮质激素(甲强龙)联合免疫抑制剂(环磷酰胺)抑制自身免疫反应[9]。根据临床病程的严重程度,一些患者将需要长期使用免疫抑制剂治疗长达6~12个月。此外,治疗重度和(或)难治性抗GBM病可加入利妥昔单抗[10];对肾功能无法逆转的患者,需长期维持透析;肾移植应在抗GBM抗体转阴,病情相对稳定后半年进行[11]。总之,早期诊断,强化血浆置换,关注患者并发症,及时控制感染,加强营养,保证容量负平衡,是改善预后,增加生存时间最有效的方法。
