长链非编码RNA和微小RNA相互作用参与调控肝细胞癌发生和发展的研究进展*
2021-09-12郑西特彭歆瑞
郑西特,彭歆瑞,何 晓
(桂林医学院,桂林 541100)
相关统计报告显示,原发性肝癌(primary liver cancer,PLC)的发病率位居世界第6,病死率居第4,全世界每年新增病例约84.1 万,死亡病例约78.2万,其发病率和病死率呈逐年上升趋势[1-2]。PLC中75%~85%为肝细胞癌(hepatocellular carcinoma,HCC),晚期HCC患者5年存活率不超过5%[3],这与早期发现诊断率不高、治疗手段单一有关。近年来,随着高通量测序技术的发展,大量非编码RNA(non-coding RNA,ncRNAs)被发现在细胞的生命调控过程中扮演着十分重要的角色。ncRNAs包括长链非编码RNA(lncRNAs)、微小RNA(microRNAs)和环状RNA(circularRNAs),可以通过调控转录过程、转录后过程和翻译后过程来控制特定的基因表达程序,涉及几乎所有的生命活动过程,如增殖、衰老、静止、分化、凋亡以及应激和免疫反应等[4]。随着对HCC 研究的深入发展,大量研究结果显示,lncRNAs、microRNAs 及两者相互作用在HCC 的发生、发展中发挥着重要的作用。本文通过检索近期有一定影响力的文章,综合分析lncRNAs、microRNAs相互作用参与调控HCC发生发展的研究进展,为今后HCC临床诊断和治疗提供新思路。
1 LncRNAs、microRNAs
LncRNAs是一类长度在200个核苷酸以上的非编码RNA,占全部ncRNA的80%~90%,数量庞大,为mRNA的3~100倍。LncRNAs是以RNA形式在多种层面上调控基因的表达,通常情况下其表达水平较低,可利用帽子结构和多聚A 尾进行拼接,但缺乏开放读框,所以lncRNA 本身并不具备翻译蛋白质的功能,而是在RNA水平上,参与基因组印记、染色质修饰、基因表达、细胞周期、核内运输等过程的调控[5]。LncRNAs 的作用机制多样,能在调节机体各种生物学过程中扮演多种角色,如分子诱饵、分子向导、分子支架以及信号通路的调节剂等[6]。同时lncRNAs 也在多种癌症表达异常,相关研究提示它的异常表达与miRNA、mRNA 的表达存在联系,影响着多种癌症的发生发展[7]。
MiRNAs 作为一类长度约18~24 个核苷酸的微小非编码RNA,也是一种表观遗传因子,由独立的非编码区RNAs或蛋白编码基因的内含子转录产生,能参与调节许多重要的生物学过程以及基因的表达[8]。大量研究表明,miRNAs在多种人类癌症的发生发展中扮演着双重角色,既可以扮演促癌基因,又可以扮演抑癌基因,能够参与调控肿瘤细胞的增殖、侵袭、迁移、血管生成、细胞周期进展、细胞凋亡和自噬等功能[9]。
2 LncRNAs 和microRNAs相互作用参与调控HCC的发生发展
LncRNAs、miRNAs 等非编码RNAs 参与生理病理过程的作用机制不断被研究,其中它们之间相互作用参与调控HCC 的发生发展的作用机制已逐渐成为研究热点,最受关注的理论应该是ceRNA调控网络,即竞争内源性RNAs(competitive endogenous RNAs,ceRNAs)假说。该假说认为,lncRNAs可通过miRNA 反应元件竞争性地与miRNA 结合,从而减少miRNAs 与mRNAs 的结合,以此来调节miRNAs 下游靶基因的表达水平,反之miRNAs 也可以通过相应途径调节lncRNAs 的表达水平[10]。LncRNAs 与miRNAs 相互之间的竞争内源性,也称为相互竞争的内源海绵。很多研究通过研究lncRNAs 与miRNAs 的调控关系来揭示非编码RNA的功能。
2.1 抑制HCC的发生发展
2.1.1 LncRNA MIR31HG 与miR-575 已发现lncRNA MIR31HG与几种癌症的进程有关联,在不同情况下可充当致癌因子或抑癌因子[11]。在HCC 相关研究中,Yan 等[12]通过体内、外实验检测lncRNA MIR31HG 对HCC 细胞增殖和转移的影响,发现MIR31HG 的过表达可明显抑制HCC 增殖和转移;双荧光素酶报告实验和免疫沉淀实验显示,MIR31HG 通过MIR31HG/miR-575/ST7L 通路的作用发挥肿瘤抑制功能,说明MIR31HG和miR-575在HCC中可能存在相互抑制形成RNA诱导沉默复合体(RNA-induced silencing complex,RISC)。对MIR31HG/miR-575的共表达情况研究和应用,也许能为肝癌的诊断和治疗带来益处。
2.1.2 LncRNA CASC2与miR-24和miR-221
Cancer Susceptibility Candidate 2(CASC2)是一种在多种癌症类型中下调的lncRNA,包括胶质瘤、乳腺癌及肝细胞癌等,可通过多种机制发挥抑制肿瘤的作用[13]。Jin 等[14]在HCC 的研究中发现,lncRNA CASC2 能够竞争性结合miR-24 和miR-221,通过CASC2/miR-24/caspase 3 和CASC2/miR-221/caspase 8 两条通路降低HCC 细胞对肿瘤坏死因子(TNF)相关细胞凋亡诱导配体(TRAIL)的抵抗,以提高TRAIL 疗法的治疗效率。TRAIL 通过死亡受体和下游死亡诱导信号复合物的形成,选择性诱导肿瘤细胞凋亡,激活caspases 3/8,导致细胞凋亡。TRAIL属于TNF超家族成员之一,能选择性诱导肿瘤细胞、转化细胞凋亡,对人体正常组织无毒,在肿瘤治疗方面具备良好的应用前景[15]。然而,简单直接使用TRAIL 疗法很容易引起肝细胞癌细胞的耐药性,限制了其作为治疗手段的应用。Jin等[14]研究结果有望为如何提高肝癌的治疗效果、降低抗药性带来新的方法。
2.1.3 LncRNA 01093 与miR-96-5p LINC01093为HCC 组织中显著下调的lncRNA 之一,其表达下调与不良预后相关[15]。有学者使用基因表达分析交互分析(GEPIA)患者lncRNA和mRNA的表达,发现LINC0109主要作为miR-96-5p的ceRNA发挥作用,两者在HCC 中呈负相关关系,并通过LINC01093/miR-96-5p/ZFAND5/NF-κB 途径发挥肿瘤抑制功能[16-17]。ZFAND5是ZFAND家族的成员,研究表明,ZFAND5通过激活泛素—蛋白酶体系统来增强蛋白质降解[18]。而NF-κB信号传导是ZFAND5的一个重要的下游途径,对肿瘤的增殖进行调控。lncRNAs通过调控microRNAs对HCC的发生、发展产生抑制作用,见表1。
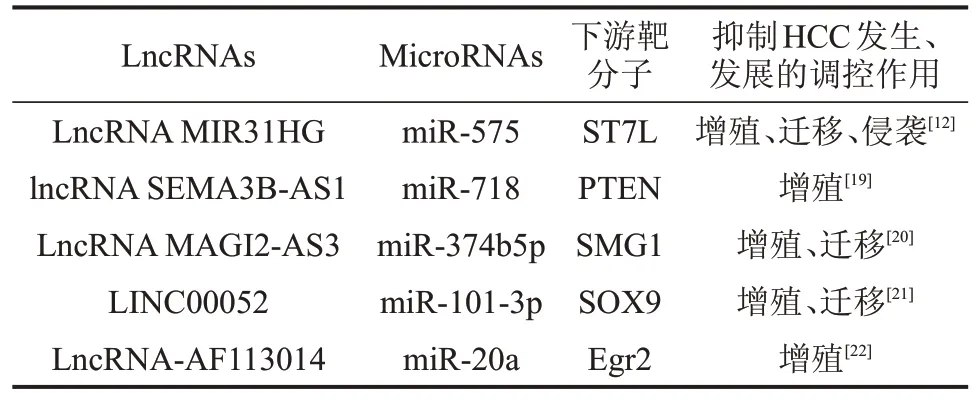
表1 lncRNAs和microRNAs相互竞争抑制HCC发生、发展
2.2 促进HCC的恶性进展
2.2.1 LncRNAHOXA-AS2与miR-520c-3p HOXA簇反义RNA 2(HOXA-AS2),是一种位于人HOXA3和HOXA4基因之间的反义lncRNA,多方报道显示其在乳腺癌、胃癌、肝癌等癌症中均存在差异表达情况,今后很可能成为癌症的可行的生物标志物或治疗的靶点[23]。Zhang 等[24]研究显示,lncRNA HOXA-AS2 在HCC 组织和细胞中表达上调,沉默HOXA-AS2 则会抑制HCC 细胞的增殖并导致细胞凋亡,过表达HOXA-AS2 则使肝癌细胞生长迅速,并促进肝癌细胞的迁移和侵袭,提示HOXA-AS2可能为HCC 的促进因子。进一步研究显示,lncRNA HOXA-AS2 在HCC 的发展过程中与miRNA-520c-3p 竞争性结合,并通过HOXA-AS2/miR-520c-3p/GPC3 通路促进肝癌生长。如何有效调控lncHOXA-AS2/miRNA-520c-3p 的共表达以达到治疗HCC的目的将是值得深入研究的课题。
2.2.2 LncRNA DLX6-AS1与miR-513c和miR-424-5p 近期有研究提示,lncRNA DLX6-AS1很可能扮演促癌基因的作用,通过调控多条信号通路参与HCC 的发生发展。在Liu 等[25]研究发现,LncRNA DLX6-AS1、Cul4A在HCC组织和细胞中呈高表达,而miR-513c 呈低表达。在HCC 细胞中沉默LncRNA DLX6-AS1 的表达后,miR-513c 呈高表达;LncRNADLX6-AS1 沉默后能够降低HCC 细胞增殖、侵袭和迁移能力,并能促进HCC细胞凋亡。LncRNA DLX6-AS1/miR-513c/Cul4A连轴作用方式很可能参与调控HCC的恶性进展。
与miR-513c相似,在恶性肿瘤中DLX6-AS1与miR-424-5p 亦呈负相关关系,很可能通过DLX6-AS1/miR-424-5p/WEE1 通路参与调控肝癌的恶性进展。有研究表明,上调DLX6AS1 通过靶向miR-424-5p 可增加WEE1 的表达,而WEE1 作为一种调节G2-M过渡的核激酶,可促进肝癌细胞增殖、侵袭和迁移[26]。此外,研究证明沉默DLX6-AS1 会降低CD133、CD13、OCT-4、SOX2 和Nanog 癌症干细胞标志物的表达水平,这些标志物均与癌症的肿瘤发生呈正相关关系[27]。
2.2.3 LncRNA HULC 与miR-2052、miR-372、miR-29 LncRNA HULC 在癌症发生过程中发挥着积极作用,HULC在HCC组织中的过表达可能与HCC患者的不良预后有关;HULC可能通过HULC/miR-2052/MET 轴调节HCC 中miR-2052 的下游靶标受体络氨酸激酶MET,以促进HCC细胞增殖、迁移和侵袭以及移植肿瘤的生长[28]。
另有研究显示,OSER1-AS1基因与肝癌细胞的增殖、侵袭和迁移及诱导细胞凋亡有关,双荧光素酶报告基因实验直接证明了OSER1-AS1作为miR-372-3p 的分子海绵促进Rab23 的表达[29]。刘远光等[30]研究发现,HULC 在肝癌组织和肝癌细胞中呈高表达,RT-qPCR结果表明,在肝癌MHCc-97L细胞中,高表达HULC 使CXCR4 基因上调,而过表达miR-372使CXCR4基因下调;而在肝癌HepG2细胞中呈现相反的结果,提示HULC 和miR-372 的表达呈负相关关系。
miR-29 很可能在HCC 的发生和发展中通过抑制肿瘤的生长和转移而发挥抑癌基因的作用[31]。朱李茹等[32]在研究中也观察到,与癌旁组织或正常干细胞比较,HULC 在HCC 组织和细胞中均呈高表达,而miR-29均呈低表达,两者在HCC样本中呈负相关关系。肝癌Huh7细胞过表达HULC后,用RTqPCR法检测miR-29及其靶基因SETDB1 mRNA的表达,与空白对照组比较,转染pcDNA/HULC 组Huh7 细胞中miR-29 的表达量明显降低,SETDB1 mRNA 表达升高。Hep3B 细胞沉默HULC 的表达后,miR-29 的表达明显升高,SETDB1 表达降低。上述研究提示,在HCC 细胞中HULC 可抑制miR-29的表达,两者的表达呈负相关关系。
由此可知,HULC 与上述3 种microRNAs 的表达在HCC 中均呈负相关关系。miR-2052 通过激酶作用于靶细胞促进HCC 进展。而miR-372、miR-29则通过靶基因发挥促癌作用。lncNAs通过作用microRNAs对HCC的发生、发展产生促进作用,见表2。
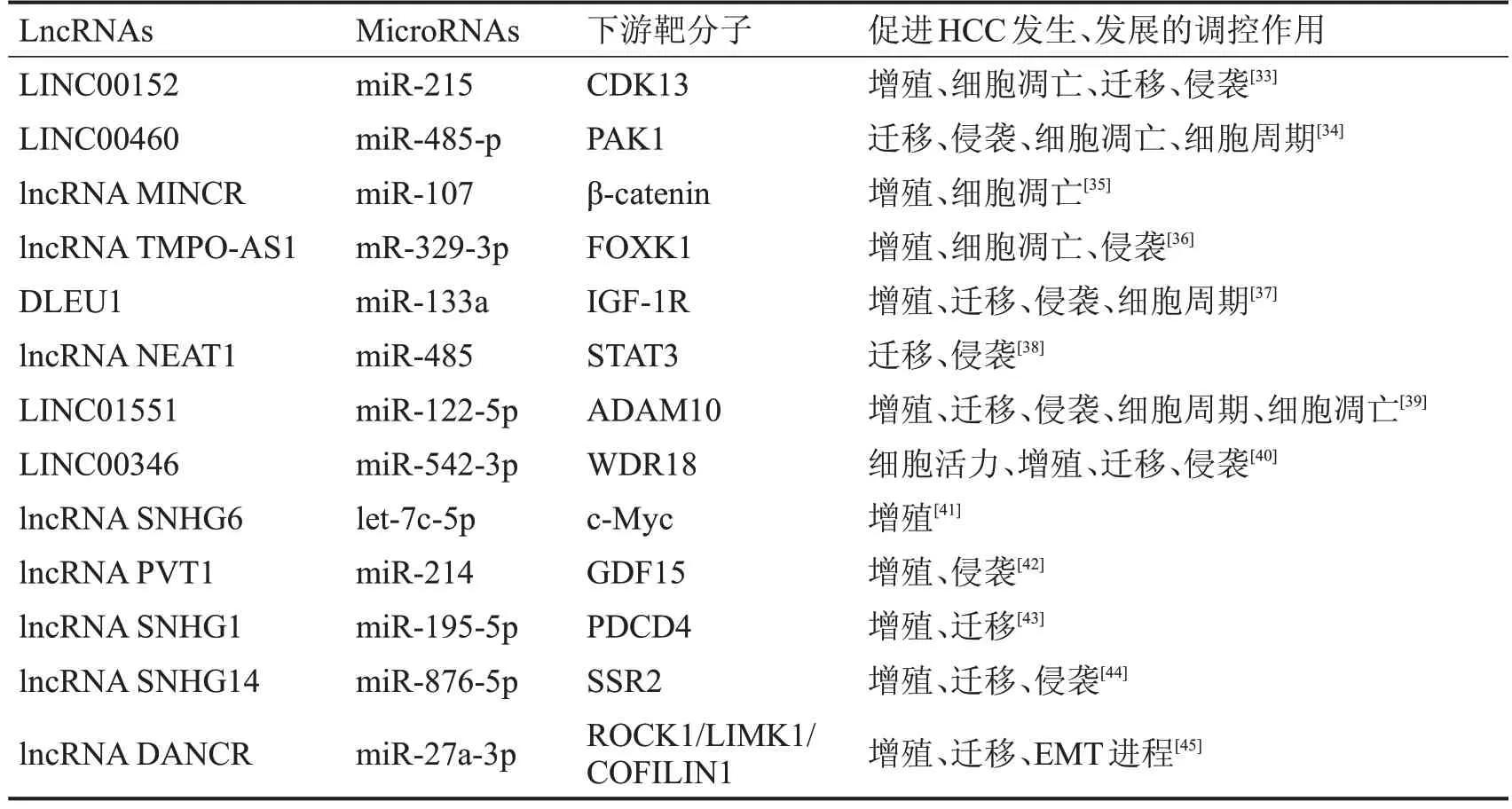
表2 lncRNAs和microRNAs相互竞争促进HCC的恶性进展
3 结语
HCC 严重危害人类健康,ncRNAs 在其发生发展中通过调控基因表达而发挥重要的作用。近年来,许多研究发现,无论是miRNAs、lncRNAs 的独立作用还是相互作用,在信号传导、细胞代谢、增殖、分化、凋亡等重要过程中扮演重要的角色,既可能起到促癌基因的作用又可能起到抑癌基因的作用。但现在对ncRNA在HCC发生发展的分子调控机制的研究成果十分有限,仍需要进一步的研究和探索。
