吉非替尼治疗非小细胞肺癌患者表皮生长因子受体突变的疗效及与Ki-67表达的关系
2021-09-10武卫红李琼洁史梦圆
武卫红,李琼洁,徐 晶,史梦圆
(1.平顶山市第一人民医院药学部,平顶山 467000;2.郑州大学第一附属医院肿瘤科,郑州 450000)
肺癌已成为全球发病率和致死率最高的肿瘤疾病,占所有肿瘤疾病的12.4%,其中85% 属于非小细胞肺癌(NSCLC)[1]。靶向治疗能提高NSCLC患者的生存率,已成为主要治疗手段[2-3]。NSCLC患者中有50%~80% 表皮生长因子受体(EGFR)表达阳性[4]。EGFR活化后与其配体(表皮生长因子、转移生长因子α等)结合激活酪氨酸激酶区域,从而导致多条信号通路开启[5],促进肿瘤细胞的增殖、分化、迁移及死亡。吉非替尼(易瑞沙)是由阿斯利康首先研发而成的EGFR分子靶向药物,于2003年批准用于治疗NSCLC。Ki-67属于细胞增殖相关蛋白,在静息细胞中不表达,仅在增殖细胞中高度表达,研究发现其表达水平与多种肿瘤有关,可用于肿瘤诊断和预后预测[6-7]。本研究通过吉非替尼治疗NSCLC患者EGFR突变的疗效及其与Ki-67表达的关系研究,探究Ki-67的表达是否与吉非替尼疗效存在相关性,旨在为NSCLC临床治疗提供参考。
1 资料与方法
1.1一般资料 选取经病理诊断为NSCLC并进行EGFR突变检测的94例患者,其中男性58例,女性 36例,年龄为45~78岁,平均(53.47±5.69) 岁。通过胸水、痰液、支气管镜、穿刺活检等获取标本进行细胞学检查,根据病理类型进行分组:其中腺癌61例,鳞癌33例;有吸烟史69例,无吸烟史25例;年龄<60岁36例,≥60岁58例;肿瘤位置分类:周围型44例,中央型50例;按肿瘤分化程度分类:中高分化56例,低分化38例;肿瘤直径≥3 cm 39例,直径<3 cm 55例,73例发生淋巴结转移,21例未发生淋巴结转移。根据国际通用肿瘤(TNM)分期标准[8],Ⅲ期57例,Ⅳ期37例。本研究经过医院伦理委员会批准且所有患者签署知情同意书。纳入标准:①病理组织学或细胞学确诊为NSCLC者;②抗肿瘤治疗前进行脑CT或MR、胸部CT扫描、腹部CT或B超,全身ECT骨扫描检查或PET-CT进行肿瘤基线评估者;③研究前未接受任何化疗或放疗等手段进行抗癌治疗者;④有可测量的局部病灶或转移病灶者;可以得到能够进行基因分析的肿瘤组织者;⑤年龄>18岁者;体力状况(ECOG)评分为0~3分者。排除标准:①病理诊断组织学分类不清者:②伴有其他肿瘤者;③病理诊断为小细胞肺癌者;④精神障碍患者;⑤研究过程中病历资料缺失或中途退出研究者。
1.2治疗方法
1.2.1EGFR突变检测方法 所有试验检测均在河南省肿瘤医院血液肿瘤病实验室进行。对标本采集和评估后,进行DNA抽提和质控,采用测序法进行检测:引物自行设计,经上海生物公司合成,通过巢式PCR扩增EGFR基因的18~21外显子,进行PCR产物测序和基因突变分析,各蛋白引物见表1。DNA提取、PCR和序列分析具体操作:通过活检或者灌洗液获得治疗前的肿瘤组织标本,通过固定、脱水、石蜡包埋后切片,制成5 μm的样本。另取新鲜组织50 mg,根据Trizol提取试剂盒,提取组织DNA,通过巢式PCR法扩增EGFR的18~21外显子片段。PCR反应条件为:94 ℃,2 min 30 s;94 ℃,30 s;55 ℃,30 s;68 ℃,30 s,30个循环。

表1 18~21外显子引物设计
1.2.2Ki-67含量表达检测 取肿瘤标本后用体积分数为10%的甲醛固定,脱水后进行石蜡包埋,切片4 μm样本,HE染色和DAB染色,用双蒸水洗涤。用中性树胶封片。由经验丰富的病理科医师随机抽取薄片,在每张切片中选5个高倍视野,每个视野计数100 个细胞,Ki-67表达阳性为细胞核为棕色颗粒。Ki-67 阳性表达强度表示如下:(1)-:阳性细胞数占总数小于5%;(2)+:阳性细胞数占总数5%~25%;(3)+ +:阳性细胞数占总数26%~50%;(4)+++:阳性细胞数占总数>50%。阳性率=(+~+++细胞数)÷总数×100%。免疫组化检测试剂盒购自北京中杉金桥公司。
1.2.3吉非替尼靶向治疗 入选患者均采用靶向药物吉非替尼(易瑞沙,规格:0.25 g,阿斯利康有限公司)治疗。给药剂量为每次250 mg,每日1次,直至患者不耐受或肿瘤进展而终止治疗。用药时间最短为3个月,最长达10个月。纳入研究的患者在治疗期间均不采用其他抗肿瘤药物或其他手段治疗,治疗期间记录详细病程。
1.3观察指标 依据实体瘤治疗疗效评价标准-RECIST[9]进行疗效评价,所有肿瘤检测、肿瘤病灶大小基线资料在治疗前5 d完成。临床疗效评价如下:①完全缓解(CR):所有病灶消失;②部分缓解(PR):基线病灶长径总和缩小至少30%;③疾病进展(PD):基线病灶长径总和增加至少20%;④疾病稳定(SD):病灶减小程度未达到PR,增加程度也未达到PD。客观缓解率(ORR)=(CR+PR)÷总例数×100%,疾病控制率(DCR)=(CR+PR+SD)÷总例数×100%。
记录所有患者无疾病进展时间(PFS),即肿瘤患者从第1次接受药物治疗至出现肿瘤进展或死亡的时间。记录所有患者总生存期(OS),即第1次接受药物治疗至患者死亡或末次随访时间。数据截止日尚生存的患者或在研究中失访的患者,将以最后1次随访日期结尾数值进行分析。

2 结果
2.1基因突变情况 纳入研究的所有患者无病例脱落和随访丢失情况,共94例患者进行EGFR检测,突变58例(58/94,61.70%)。19号外显子突变24例(24/94,25.53%),21号外显子突变20例(20/94,21.28%),20号外显子突变11例(11/94,11.70%),18号外显子突变3例(3/94,3.19%);33例为单点突变,25例为缺失突变。具体情况如下:19号外显子中17例发生单点突变,7例发生缺失突变,3例突变位点在del2236-2250,4例突变位点在del2235-2249;21号外显子中15例为单点突变,5例为缺失突变,突变位点为 L858R 12例,突变位点2573T>G 8例;20号外显子突变中8例为单点突变,T790 M突变3例,2350T>C 5例,缺失突变3例,突变位点为del2235-2249;18号外显子2例为单点突变,2162G>C 2例,缺失突变1例,位点为del2236-2250。
2.2吉非替尼疗效 (1)突变组PFS为6~21.5个月,中位PFS为15个月,OS为9~31.7个月,中位OS为18个月;野生组PFS为3.4~5.6个月,中位PFS为4.0个月,OS为5.2~6.8个月,中位OS为5.7个月,见图1和图2。突变组的PFS和OS明显高于野生组,差异有统计学意义(P<0.000 1)。
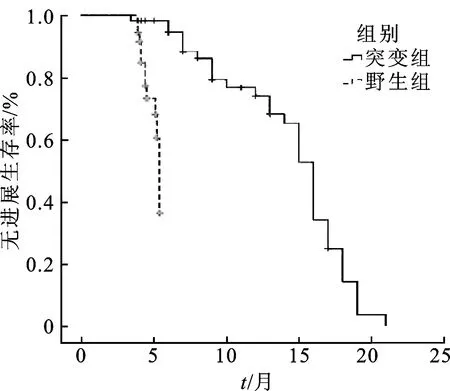
图1 突变组和野生组的PFS比较
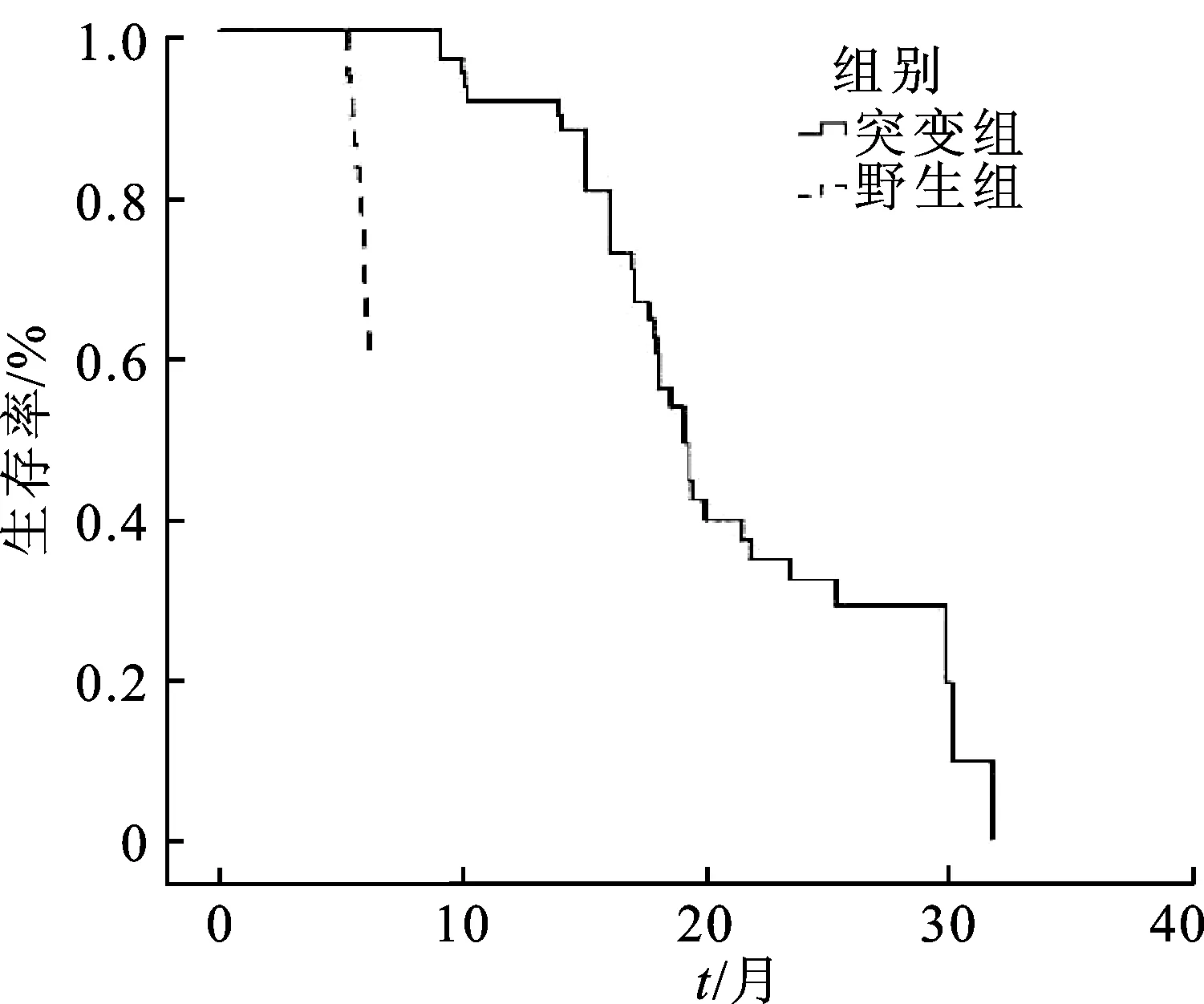
图2 突变组和野生组的OS比较
(2)突变组的临床疗效明显优于野生组(u=2.94,P=0.003),突变组的ORR明显高于野生组(χ2=7.35,P=0.007);突变组的DCR明显高于野生组(χ2=4.68,P=0.030),见表2。

表2 突变组与野生组的临床疗效比较
2.3Ki-67在NSCLC患者中的表达及与临床病理特征的关系
2.3.1Ki-67在NSCLC患者中的表达 阳性率免疫组化染色后细胞核呈棕色颗粒表示Ki-67阳性。94例NSCLC患者中,Ki-67阳性76例(80.85%),其中+38例,++21例,+++17例。Ki-67 的免疫组化染色图见图3。

图3 Ki-67在NSCLC患者癌组织中的表达
2.3.2Ki-67表达与临床病理特征的关系 Ki-67表达在性别、年龄、是否吸烟、组织学类型、肿瘤位置和肿瘤直径方面比较差异无统计学意义;中高分化患者的Ki-67表达阳性率明显高于低分化患者;淋巴结转移患者Ki-67表达阳性率明显高于未转移患者,差异有统计学意义,见表3。

表3 Ki-67表达与临床病理特征
2.4吉非替尼疗效与Ki-67表达的关系
2.4.1EGFR突变与Ki-67表达的关系 突变组58例患者中,Ki-67表达阳性56例,阴性2例;野生组36例患者中,Ki-67表达阳性20例,阴性16例。采用Spearman相关性分析,Ki-67表达与EGFR突变呈正相关(P<0.05),说明Ki-67表达阳性则EGFR突变概率越高。见表4。
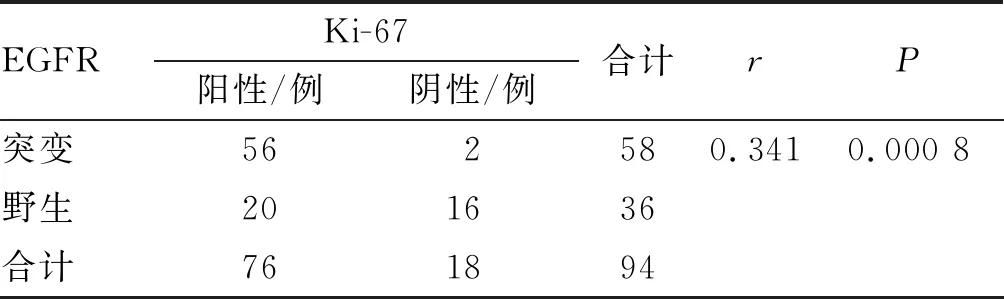
表4 EGFR突变与Ki-67表达的相关性分析
2.4.2Ki-67表达与吉非替尼疗效的关系 Ki-67表达阳性组的临床疗效明显优于阴性组(u=2.958,P=0.003),阳性组ORR明显高于阴性组(χ2=7.582,P=0.006);阳性组的DCR明显高于阴性组(χ2=4.505,P=0.034),见表5。此外,Ki-67表达阳性患者使用吉非替尼治疗效果更好,PFS和OS明显高于Ki-67表达阴性患者(P<0.000 1),见图4和图5。
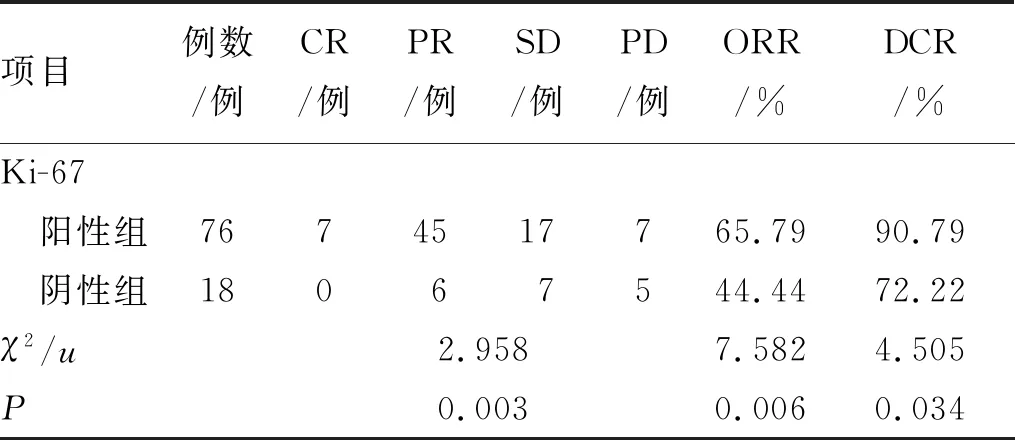
表5 Ki-67表达与吉非替尼疗效的关系
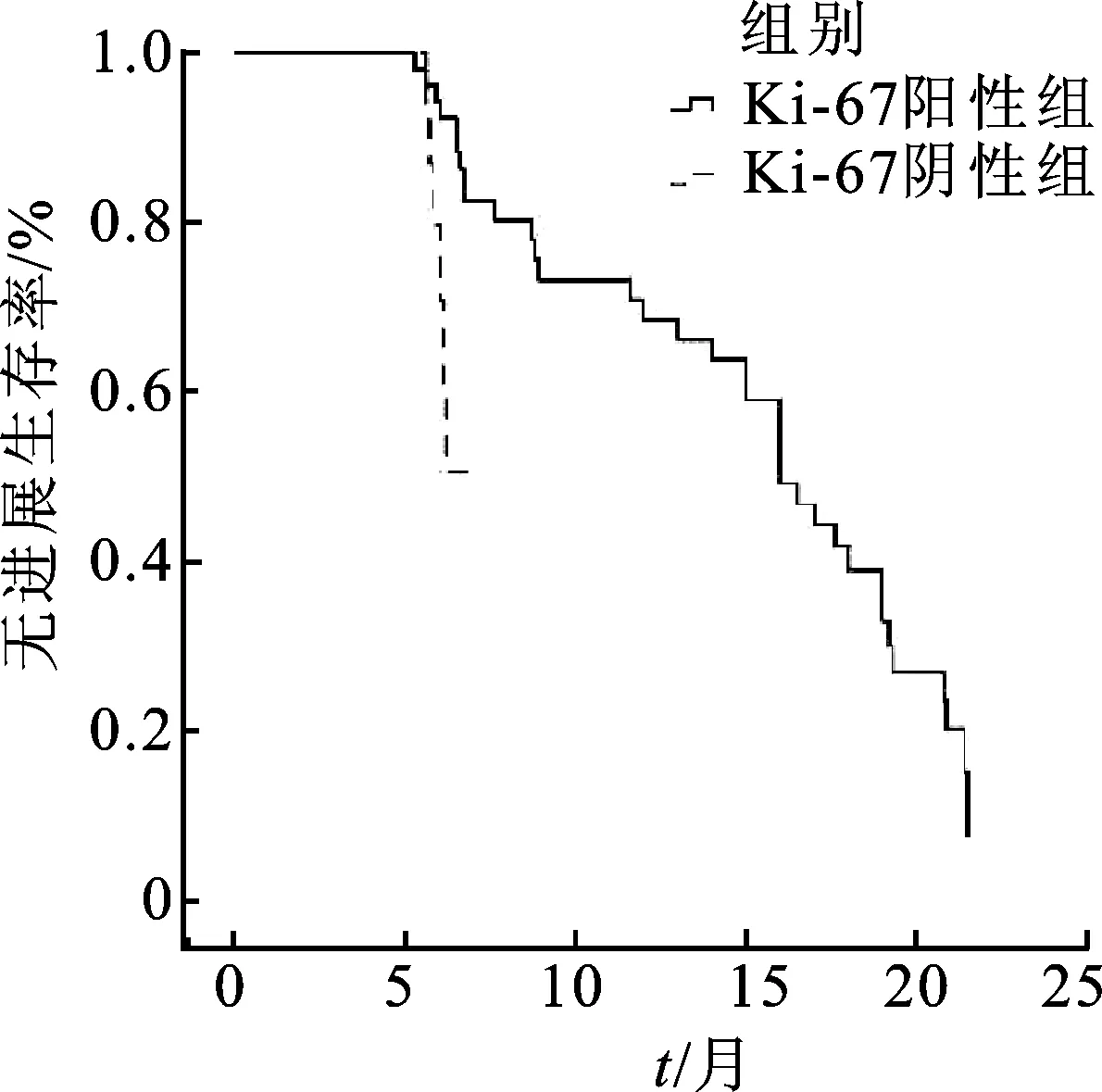
图4 Ki-67表达阳性和Ki-67表达阴性的NSCLC患者PFS比较
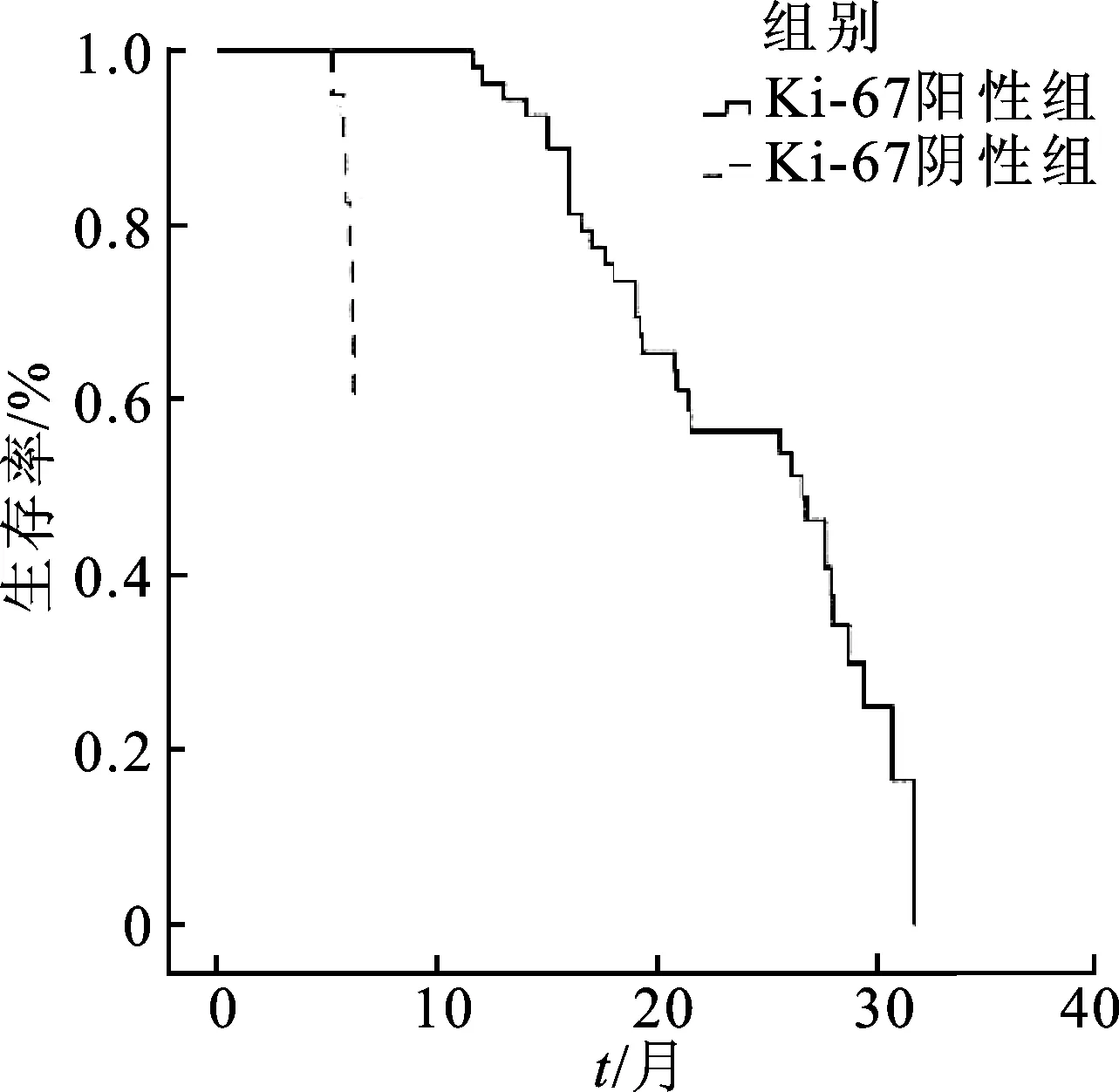
图5 Ki-67表达阳性和Ki-67表达阴性的NSCLC患者OS生存比较
3 讨论
近年来肺癌的发病率和致死率均呈上升趋势,已位居癌症首位,特别是发展中国家。据统计,到2025年,我国每年将增加100万肺癌患者[10]。肺癌早期无明显症状,患者往往不去就诊治疗,尤其在农村,因此,多数患者发现肺癌时已为晚期,显著降低了患者的生存率。根据临床表现不同,肺癌分为小细胞肺癌和NSCLC,NSCLC包括鳞状细胞癌和腺癌,临床多以NSCLC常见,但NSCLC症状存在不明显、易转移、难治疗等问题,严重影响患者的预后和生存时间。早期肺癌可接受手术治疗[11],晚期肺癌多采用化疗保守治疗,但出现耐药、治疗效果不佳等问题,影响患者的生活质量和疾病进展时间,因此,预测疾病发展和药物治疗效果成为NSCLC治疗的关键问题。根据《中华医学会肺癌临床诊断指南(2018年版)》[12]中的治疗方式,对于肺癌晚期、放化疗治疗无效的患者首选EGFR抑制剂治疗,即抑制EGFR活性,EGFR在NSCLC中高度表达并激活至磷酸化状态,导致下游蛋白磷酸化,从而刺激细胞增殖、侵袭和抑制凋亡。吉非替尼为EGFR抑制剂,通过抑制EGFR活性,从而减慢肿瘤细胞的增殖、迁移[13-14]。2003年刚上市时,吉非替尼效果不佳,随后有研究发现主要是由于吉非替尼的治疗效果与EGFR基因突变密切相关,并发现突变主要发生于女性、无吸烟史和我国东部地区患者[15-16]。因此,检测EGFR基因突变是NSCLC患者能否从EGFR抑制剂治疗中获益的重要因素。
研究发现,EGFR 突变型 NSCLC 对 EGFR 靶向药物异常敏感,尤其是外显子19和外显子21,在亚洲人群中突变率高达30%~40%[17]。随着吉非替尼临床使用越来越成熟,多项大型研究证实靶向药物治疗可明显改善NSCLC患者的生活质量和生存时间。本研究在研究前对所有患者进行基因检测,发现有58例患者发生EGFR基因突变,其中主要发生在外显子21和19,与此前研究一致。外显子 19 的LREA基因缺失为主要突变位置,是EGFR抑制剂的作用位点。外显子21的主要突变位点在L858R,该突变提高了A区域(A-Loop)稳定性和药物治疗效果[18]。吉非替尼作为EGFR抑制剂药物,可作用于突变靶点,抑制肿瘤生长,增加肿瘤细胞凋亡。早前细胞研究发现,L858R突变细胞株只需0.1 μmol·L-1的吉非替尼就可以抑制细胞生长,而野生型细胞株需要10 μmol·L-1,说明吉非替尼对突变性细胞株敏感度显著增加,且突变位点在L858R,临床试验中也发现,吉非替尼在普通人群中的治疗有效率仅为10%~30%,但在EGFR突变患者中的有效率明显升高至75%~95%[19]。因此,通过基因筛选可有效提高患者的治疗效果,本研究突变组的ORR(72.41%)和DCR(93.19%)均明显高于野生组(ORR=44.44%,DCR=77.78%),差异有统计学意义(P<0.05),此外,突变组的PFS和OS也明显高于野生组,差异有统计学意义(P<0.05)。研究显示,吉非替尼治疗较化疗毒性和不良反应更小,疗效更佳[20]。一项吉非替尼Ⅲ期临床试验发现,吉非替尼的PFS明显优于铂类药物,吉非替尼的OS优于铂类化疗2倍[21-22]。本研究证实了吉非替尼对于NSCLC的治疗效果,但近年来有研究报道表示,EGFR抑制剂产生耐药性,患者预后较之前差[23-24]。目前,临床上对于NSCLC患者耐药性及预后的预测尚未找到合适的标志物。有研究发现,Ki-67在其他肿瘤中高度表达,可作为肿瘤相关性标志物[25-26],在NSCLC中也有研究显示,Ki-67表达与肿瘤细胞活跃呈正相关[27]。在G1期Ki-67开始少量表达,在S期和G2期表达量明显增高,至M期表达量达最大量。因此,Ki-67表达水平与EGFR基因突变呈正相关,可成为EGFR抑制剂治疗NSCLC疗效的有效预测指标。本研究结果显示,Ki-67表达与EGFR突变呈正相关(P<0.05),说明Ki-67表达阳性则EGFR突变概率越高。可用Ki-67预测吉非替尼的治疗效果。
综上所述,本研究明确了吉非替尼对于基因突变敏感度高的NSCLC的治疗效果,并初步证实了Ki-67表达水平与EGFR突变的关系,Ki-67可作为吉非替尼治疗NSCLC疗效的预测指标之一,对于EGFR突变敏感性尚不确定的患者,通过检测Ki-67可以为临床医生选择EGFR突变检测提供一定的参考,从而使患者更好地从EGFR抑制剂治疗中获益。但Ki-67对吉非替尼治疗NSCLC疗效的具体预测价值还有待进一步研究。
