雷帕霉素对S180肉瘤细胞及CD90、CD133、Notch1蛋白表达的影响
2021-09-10王康嵘
孔 萍,王康嵘,张 静
(1.宜昌市夷陵医院药剂科,宜昌 443100;2.武汉市普仁医院耳鼻喉口腔头颈外科,武汉 430081)
恶性肿瘤是目前导致居民死亡的主要原因之一[1]。近年研究发现,抗原分化簇90(CD90)参与肿瘤细胞增殖、转移、凋亡等过程,可在各种正常组织或细胞中表达并与肿瘤预后密切相关[2]。肿瘤干细胞(CSCs)的存在是肿瘤逆转和恢复的主要原因之一。抗原分化簇133(CD133)为CSCs标志物,Notch为调控CSCs的经典信号通路。研究表明,CD133和Notch1具有致瘤性,且与CSCs肿瘤的发生、转移和耐药有关[3-4]。研究证实,细胞自噬具有促进肿瘤细胞发生和发展的作用,通过抑制细胞自噬可达到抗肿瘤作用[5]。雷帕霉素靶蛋白(mTOR)为细胞自噬的重要调控途径。雷帕霉素是目前临床常用的mTOR受体抑制剂,可通过抑制mTOR活化,促进细胞自噬[6]。本研究观察了雷帕霉素对S180肉瘤细胞和小鼠S180肉瘤模型的抑瘤作用,以及对肿瘤组织CD90、CD133和Notch1蛋白表达的影响,旨在进一步探讨雷帕霉素的抗肿瘤作用机制,为临床抗肿瘤治疗提供参考。
1 仪器与材料
1.1仪器 Multiskan FC型酶标仪和Attune NxT型流式细胞仪,均购自美国赛默飞世尔公司。
1.2材料 小鼠S180肉瘤细胞,上海江林生物科技有限公司;雷帕霉素(批号822178),北京华迈科生物技术有限责任公司;DMEM完全培养基(批号31600)、磷酸盐缓冲液(PBS,批号P1022)、胰蛋白酶(批号T1320)、CCK-8试剂盒(批号CA1210)、抗荧光衰减封片剂(批号S2100)、HRP标记二抗(批号SE064)、DAB显色试剂盒(批号DA1015),均购自北京索莱宝科技有限公司;细胞周期检测试剂盒(批号340242)、细胞凋亡检测试剂盒(批号556507),均购自美国BD公司;冷冻包埋剂(批号6506)、荧光二抗(批号A-11034),均购自美国赛默飞世尔公司;CD90多克隆抗体(批号ABP56393)、CD133多克隆抗体(批号ABP52923)、Notch1多克隆抗体(批号PAB19810)、β-actin多克隆抗体(批号ABP50593),购自武汉艾美捷科技有限公司。
1.3动物 KM小鼠(批号CS-003),雄性,40只,6~8周龄,体质量为(20.13±1.78) g,均购自辽宁长生生物技术股份有限公司,实验动物许可证号SCXK(辽)20200002。
2 方法
2.1体外实验
2.1.1细胞培养与分组 在液氮中取出冻存细胞,置于37 ℃水浴锅中融化,移至15 mL离心管中,加入预热的DMEM完全培养基10 mL,以2 000 r·min-1离心2 min,弃上清液;以DMEM完全培养基10 mL清洗,弃上清液;再次加入DMEM完全培养基10 mL,接种于培养板中,置于37 ℃、体积分数为5%的CO2培养箱中培养,待细胞融合度达80%~90%时,弃去培养基;以PBS清洗2次,加入胰蛋白酶3 mL消化,3 min后以DMEM完全培养基终止反应,移至15 mL离心管中,以2 000 r·min-1离心2 min,弃上清液;加入PBS 10 mL,吹匀后细胞以1×105个·孔-1接种于96孔板中,孵育过夜,雷帕霉素低、中、高剂量组分别加入20、50、100 nmol·L-1的雷帕霉素;对照组加入等量培养液,每组设置5个复孔;空白组仅加入等量培养液。
2.1.2细胞增殖 采用CCK-8法检测细胞增殖。雷帕霉素分别作用24、48、72 h后,每孔加入CCK-8试剂10 μL,37 ℃避光孵育3 h;用酶标仪在450 nm波长处测定吸光度值A,实验重复3次,取平均值,细胞增殖抑制率(%)=[1-(A给药组-A对照组)÷(A对照组-A空白组)]×100%。
2.1.3细胞周期与凋亡 采用流式细胞术法检测细胞周期与凋亡。雷帕霉素作用48 h后,在4 ℃条件下,以3 000 r·min-1离心5 min,弃上清液;加入预冷的PBS洗涤2次,以100 μL结合PBS重悬细胞;分别按照细胞周期检测试剂盒和细胞凋亡检测试剂盒说明书操作,利用流式细胞仪检测细胞周期和凋亡,实验重复3次,取平均值。
2.2体内实验
2.2.1模型构建与分组 将S180肉瘤细胞以1×106个·mL-1接种于小鼠左前肢腋下皮下,24 h后随机将小鼠分为对照组以及雷帕霉素低、中和高剂量组;定期测量小鼠体质量和肿瘤长径(a)、短径(b),计算肿瘤体积V(mm3),V=ab2÷2,当V≥100 mm3时,按照人体临床用量的0.5、1.0、2.0倍换算小鼠用量,雷帕霉素低、中和高剂量组小鼠分别以1、2、4 mg·kg-1雷帕霉素灌胃,对照组以等量生理盐水灌胃,每日1次,共3周。
2.2.2皮下成瘤实验 末次灌胃后24 h,测定小鼠体质量,以CO2吸入麻醉,剥取肿瘤称定质量,记录瘤质量并计算抑瘤率,抑瘤率(%)=(对照组瘤质量-给药组瘤质量)÷对照组瘤质量×100%。
2.2.3肿瘤组织CD90、CD133和Notch1蛋白表达 取肿瘤组织,一部分保存于-70 ℃冰箱内,用于免疫荧光染色;另一部分固定于甲醛中,用于免疫组织化学染色。(1)免疫荧光染色:取组织,用冷冻包埋剂包埋后,用切片机制备成厚8 μm的连续切片;4 ℃下丙酮固定10~20 min,用PBS冲洗3次,每次5 min;滴加正常羊血清,37 ℃反应30 min;弃去多余血清,滴加一抗,4 ℃过夜;用PBS冲洗3次,每次5 min;滴加荧光素标记二抗,37 ℃避光孵育60 min;PBS冲洗3次,每次5 min;以抗荧光衰减封片剂封片,400倍荧光显微镜观察并拍照;CD90、CD133和Notch1蛋白阳性信号为细胞膜或细胞浆出现绿光颗粒、细胞核出现蓝光颗粒;计算染色强度,染色强度越大提示蛋白表达越强。(2)免疫组织化学染色:取组织,依次进行常规脱水、透明、浸蜡处理后,以石蜡包埋,用切片机制备成厚4 μm的连续切片;烤片60 min,依次进行脱蜡、水化,加入过氧化氢溶液灭活;PBS冲洗3次,每次5 min;滴加抗原修复液,沸水浴中煮沸15 min,自然冷却至室温;PBS冲洗3次,每次5 min;滴加一抗,4 ℃过夜;PBS冲洗3次,每次5 min,滴加HRP标记二抗,37 ℃孵育60 min;PBS冲洗3次,每次5 min,滴加DAB显色剂,3 min后用自来水冲洗,苏木素复染3 min,分化液反应30 s,反蓝后用自来水冲洗;常规脱水、透明处理后,以中性树胶封片,400倍显微镜下观察并拍照;CD90、CD133和Notch1蛋白阳性信号为细胞膜或细胞浆出现棕黄色或棕褐色颗粒,计算灰度值,灰度值越高提示蛋白表达越弱。

3 结果
3.1雷帕霉素对S180肉瘤细胞增殖的影响 见表1。由表1可知,与对照组比较,雷帕霉素低、中和高剂量组作用S180肉瘤细胞后,细胞增殖抑制率显著升高(P<0.05),且与作用时间呈正相关;同一作用时间,细胞增殖抑制率随雷帕霉素浓度的增加而升高(P<0.05)。
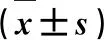
表1 不同浓度雷帕霉素对S180肉瘤细胞各时间点细胞增殖抑制率的影响
3.2雷帕霉素对S180肉瘤细胞周期的影响 见表2。由表2可知,与对照组比较,雷帕霉素低、中和高剂量组作用S180肉瘤细胞48 h后,细胞周期阻滞明显(P<0.05),主要阻滞于G0/G1期。
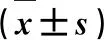
表2 不同浓度雷帕霉素对S180肉瘤细胞各细胞周期抑制率的影响
3.3雷帕霉素对S180肉瘤细胞凋亡的影响 见图1和表3。由图1和表3可知,与对照组比较,雷帕霉素低、中和高剂量组作用S180肉瘤细胞48 h后,细胞凋亡率显著升高(P<0.05),呈浓度依赖性。

图1 不同浓度雷帕霉素作用于S180肉瘤细胞的凋亡情况
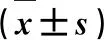
表3 不同浓度雷帕霉素对S180肉瘤细胞凋亡率的影响
3.4雷帕霉素对S180肉瘤小鼠的抑瘤作用 见表4。由表4可知,实验前后,各组小鼠体质量比较,差异无统计学意义(P>0.05);与对照组比较,雷帕霉素低、中和高剂量组小鼠瘤质量显著降低,抑瘤率显著升高(P<0.05);瘤质量随雷帕霉素浓度的增加而降低,抑瘤率随雷帕霉素浓度的增加而升高(P<0.05)。

表4 各组小鼠体质量、瘤质量和抑瘤率比较
3.5雷帕霉素对小鼠肿瘤组织CD90、CD133和Notch1蛋白表达的影响
3.5.1免疫荧光染色 见表5。由表5可知,与对照组比较,其他3组小鼠肿瘤组织CD90、CD133和Notch1蛋白表达显著降低,随雷帕霉素浓度增加而降低(P<0.05)。

表5 各组小鼠肉瘤组织CD90、CD133和Notch1蛋白免疫荧光染色结果比较
3.5.2免疫组织化学染色 见表6。由表6可知,与对照组比较,其他3组小鼠肿瘤组织CD90、CD133和Notch1蛋白表达显著降低,随雷帕霉素浓度增加而降低(P<0.01)。见表6。

表6 各组小鼠肉瘤组织CD90、CD133和Notch1蛋白免疫组化染色结果比较
4 讨论
恶性肿瘤是严重威胁居民生命健康的公共卫生问题,其发生和发展与细胞自噬密切相关[7]。吴晓莉等[8]研究表明,自噬活性改变可导致正常细胞恶性转化或促进肿瘤进展。mTOR为诱导细胞自噬和抑制肿瘤细胞增殖的重要途径[9]。雷帕霉素为新型大环内酯类免疫抑制剂,主治器官移植术后抗排斥反应及自身免疫性疾病[10]。近年研究发现,雷帕霉素可与细胞内受体FKBP-12结合形成复合物,抑制mTOR活性和诱导细胞循环停滞在G1期[11]。宋魏等[12]研究发现,雷帕霉素可通过下调mTOR表达和mTOR磷酸化,降低mTOR信号通路活性,显著抑制鼻咽癌肿瘤干细胞增殖,达到抗肿瘤作用。
肉瘤源于小鼠间叶组织恶性肿瘤,常见于纤维肉瘤、骨肉瘤、淋巴肉瘤等[13]。崔明星等[14]以不同浓度雷帕霉素(20、50、100 nmol·L-1)作用于人骨肉瘤MG-63细胞发现,作用3~5 d后细胞增殖能力显著降低。另有研究发现,通过调控磷酸肌醇3激酶/蛋白激酶B/mTOR信号通路,可显著抑制骨肉瘤细胞的增殖和迁移[15]。本研究使用的小鼠S180肉瘤细胞来源于白人女性骨肉瘤组织,不同浓度雷帕霉素(20、50、100 nmol·L-1)作用后发现,S180肉瘤细胞增殖抑制率显著升高,且与作用时间呈正相关,符合以往研究结果[16],同一作用时间,细胞增殖抑制率随雷帕霉素浓度的增加而升高,提示随着雷帕霉素浓度的增加,其抑制肿瘤细胞增殖能力可能越强。既往研究结果显示,雷帕霉素可抑制高糖状态下肾系膜细胞增殖,促进其凋亡并使细胞阻滞于G1/S期[17]。周伦欢等[18]研究发现,雷帕霉素可通过抑制mTOR通路活性,将细胞阻滞于G1/G0期,抑制伯基特淋巴瘤细胞株增殖和诱导细胞凋亡。本研究结果显示,雷帕霉素作用S180肉瘤细胞48 h后,细胞周期阻滞明显,且主要阻滞于G0/G1期,雷帕霉素促进细胞凋亡作用呈浓度依赖性,符合以往研究结果。以上体外实验证实,雷帕霉素具有明显的抗肿瘤作用,可能通过抑制细胞增殖,阻滞细胞周期于G1/G0期,促进细胞凋亡实现。Shen M H等[19]研究发现,雷帕霉素能显著降低肿瘤负荷。本研究通过构建小鼠S180肉瘤皮下荷瘤模型发现,雷帕霉素可显著降低小鼠瘤质量,且瘤质量随雷帕霉素浓度的增加而降低,抑瘤率随雷帕霉素浓度的增加而升高,符合以往研究结果,体内实验进一步证实雷帕霉素具有明显的抗肿瘤作用。CSCs是影响肿瘤形成、增殖、复发和转移的重要因素。Hubo Shi等[20]研究发现,雷帕霉素诱导的肿瘤生长延迟可能与抑制肿瘤干细胞表型Notch1、CD133和CD90蛋白表达有关。本研究分别采用免疫荧光染色和免疫组织化学染色法检测肿瘤组织Notch1、CD133和CD90表达,结果均显示,雷帕霉素可显著抑制小鼠肿瘤组织CD90、CD133和Notch1蛋白表达,且随雷帕霉素浓度的增加而降低,符合以往研究结果。
综上所述,雷帕霉素可能通过下调CD90、CD133和Notch1蛋白表达,影响S180肉瘤细胞的增殖和凋亡,达到体内外抑瘤作用。
