5-羟甲基胞嘧啶与肿瘤
2021-09-09刘双庆车德海综述孟庆威审校
刘双庆 车德海 综述 孟庆威 审校
表观遗传学是指不改变DNA序列的条件下发生的影响表型或基因型的稳定可遗传的基因修饰,是调控基因表达的重要环节[1]。DNA甲基化是表观遗传学中最为广泛研究的机制之一。主要通过改变DNA与转录调控分子的结合能力发挥表观调控作用[2]。在基因表达的动态调控中,胞嘧啶甲基化产物5-甲基胞嘧啶(5-methylcytosine,5-mC)可去甲基化形成胞嘧啶,其中间产物5-羟甲基胞嘧啶(5-hydroxymethyl cytosine,5-hmC)被称作高等生物基因组的“第六碱基”[3-4]。5-hmC是一种稳定的表观遗传学修饰[5]。生理状态下,5-hmC在胚胎植入[6]、神经系统功能调控[7]等方面发挥作用。在肿瘤中,5-hmC能作为疾病诊断、疗效预测的标志物及治疗靶点。
在肿瘤中,5-hmC总体呈减少趋势。肿瘤细胞全基因组5-hmC水平的降低最早发现于血液系统肿瘤[4],而后在宫颈癌[10]、前列腺癌[11]、黑色素瘤[12]、肝癌[13]等肿瘤组织及细胞系中,均观察到5-hmC总体水平的改变和5-hmC在基因上的重新分布。作为表观遗传学调控的重要分子,5-hmC能通过参与Wnt等信号通路的调控[14]、影响组蛋白修饰[15],与miRNA相互作用[16]等途径影响肿瘤的发生发展。肿瘤中5-hmC的动态变化可能是多种因素作用的结果,主要机制包括DNA复制时出现5-hmC的丢失[8];TET酶的下调或突变[12,16];IDH的下调或突变[17];维生素C的减少[18];5-hmC清除酶的增多[8]等。随着表观遗传学研究的逐渐深入,5-hmC作为肿瘤标志物的潜能逐渐受到重视,5-hmC在时间和空间上动态变化的机制也引起研究者的广泛关注。
1 5-hmC概述
5-hmC是5-mC去甲基化的重要中间产物和参与因子,5-mC的去甲基化包括主动去甲基化(De novo methylation or Active DNA demethylation)和被动去甲基化(Maintenance methylation or passive DNA demethylation)两种机制,5-hmC主要参与主动去甲基化[4]。TET1(Ten-eleven-translocation 1)酶在5-mC第五位碳原子的甲基上添加一个羟基,使5-mC转化为5-hmC。这一过程称为羟甲基化,是5-mC主动去甲基化的启动过程[3,19]。TET家族酶还能进一步将5-hmC的羟基氧化为醛基形成5-甲酰基胞嘧啶(5-formyl cytosine,5-fC),氧化为羧基形成5-甲羧基胞嘧啶(5-carboxylcytosine,5-caC)。5-fC和5-caC能被TDG(Thymine-DNA glycosylase)识别并切除,再通过BER(Base excision repair)途径转化为胞嘧啶完成5mC的主动去甲基化[3-4](图1)。
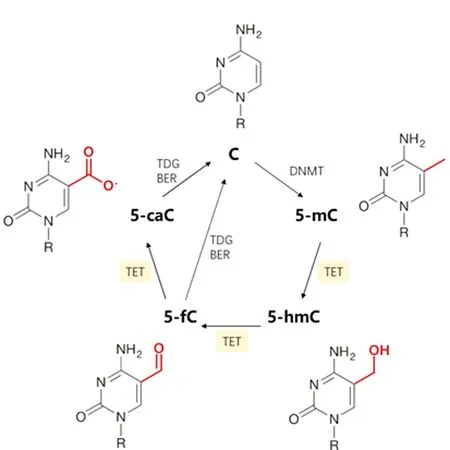
图1 胞嘧啶甲基化与5-mC主动去甲基化Figure 1 The cycle of DNA methylation and active demethylation
2 肿瘤中5-hmC的特点与作用
2.1 肿瘤中5-hmC表达水平的改变
关于肿瘤中5-hmC的水平的改变,国内外进行了多项研究。与成熟黑色素细胞和黑色素痣相比,黑色素瘤细胞中5-hmC水平较低。且分期晚的黑色素瘤5-hmC水平较早期更低[12,20-21]。早期肝细胞癌中即发现全基因组5-hmC水平的减少,且5-hmC的减少与肝癌的分期晚、侵袭性强、AFP水平高、肝功能受损及肿瘤负荷大相关[13,16,22-23]。在宫颈癌[10]、前列腺癌[11]等实体瘤中也有类似发现。因此在实体瘤中,5-hmC可以作为恶性肿瘤的表观遗传学标记,具有一定的诊断和判断预后的价值。然而,在肺癌患者的cfDNA监测中,两个不同的研究得出了截然相反的结果。Song等[24]的研究结果显示肺癌患者cfDNA中5-hmC水平较健康人低,且分期越晚的患者cfDNA中5-hmC水平越低,与前人在实体瘤中的结论相似。Zhang等[25]却发现NSCLC患者cfDNA中5-hmC较健康人增多,且5-hmC富集区域(5-hmC-enriched regions,hmRs)的分布更广泛。因此仅测量cfDNA中5-hmC水平的改变可能无法作为可靠的肿瘤标志物。应该结合5-hmC的调控功能进一步探讨5-hmC的分布情况。尽管不同研究得出了不同结论,但并不影响5-hmC作为肿瘤标志物的潜力。
2.2 肿瘤中5-hmC分布的改变
除了5-hmC总体水平的改变,在基因层面,5-hmC可以分布在基因的CpG岛、启动子、增强子、外显子等区域[9]。基因体(Gene body)的5-hmC增多常提示基因活跃,TSS(Transcription start site)的5-hmC增多则与转录抑制相关[5]。在肝癌中,研究者认为5-hmC多聚集在CpG岛岸(CGI shores),即CpG岛上游距离不超过2kb的区域,并呈双峰分布。5-hmC在空间上的这种改变可能通过影响增殖及分化相关基因的表达水平参与恶性肿瘤的发生发展[15]。5-hmC在基因上的分布特点与5-hmC发挥表观遗传学调控的方式是分不开的,因此研究者将目光转向探索5-hmC在肿瘤中的作用机制。
2.3 5-hmC参与肿瘤表观遗传学调控的机制
5-hmC可能参与调控Wnt/β-catenin信号通路。在胰腺癌组织中,5-hmC和TET1水平均有降低,且二者表达量呈正相关。在胰腺癌细胞系中过表达TET1时,Wnt/β-catenin通路中的CTNNB1、FZD7、GSK-3β、Cyclin D等分子下调,磷酸化的GSK-3β升高,提示Wnt/β-catenin通路受抑制。因此推测TET1酶可能通过调控5-hmC水平抑制Wnt/β-catenin通路进而阻碍上皮间质转化(Epithelial to mesenchymal transition,EMT)[14]。
对于肝细胞癌和正常肝细胞的研究显示,5-hmC主要聚集在转录活跃基因的CpG岛岸区域,且5-hmC的分布形成一个双峰。人干细胞和脑组织中的5-hmC分布也具有同样特点。结合组蛋白修饰的研究,发现H3K4me1在转录活跃基因的CpG岛岸周围也呈基本一致的双峰分布,提示H3K4me1与5-hmC之间可能有潜在的交叉作用[15]。另有研究显示5-hmC的分布与H3K4Me2、H3K4Me3等组蛋白修饰相关。这些结果提示5-hmC可能与组蛋白修饰相互作用,参与CpG岛岸对基因的调控[26]。
除了上述调控机制,5-hmC还可以通过调节染色体空间结构的形成和重构来调控基因表达。例如,5-hmC能抑制MeCP2(Methyl-CpG-binding protein 2)、MBDs(Mehyl-CpG-binding domain proteins)等与甲基化的CpG的结合能力,以此抑制5-mC对基因的调控作用[9]。5-hmC也可能参与EMT[14,27],而EMT能参与肿瘤的侵袭和转移[28]。表观遗传学调控是复杂而精密的,5-hmC在肿瘤中的作用机制仅仅露出冰山一角。阐明5-hmC在肿瘤基因中的分布情况,探索5-hmC在肿瘤表观调控中的作用机制,将为5-hmC作为肿瘤标志物及治疗靶点应用于临床提供理论依据。
3 肿瘤中5-hmC表达的动态调控
3.1 DNA复制时的5-hmC丢失
肿瘤细胞增殖速度较快,研究者在鼠胚胎细胞中发现了5-hmC在DNA复制过程中的被动丢失。在肿瘤细胞中,虽然DNA损伤能够导致5-mC向5-hmC转化,但DNA复制频率的增加会导致5-hmC的丢失。同样的,在脑部肿瘤中,复制水平较高的细胞5-hmC水平较低[8]。
3.2 TET酶的下调或突变导致肿瘤中5-hmC水平降低
TET水平的下调也能导致肿瘤细胞中5-hmC水平的降低[16],在前列腺癌、乳腺癌、直肠癌和肝癌中均得到证实。在黑色素瘤和血液系统肿瘤中,TET2的表达量也有降低,同时5-hmC水平下调[12]。将乳腺癌和肝癌细胞与正常细胞对比,研究者还发现TET3表达量的降低也与5-hmC水平的降低有关,此外,TET3水平的降低与乳腺癌患者的不良预后相关[29]。
3.3 IDH的下调或突变导致肿瘤中5-hmC水平降低
异柠檬酸脱氢酶(Isocitrated dehydrogenase,IDH)的突变也是肿瘤中5-hmC减少的可能机制。在神经胶质瘤、结肠癌、前列腺癌、黑色素瘤中均发现IDH1和(或)IDH2的突变。突变的IDH能阻断TET共同作用分子αKG的产生,并产生竞争性抑制剂2HG,从而削弱TET的作用。故IDH突变至少能部分解释肿瘤中5-hmC水平的降低[17]。
3.4 肿瘤组织中维生素C的减少导致肿瘤中5-hmC水平降低
肿瘤组织中维生素C的减少也是5-hmC丢失的机制之一。体外培养的肿瘤细胞中,维生素C能通过TET途径促进5-hmC生成。研究者发现维生素C能增多Fe3+向Fe2+的转换加强TET活性。维生素C的减少则与转运体SVCT2减少、氧化应激的增加等因素相关[18,30]。
3.5 5-hmC清除酶的增多导致肿瘤中5-hmC水平降低
5-hmC清除相关酶的增多也能导致5-hmC减少,如在神经胶质瘤中,观察到AID/APOBEC家族蛋白和BER糖基化酶等酶的过表达[8]。
肿瘤中5-hmC的减少可能是上述机制共同作用的结果,TET酶对5-mC、5-hmC等底物的催化具有选择性,其机制仍需探究[7]。在复杂但严谨的表观遗传学调控中,决定基因表观修饰状态的具体调控机制更需要一步步探索。
4 肿瘤中5-hmC的临床价值
5-hmC在肿瘤组织及cfDNA中的水平及不同基因位点的分布可作为实体瘤诊断及预测的重要指标。但不可忽视的是,5-hmC的检测方法尚不统一,为提高5-hmC作为肿瘤预测因子的准确性,需要推出广泛认可的检验方法和标准流程。
5-hmC也可作为抗肿瘤治疗的潜在靶点,急性粒细胞性白血病治疗药物HHT(Homeharringtonine)能够降低TET表达进而减少5-hmC发挥抗白血病作用[31]。在膀胱癌[18]、白血病[32]、肾癌[33]中均发现了维生素C能上调5-hmC并抑制肿瘤增殖。压力、饮食运动等外界因素也与5-hmC水平相关[7]。因此以5-hmC为靶点药物的研究具有潜在的临床意义,生活方式的改善对5-hmC及肿瘤的潜在影响也待探究。但由于TET的复杂调控,通过靶向TET调节5-hmC的治疗方法应用前景很难预测。
5 小结与展望
在肿瘤中,5-hmC作为一种稳定的表观遗传学修饰调控基因表达,参与肿瘤的发生发展。在复杂的调控和反馈机制下,5-hmC水平处于动态平衡中。对5-hmC的分布情况及调控机制的研究有助于发掘5-hmC的临床应用潜力。5-hmC在肿瘤组织及cfDNA中的水平及不同基因位点的分布可作为实体瘤诊断及预测的重要指标,5-hmC也有望成为抗肿瘤治疗靶点。除5-hmC外,5-fC、5-caC也能参与DNA的表观遗传学调控并影响甲基化去甲基化的动态进程。相信在不久的未来,关于胞嘧啶及其修饰产物,以及TET家族酶作用机制的研究,会迎来更多引人瞩目的进展。
