利用ARTP选育真姬菇高产菌株*
2021-09-08李春霞刘静雯李欣悦王竟夷班立桐
李春霞,刘静雯,李欣悦,王竟夷,黄 亮,班立桐,孙 宁,王 玉
(天津农学院农学与资源环境学院,天津 300384)
真姬菇(Hypsizygus marmoreus) 又名蟹味菇、斑玉蕈等,隶属担子菌亚门(Basidiomycotina)层菌纲 (Hymenomycetes) 伞菌目 (Agaricales) 白蘑科(Tricholomataceae) 玉蕈属 (Hypsizigus)[1]。真姬菇在栽培过程中菌丝生长速度慢、生长周期长、易受栽培环境的影响[2],且栽培基质中含有大量木质素和纤维素,在降解纤维素前必须先降解木质素,漆酶在木质素的降解过程中起主要作用[3-4]。近年来,许多研究者开始借助平板筛选法以获得木质素降解酶活性高的菌株以期缩短食用菌生长周期[5-6]。通过采用平板筛选获得木质素降解酶活性高的菌株,旨在为真姬菇工厂化栽培提供新的优质菌株,提高子实体产量。
常压室温等离子体诱变技术(atmospheric room temperature plasma,ARTP) 可以使微生物表面电势下降或者改变细胞膜的通透性,导致遗传物质发生损伤,生物细胞中容错率高的SOS修复机制启动,使得调控网络、造成遗传物质及代谢途径发生改变[7-8]。与传统诱变技术相比,ARTP诱变技术具有普适、高效、快速、安全、无污染等优点[9];ARTP诱变技术近年来广泛应用于细菌、放线菌、霉菌[10-14],此外,在食用菌菌株筛选及育种工作中也有应用[15-16]。通过对真姬菇菌株原生质体的常压室温等离子体诱变技术进行探索,以筛选出漆酶高产菌株,可为规模化的真姬菇生产提供助力。
1 材料及方法
1.1 试验菌株
真姬菇菌株(编号O-T),保藏于天津农学院食用菌研发中心。
1.2 主要培养基
PDA培养基、RB-PDA培养基、再生培养基配方见参考文献[17-18]。
羧甲基纤维素钠培养基(CMC-Na培养基) 配方见参考文献[19];LBL液体培养基配方见参考文献[20]。
1.3 主要仪器及试剂
木聚糖:山毛榉木木聚糖纯度90%,上海源叶生物科技有限公司;羧甲基纤维素,上海生工生物工程有限公司;ABTS,北京索莱宝科技有限公司;溶壁酶lywallzyme,广东微生物研究所研制。
ARTP-M常压室温等离子体育种机,无锡思清源生物科技公司;EnSpire多功能酶标仪,珀金埃尔默仪器有限公司。
1.4 原生质体制备
原生质体制备参照参考文献[21]并稍加改动,称取15 mg溶壁酶溶于1 mL的0.6 mol·L-1甘露醇溶液中,经0.22 μm微孔滤膜过滤除菌,用接种环挑取适量菌体于0.6 mol·L-1的甘露醇溶液中清洗,清洗后的菌体用无菌滤纸迅速擦干放入酶液中,30℃酶解3 h,酶解结束后2 000 r·min-1离心5 min,用移液枪吸取上清,用0.6 mol·L-1的甘露醇溶液重新悬浮,用塞脱脂棉的无菌注射器纯化原生质体,400倍下用血球计数板计数,并将原生质体浓度稀释为1×106个/mL,添加终浓度为5%的甘油作为保护剂,得到的原生质体悬浮液用于ARTP诱变。
在预试验的基础上,采用单因素试验分别研究酶解温度(28℃、30℃、32℃、34℃)、酶解时间(2.0 h、2.5 h、3.0 h、3.5 h、4.0 h、4.5 h)、渗稳剂种类(甘露醇、蔗糖、氯化钾、硫酸镁)、溶壁酶的浓度 (10 mg·mL-1、15 mg·mL-1、20 mg·mL-1、25 mg·mL-1)对原生质体产量的影响。
1.5 常压室温等离子体诱变
利用常压室温等离子体育种机对真姬菇原生质体进行诱变,原生质体悬浮液的上样量为10 μL,诱变功率为120 W,辐照距离2 mm,气体流速10 L·min-1,诱变时间梯度分别为 0、20 s、40 s、60 s、80 s、100 s、120 s,每个梯度3组重复,将诱变后的原生质体悬浮液用0.6 mol·L-1的甘露醇原生质体渗透压稳定剂稀释并涂布于再生培养基中,计算致死率。原生质体致死率(F,%)的计算公式为:

式中:A为对照平板菌落数(个);B为诱变后存活菌落数(个)。
1.6 菌株筛选
1.6.1 菌株初筛
待再生培养基上长出零星小菌落时,将菌落挑至PDA培养基上,距离菌落1 cm处斜插入无菌盖玻片,25℃培养,待边缘菌丝生长至盖玻片2/3处时取出镜检,区分单核菌株和双核菌株,测定诱变后的双核菌株的菌丝生长速度、浓密度、洁白度、边缘整齐度;挑选优势菌株分别接种于RB-PDA培养基及以羧甲基纤维素钠为唯一碳源的平板培养基中,分别筛选出产漆酶和纤维素酶酶能力较高的优势菌株。
1.6.2 菌株复筛
采用LBL液体培养基进行液体培养,25℃、180 r·min-1摇床培养20 d后于615 nm下测定吸光度,计算脱色率 (decolorizing rate,DR)。脱色率(DR,%) 的计算公式为:
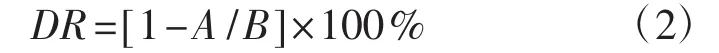
式中:A为菌株培养后培养基的吸光度值;B为空白培养基的吸光度值。
1.7 真姬菇栽培料中的酶活性分析
1.7.1 粗酶液提取
取真姬菇后熟期58 d的栽培料为酶活测定的试验材料,称取6 g栽培料置于50 mL离心管中,加入30 mL蒸馏水,30℃水浴2 h,过滤,离心,上清液为粗酶液。
1.7.2 漆酶酶活测定
向96孔板中依次加入0.15 mL的50 mmol·L-1的醋酸钠缓冲液 (pH 4.2)、50 μL 酶液、0.1 mL 的1 mmol·L-1ABTS,以灭活30 min的酶液为对照。使用酶标仪测定420 nm处5 min内的吸光度变化。定义每分钟转化1 μmoL ABTS所需的酶量为一个活力单位。酶活力(E,U·mL-1)的计算公式为:
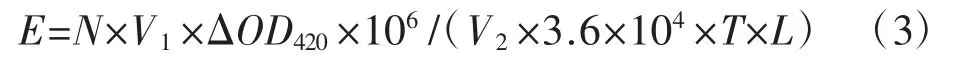
式中:N为酶液稀释倍数;V1为漆酶酶活测定反应体体系的终体积;V2为反应添加的酶液体积;OD420为t时间内反应液在420 nm处吸光度的增加值;3.6×104为420 nm处ABTS氧化态的摩尔吸光系数(L·mol-1cm-1);T为反应时间(min);L为96孔板孔的高度(cm)。
1.7.3 纤维素酶测定
纤维素酶测定方法参照参考文献[22]。
1.7.4 木聚糖酶活性测定
木聚糖酶测定方法参照参考文献[22]。
1.8 数据处理
应用Excel软件处理数据,通过SPSS 23.0软件分析数据。
2 结果与分析
2.1 真姬菇原生质体的酶解条件研究
2.1.1 酶解温度对真姬菇原生质体产量的影响
温度主要影响溶壁酶活性及细胞壁的生理状态[23],酶解温度对真姬菇原生质体产量的影响具有显著性差异,见图1。

图1 酶解温度对原生质体产量的影响Fig.1 Effect of enzymatic temperature on protoplast yield
如图1所示,随着温度升高,原生质体产量先增加后降低,酶解温度为32℃时,原生质体产量最大为4.50×106个/mL;酶解温度为34℃时,原生质体产量略有降低,为4.30×106个/mL,原生质体产量下降,原因可能为酶活性略有降低,酶解效果降低,但2种酶解温度下,原生质体产量无显著性差异,故筛选出来的最佳酶解温度为32℃。
2.1.2 酶解时间对真姬菇原生质体产量的影响
不同酶解时间下真姬菇原生质体的产量见图2。

图2 酶解时间对原生质体产量的影响Fig.2 Effect of enzymatic time on protoplast yield
图2结果表明酶解时间对真姬菇原生质体产量的影响具有显著性差异。在溶壁酶的作用下,真姬菇菌丝体逐渐变软,原生质体从菌丝尖端逐渐开始释放,随着酶解时间的增加,原生质体产量先增加后略微降低。酶解3.5 h时释放的原生质体最多,达到4.70×106个/mL;随着酶解时间的增加,原生质体产量降低,降低原因可能是由于菌丝体酶解完全,溶壁酶导致原生质体破裂,故3.5 h是最佳的酶解时间。
2.1.3 渗稳剂种类对真姬菇原生质体产量的影响
渗稳剂对维持反应体系中原生质体的渗透压稳定性至关重要[24],渗稳剂种类对真姬菇原生质体产量的影响结果见图3。
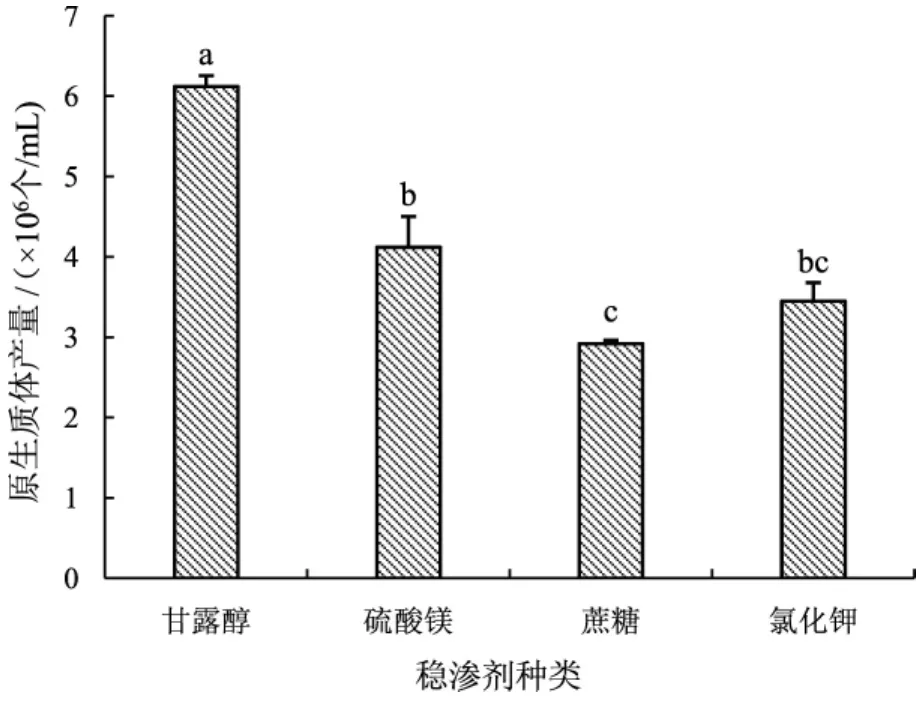
图3 渗稳剂种类对原生质体数量的影响Fig.3 Effect of the type of osmotic stabilizer on the number of protoplasts
如图3所示,以甘露醇作为渗稳剂时,真姬菇原生质体产量达到最大为6.12×106个/mL;以蔗糖作为渗稳剂时,原生质体产量最少为2.92×106个/mL;以硫酸镁和氯化钾作为渗稳剂时,两者对真姬菇原生质体的产量低且无显著性差异,故真姬菇菌丝体酶解的最佳渗稳剂为0.6 mol·L-1甘露醇。
2.1.4 溶壁酶浓度对真姬菇原生质体产量的影响
不同溶壁酶浓度对真姬菇原生质体产量的影响结果见图4。
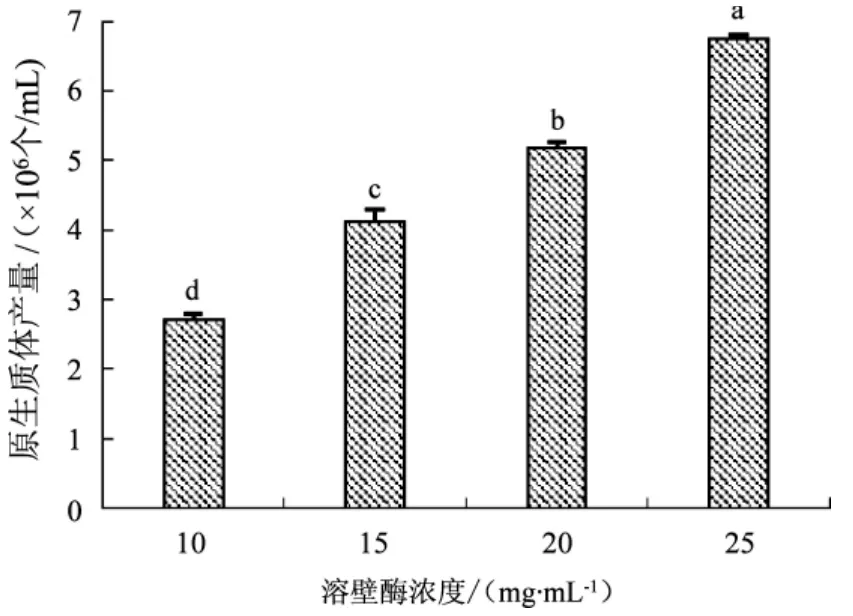
图4 溶壁酶浓度对原生质体产量的影响Fig.4 Effect of different lysozyme concentration on protoplast yield
如图4所示,不同溶壁酶浓度对真姬菇原生质体产量的影响具有显著性差异。随着溶壁酶浓度的增加,真姬菇原生质体产量逐渐增加,其原因是由于酶分子与菌丝体的接触增加,而当酶浓度为25 mg·mL-1时,原生质体产量达到最大,为 6.75×106个/mL,酶浓度在20 mg·mL-1时,原生质体产量为5.18×106个/mL,在节约溶壁酶用量,且能达到诱变要求(悬浮液纯化后原生质体数量为106个/mL) 的前提下[18],选用的溶壁酶浓度最佳为20 mg·mL-1。
2.2 真姬菇原生质体诱变条件的研究
诱变试验结果见图5。

图5 不同诱变时间对原生质体致死率的影响Fig.5 Effect of different mutagenesis time on the fatality rate of protoplast
如图5所示,随着诱变时间的增加,原生质体的致死率逐渐升高。诱变时间为100 s时,原生质体致死率达到90.3%。挑选致死率达到90%以上时仍存活的菌落于PDA培养基中。
2.3 双核菌丝筛选结果
常压室温等离子体诱变共获得290株再生菌株,镜检结果确定双核菌株288株,单核菌株2株。采用双核菌株进行菌株筛选,双核菌丝镜检图见图6。

图6 双核菌丝镜检图Fig.6 Microscopy figure of dikaryotic mycelium
如图6所示,图中箭头指示为锁状联合菌丝,即表明所观察菌株为双核菌株。
2.4 菌株初筛结果
2.4.1 菌株生长速度筛选结果
通过测定菌丝生长速度、浓密度、洁白度、边缘整齐度共获得30株菌丝生长速度大于出发菌株,其筛选结果见表1。

表1 诱变菌株和菌株O-T菌丝生长情况Tab.1 Mycelium growth of mutant strains and strain O-T
由表1可知,获得了30株菌丝生长速度大于出发菌株O-T、且浓密度、洁白度高且边缘整齐,其中22株诱变菌株的生长速度与出发菌株O-T之间具有显著性差异。
2.4.2 产酶能力较高的菌株筛选结果
将上述30个诱变菌株分别用于产纤维素酶和产漆酶能力的筛选,试验结果见表2。

表2 产酶能力较高的菌株筛选结果Tab.2 Screening results of strains with high enzyme production capacity
由表2可知,7株诱变菌株在以羧甲基纤维素钠为唯一碳源的培养基中的生长速度高于突变株,其中菌株M-105、M-50、M-65、M-212、M-56的生长速度与出发菌株O-T相比具有显著性差异。通过观察RB-PDA平板中的颜色变化情况,筛选出产漆酶能力较高的菌株4株,分别为菌株M-50、M-48、M-96、M-133,其中菌株M-50产2种酶的能力均高于出发菌株。
2.4.3 拮抗试验结果
将2.4.2中得到的产漆酶及纤维素酶能力较高的10株菌株及出发菌株O-T进行拮抗试验,结果见表3。

表3 拮抗试验结果Tab.3 Antagonistic test results
如表3所示,出发菌株O-T与诱变菌株M-94、M-96、M-53、M-133之间无拮抗反应,诱变菌株M-65与菌株M-94、M-48、M-133之间无拮抗反应。
2.5 菌株复筛
LBL液体培养检测结果见表4。

表4 11个菌株LBL脱色检测结果Tab.4 LBL decolorization test results of 11 strains
如表4所示,菌株M-212、M-96、M-50的脱色率显著高于出发菌株O-T。刘洋等[25]研究表明,显色反应与真姬菇产量具有一定相关性,培养基颜色越浅,脱色率越高,表明该菌株的结实性越好。
2.6 栽培料中的漆酶、纤维素酶、木聚糖酶活力结果分析
以真姬菇栽培过程中后熟期58 d的栽培料为试验样品,测定复筛得到的诱变菌株M-212、M-50、M-96及出发菌株O-T的产酶能力,酶活力测定结果见表5。

表5 4个菌株酶活力测定结果Tab.5 Results of enzyme activity of 4 strains
由表5可知,3株诱变菌株产漆酶能力及产木聚糖酶能力均显著性高于出发菌株O-T,表明这三株菌株降解木质素、半纤维素的能力较强;菌株M-212、M-50降解纤维素的能力显著高于出发菌株OT,诱变菌株M-96降解纤维素的能力略弱于出发菌株O-T。
3 结论
首次采用常压室温等离子体诱变技术对出发菌株O-T的原生质体进行诱变,由于原生质体无细胞壁,对外界诱变条件敏感,等离子体对原生质体诱变效率高。原生质体数量对诱变结果有很大影响,通过单因素试验筛选得到的最佳渗稳剂为0.6 mol·L-1甘露醇、最佳酶解温度为32℃、最佳酶解时间为3.5 h、最佳酶浓度为20 mg·mL-1,原生质体数量最大可达到6.75×106个/mL,足以满足诱变需求,该试验结果与已有的文献结果略有差异[18,26],造成的原因可能是不同菌株对溶壁酶的耐受能力有差别。
共获得诱变后产纤维素酶能力高的菌株7株,产漆酶能力高的菌株4株,但与平菇等(Pleurotus ostreatus)[27-28]相比,真姬菇菌株在产漆酶能力的平板筛选试验中变色不明显。采用2种平板筛选方法来筛选优势菌株,操作简便,结果直观。近年来,诸多研究者[29-30]采用LBL脱色检测来判断菌种退化程度,赵楚楚等[31]对LBL菌种质量评价方法进行了机理初探,表明发酵液变色与BTB作用活性物质的含量差异有关;刘洋等[25]研究表明LBL评价方法可对与真姬菇菌种质量相关的多个性状指标进行整合评价,进一步证明了该方法的可靠性,且LBL质量评价方法操作简便,具有较好的时效性,可更好的节约育种时间。
真姬菇在营养生长过程中会产生大量漆酶降解栽培基质以满足自身生长发育的需求,陈辉等[32]对真姬菇不同生长发育时期的酶活力进行测定,发现大多数漆酶基因的表达量在后熟40 d~60 d时持续提高。通过考察后熟58 d的真姬菇栽培料中的酶活力,并以此为依据验证筛选出优势菌株;所得优势菌株的产漆酶能力明显高于出发菌株O-T,进一步验证了其在基质降解转化能力上的优势,有利于菌株生长过程中营养转化。
