不同类型儿童吉兰-巴雷综合征的临床、神经电生理及治疗研究
2021-09-07李丽君李磊段丽芬沈勤朱萍王尚昆
李丽君,李磊,段丽芬,沈勤,朱萍,王尚昆
吉兰-巴雷综合征(Guillain-Barré syndrome,GBS)目前被认为是一类免疫介导的急性炎性周围神经病,其发病率约为(0.4~2.5)/10万,临床特征为急性起病,单相自限性病程,四肢肌力降低,腱反射减弱或消失,两周左右临床症状达高峰,神经电生理表现为多发性神经根及周围神经损害,常伴有脑脊液蛋白-细胞分离现象。根据神经电生理的表现可分为急性炎性脱髓鞘性多发神经根神经病(acute inflammatory demyelinating polyneuropathies,AIDP)、急性运动轴突性神经病(acute motor axonal neuropathy,AMAN)、急性运动感觉轴突性神经病(acute motor-sensory axonal neuropathy,AMSAN)、急性感觉神经病(acute sensory neuropathy,ASN)、急性泛自主神经病(acute panautonomic neuropathy)以及米勒-费雪综合征(Miller-Fisher syndrome,MFS)等,其中以AIDP及AMAN为最常见亚型,其余亚型较少见[1-4]。GBS的诊断、分型、疾病进展变化、判断预后都离不开神经电生理检查的支持[5-10]。对儿童GBS患儿的系统性临床及神经电生理研究,有利于推动对儿童GBS的认识和进一步规范诊疗,为国内多中心研究的开展提供一定理论依据。国内不同地区已有部分关于儿童GBS的研究报道,研究多集中于以下几方面:中东部发达地区,成人研究为主,影响预后的相关因素,免疫治疗集中于静注丙种球蛋白(intravenous immunoglobulin,IVIG)和血浆交换(Plasma exchange,PE)这两种疗法研究。本研究的目的在于探讨两种类型GBS(即脱髓鞘型和轴突型)的临床表现、神经电生理特征及免疫治疗的预后。本研究回顾性分析昆明医科大学附属儿童医院近5年余住院治疗的GBS患儿资料,旨在对云南地区儿童GBS的发病特点、临床及神经电生理进行归纳总结,以期提高云南多民族地区儿童GBS的诊疗及神经电生理诊断水平。
1 资料和方法
1.1 研究对象
选取2015年1月至2020年1月昆明医科大学附属儿童医院神经内科、综合内科、PICU以及康复科住院诊治的GBS患儿共40例,诊断标准符合中国GBS诊治指南2019[11]。排除标准:①由其它原因所导致的周围神经病变;②存在神经肌肉接头病变、肌肉病变或前角病变;③近期曾接受糖皮质激素、丙种球蛋白或免疫抑制剂治疗;④无法确定分型;⑤排外急性感觉神经病、急性泛自主神经病以及米勒-费雪综合征等少见GBS亚型;⑥临床资料不完整。其中37例患儿符合条件纳入本研究。
1.2 研究方法
1.2.1 神经电生理检查方法[12-13]
应用日本光电MEB-9200K肌电图/诱发电位仪在适宜室温下进行检查,被检者皮肤温度控制在32℃以上。刺激电流时限0.1~0.5 min、频率1 Hz、脉宽100~200 ms;运动神经传导:扫描速度2~3 ms/格,灵敏度5~10 mV/格,带通10 Hz至10 kHz;感觉神经传导:扫描速度1~2 ms/格,灵敏度20 μV/格,带通2 Hz~2 kHz。
测量并记录大部分患儿上肢(正中、尺、桡神经)、下肢(胫、腓总神经)的运动神经传导速度(motor nerve conduction velocity,MCV)、远端运动潜伏期(distal motor latency,DML)、近/远端复合肌肉动作电位波幅(proximal compound muscle action potential,pCMAP;distal compound muscle action potential,dCMAP);少部分患儿增加近端(腋、股神经)神经检查;部分运动神经(正中、尺、胫神经)测量F波潜伏期及出波率。测量并记录正中、尺、桡、腓肠、腓浅神经等感觉神经传导速度(sensory nerve conduction velocity,SCV )及感觉神经电位波幅(sensory nerve action potential,SNAP)。
运动神经传导检测( MCS):采用表面电极,记录电极置于相应肌肉的肌腹处,参考电极置于记录电极远端2~3 cm,地线置于记录电极与刺激电极之间。采取分段刺激:正中神经(肘上-肘下-腕)、尺神经(肘上-肘下-腕)、桡神经(桡神经沟-肘下)、腓总神经(腓骨小头上-腓骨小头下-踝)、胫神经(腘窝-踝)、腋神经(Erb点)、股神经(腹股沟)、面神经 (耳前)。
感觉神经传导检测(SCS):采用表面电极或指环电极,顺向法测定正中神经(指1、2-腕)、尺神经(指5-腕)、桡神经(背侧指1-腕上),逆向法测定腓浅神经(足背-小腿外侧)、腓肠神经(外踝下-小腿后)。
1.2.2 神经电生理判定标准
基于相关文献的肌电图正常值为依据[12-15],并结合本实验室对3岁以下儿童参考值做出的部分修正。3岁以上神经传导数值接近于成人,参考成人正常值进行比较。
1.2.3 GBS神经电生理分型标准[11]
急性炎性脱髓鞘性多发神经根神经病(AIDP):①NCS:至少有2根运动神经存在下列指标中的最少1项异常:DML延长>125%正常值上限(ULN);MCV<80%正常值下限(LLN); F波潜伏期>120%正常值上限(ULN)或出波率下降;传导阻滞:pCMAP/dCMAP<80%,且pCMAP时限/dCMAP时限<115%;波形离散:pCMAP时限/dCMAP时限>115%;②SCV明显减慢,可伴有SNAP降低。
急性运动轴突性神经病(AMAN):神经电生理改变包括以运动神经轴突变性为主和以可逆性运动神经传导阻滞为主两种情况[8-9]。①NCS至少3条神经符合以下标准:A.运动神经轴突变性型:所有测定神经均不符合AIDP标准中脱髓鞘的电生理改变,dCMAP<80%正常值下限(LLN);B.可逆性运动神经传导阻滞型:首次检查结果表现为传导阻滞,随着临床的好转,复诊时传导阻滞和远端CMAP波幅可有明显改善,而不伴有其它脱髓鞘证据[16]。②SCS:无感觉神经传导异常。
急性运动感觉轴突性神经病(AMSAN):①NCS:同AMAN;②SCS:SNAP下降或无法引出。
米勒-费雪综合征(MFS):少部分患者SNAP下降,SCV减慢;颅神经受累者可出现面神经CMAP下降;瞬目反射(Blink):R1、R2波潜伏期延长或波形消失。
1.2.4 肢体功能障碍评分
采用Hughes功能分级量表,由神经科医生对患儿病情高峰(即临床肌无力最严重时)的运动功能状态进行评判[17-19],Hughes评分如下:0级:正常;1级:轻微症状和体征,不影响正常社会生活;2级:无扶助下能独行5 m;3级:借助拐杖和助行器行走5 m;4级:在床上和轮椅上活动;5级:需要辅助通气;6级:死亡。由于儿童检查配合度较低,难以像成人一样准确评估四肢肌力及肌张力,故肌力及肌张力评价取患儿受检时临床功能障碍最重肢体的肌力及肌张力。
1.2.5 治疗方法[11]
所有患儿均静脉大剂量IVIG治疗,用法为400 mg/(kg·d),连续使用3~5 d;并给予维生素B1、B6、B12;加强营养支持及对症治疗如呼吸支持和抗感染治疗等。
1.3 统计学方法

2 结果
2.1 GBS的临床特征
入组的37例GBS患儿,其GBS类型及临床特征表现详见表1。由于除AIDP型外其余类型数量较少,故将其中两类AMAN及AMSAN统归于轴突型病变进行统计学分析。两组伴颅神经症状的患儿数量比较差异有统计学意义(P<0.05);住院期间病情最重时,两组肌力≤3级的患儿数量比较差异有统计学意义(P<0.05);两组患儿Hughes评分比较差异有统计学意义(P<0.05)。

表1 37例GBS患儿的临床资料比较(例)
2.2 神经电生理特征
共有40例患儿首次接受神经电生理检查,其中6例患儿首次神经电生理检查表现为四肢失神经电位,26例患儿为脱髓鞘型表现,7例患儿为轴突型表现, 1例患儿临床及电生理符合MFS诊断。 排外1例MFS患儿及2例无法分型患儿(首诊失神经电位表现,未按期复查,故无法确定GBS类型);其余37例患儿均于发病后4~6周再次门诊复查神经电生理,复诊时受检神经与首诊时保持一致,26例表现为脱髓鞘型,11例表现为轴突型。4例首次失神经电位表现的患儿,再次复查时CMAP仍显著下降而不伴有传导阻滞或波形离散等脱髓鞘改变,符合可逆性运动传导阻滞的AMAN,最终将其归为轴突型。
神经电生理有效数据的选择:①同一患儿不同肢体神经电生理结果与其临床表现一样,差异均有统计学意义。并对所检周围神经进行分析;②根据GBS的分型结果,回溯神经电生理的检查,将患儿各周围神经电生理检查结果进行分类汇总,并与其首次结果进行对比;③研究对象为儿童,部分神经检查结果(尤其是感觉神经检查)受到影响,故将少部分不能客观评价的结果予以排除。
运动神经检测异常结果为DML延长、dCMAP降低、MCV减慢、F波潜伏期延长、F波出波率降低和传导阻滞及波形离散等,37例GBS患儿首诊、复查时各项指标及恢复情况详见表2。
对于两种类型的GBS,反映运动神经功能的各项指标在复查时均有不同程度的改善,且它们的恢复比之间比较差异均有统计学意义(P<0.05)。脱髓鞘型神经的dCMAP恢复较轴突型快,而轴突型神经的DML、MCV、F波潜伏期及出波率恢复较脱髓鞘型快。
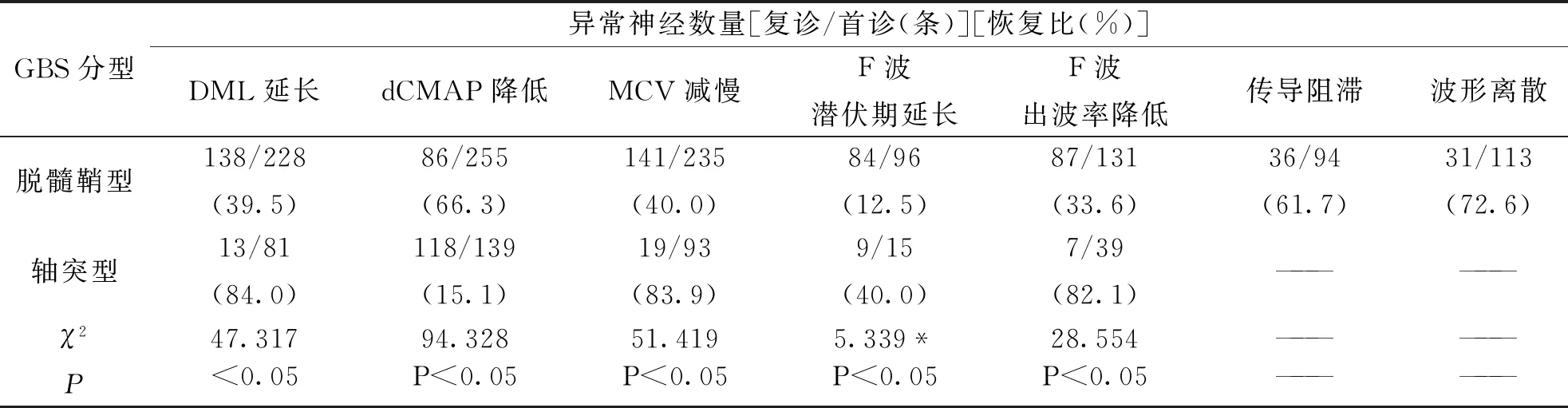
表2 37例GBS患儿的运动神经传导检测结果比较
感觉神经传导检测异常结果为SNAP降低和SCV减慢等,由于轴突型含有不伴感觉神经传导功能异常的AMAN,会拉低轴突型感觉神经异常率,故脱髓鞘型和轴突型的感觉异常检测结果不纳入统计分析。两次检查结果详见表3。与首诊时相比,复诊时脱髓鞘型GBS反映感觉神经指标的异常率反而升高,两者间差异有统计学意义(P<0.05)。

表3 37例GBS患儿的感觉神经传导检测结果比较[条(%)]
2.3 治疗效果
脱髓鞘型患儿的住院时间为(9.27±4.53) d,轴突型患儿的住院时间为(12.45±7.57) d,两种GBS类型患儿住院天数比较差异无统计学意义(P>0.05)。37例GBS患儿均于入院一周内进行IVIG治疗,并于发病后4~6周再次来院复查肌电图及进行肢体功能评估,结果详见表4、5。

表4 37例GBS患儿的肌力恢复情况比较(例)

表5 37例GBS患儿的Hughes Scales恢复情况比较(例)
3 讨论
3.1 发病特点
吉兰-巴雷综合征(GBS)的两个主要类型——脱髓鞘型和轴突型的占比在不同地区之间存在明显差异,美国和欧洲以脱髓鞘型为主,而日韩轴突型占比近五成[14,18]。近年来国内各地文献的报道也各不相同[10,20],我院接诊患儿GBS分型仍以脱髓鞘型(26例,65%)为主。国内GBS发病类型是否具有地域特点仍有待多中心研究。
脱髓鞘型和轴突型在发病性别及年龄方面比较差异均无统计学意义,大多均有前驱感染史,且多为呼吸系统感染,与相关报道一致[21]。近一半患儿发病集中于秋冬季(10月至次年1月),是否与秋冬季呼吸道感染高发有关不得而知。
3.2 临床表现
成人大多数就诊时就有典型的临床特征,而儿童年龄越小,症状越不典型,低龄儿童(<6岁)多以非典型临床表现为主,学龄前期儿童大多以拒绝行走、定位不明确的腿部疼痛、易怒、脑膜炎或步态不稳等为主诉就诊;学龄期儿童症状较为典型,大多表现为肢体无力和感觉异常[22]。这就导致对儿童GBS临床特征的判断难于成人,尤其是感觉症状和自主神经功能障碍判断更为不易。本研究显示,大部分患儿仍以肢体无力为首发症状,下肢表现重于上肢。
两种类型GBS与颅神经损伤的关系,各研究存在分歧。本研究显示轴突型的颅神经损伤发生率高于脱髓鞘型,与Fletcher等的研究结论一致[23]。而有的研究显示两者的颅神经异常率无明显差异[20,24],有的研究显示脱髓鞘型的颅神经损伤更多见[10,25]。病情高峰时轴突型肌力≤3级比例更高,说明其肌力降低更为显著,肢体无力症状更为突出;轴突型Hughes Scale评分>3分的比例更高,说明其功能影响更为显著。有文献[26]报道也指出儿童的轴突型GBS比脱髓鞘的GBS具有更严重的后果。
3.3 神经电生理表现
与首次肌电图检查相比,复诊时(约发病后4~6周)几乎所有的运动神经电生理异常结果均有不同程度的改善,说明此时周围运动神经功能有所恢复。有文献报道证实[27],在长达24个月的随访中,脱髓鞘型GBS与轴突型GBS的功能评价无差别。我们的研究认为,发病的一段时间内,脱髓鞘型神经的dCMAP恢复较轴突型快,而轴突型神经的DML、MCV、F波潜伏期及出波率恢复较脱髓鞘型快,说明其恢复情况与GBS电生理分型标准、病理以及损伤修复机制有关。轴突型就算合并部分脱髓鞘改变,但其程度较轻微,恢复较快;同理,脱髓鞘型就算合并部分轴突病变,但其程度也较轻微,恢复也较快。而脱髓鞘型神经的部分异常结果占比(SNAP、SCV)反而增高,说明感觉神经较运动神经受累晚,早期受累程度轻,本研究结果与文献一致[24]。可能由于感觉神经纤维较运动神经纤维粗,含有较多的髓鞘,对炎症的抵抗力较强,也导致其损伤修复较运动神经纤维滞后。
3.4 治疗
GBS的病因目前认为是外在致病因素与机体本身因素共同导致的周围神经免疫性疾病。其确切发病机制迄今为止尚未阐明,但其作为细胞免疫与体液免疫共同介导的自身免疫疾病已得到公认。所以其对症治疗也以免疫治疗为主,免疫治疗可以抑制异常免疫反应,消除致病因子导致的神经损伤,促进神经再生[28]。国外GBS诊疗指南[11,22]将PE及IVIG作为其首选治疗方式,IVIG可阻止GBS病情进展,缩短病程,减少辅助通气可能性,改善近、远期疗效。IVIG与PE的疗效相似,越早应用疗效愈佳。而由于PE只在有使用经验的中心提供,并且似乎比IVIG更可能产生不适感和并发症,因此IVIG通常是儿童GBS的一线治疗手段[22]。尽管人们期望糖皮质激素应用有利于降低炎症反应,但多项随机对照试验表明其对GBS治疗无明确疗效,甚至还会带来一些副作用[22,29]。部分指南及共识认为[30],PE和IVIG对GBS有益,而糖皮质激素治疗无效,但仍可考虑应用于由于病程延长而怀疑急性发作的慢性炎症性脱髓鞘性多发性神经病(A-CIDP)。然而受限于我国的经济发展水平等多种因素,国内许多地区仍将糖皮质激素应用于GBS早期或病情较重者的治疗[11]。而近年来对于IVIG治疗不同类型GBS的疗效尚有一定争议。部分文献报道IVIG治疗AIDP型和AMAN型恢复速度、治疗效果无明显差别;而另一些报道认为IVIG对AMAN型治疗无效,尤其是对儿童。还有的研究发现IVIG治疗AIDP型起效早于AMAN型,并且临床恢复较AMAN型快,但IVIG治疗1年后AMAN和AIDP型临床恢复情况无明显差别[20,24]。我们的研究发现,IVIG治疗两种类型的GBS,在起病后4~6周时,其肌力和功能恢复等指标两组比较差异无显著意义。
本研究的不足之处:①病例数较少,尚需累积扩大研究病例;②儿科患儿多不愿接受有创性针极肌电图检查,致使肌电图检查例数较少;③ 脑脊液及神经电生理检查患儿难以接受,缺乏患儿连续动态的实验室监测结果;④ 抗体检测受制于经济状况,接受度不高。
综上所述,我院接诊的云南地区GBS患儿仍以脱髓鞘型为主,发病多集中于秋冬季,临床表现为肢体无力和感觉障碍,下肢重于上肢。轴突型较脱髓鞘型颅神经损伤更为常见,肌力降低及功能障碍更为显著。脱髓鞘型GBS的感觉神经电生理功能恢复滞后于运动神经,不同类型的GBS神经电生理恢复各有其特点。儿童GBS应用IVIG治疗预后好,脱髓鞘型和轴突型预后比较差异无统计学意义。我们希望通过本研究可以更好地了解认识儿童GBS,并进一步提高西部地区儿童GBS的临床诊疗水平。
