缝合线成形术与人工瓣环成形术治疗三尖瓣关闭不全的效果比较
2021-09-07MateusMacho付蕾雅付庆林韩凯丽孙晓柯张亮罗鸿张新乔晨晖
Mateus T. N. Macho,付蕾雅,付庆林,韩凯丽,孙晓柯,张亮,罗鸿,张新,乔晨晖
(郑州大学第一附属医院 心血管外二科,河南 郑州 450052)
三尖瓣关闭不全(tricuspid regurgitation,TR)是右侧房室瓣膜疾病。微量或轻度TR在健康人中也比较常见。TR包括原发性和继发性2种类型。原发性TR是三尖瓣瓣膜本身的先天性或获得性异常引起的;继发性TR是三尖瓣瓣膜继发于三尖瓣环的扩张、腱索、左心疾病和肺动脉高压导致的右心室重构。三尖瓣成形术已成为TR矫正中最常用的技术,包括成形环成形和缝合线成形两种技术,均可以使瓣环缩小,瓣叶闭合。本研究比较不同三尖瓣成形术对TR的效果,为临床选择最有效的治疗方法提供循证学证据。
1 资料与方法
1.1 研究对象收集2012年2月至2019年3月于郑州大学第一附属医院接受三尖瓣成形术治疗的1 005例患者的临床资料。患者均在接受其他心脏疾病手术的同时接受三尖瓣成形术治疗。检索其住院病历和门诊随访时的超声心动图报告。排除未在郑州大学第一附属医院进行术后随访以及资料不全的患者,排除接受三尖瓣置换治疗的患者。根据手术方式将患者分为缝合线组和成形环组。1 005例患者:662例(65.9%)患者同时进行了左侧瓣膜手术[主动脉瓣置换术(aortic valve replacement,AVR)、主动脉瓣成形术(aortic valvuloplasty,AVP)、二尖瓣置换术(mitral valve replacement,MVR)、二尖瓣成形术(mitral valvuloplasty,MVP);274例(27.2%)患者同时接受了各种先天性心脏缺陷矫治术[房间隔缺损修补术(atrial septal defect repair,ASDR)、室间隔缺损修补术(ventricular septal defect repair,VSDR)、法洛四联症根治术(tetralogy of fallot repair,TOFR)、肺动脉瓣成形术(pulmonary valvuloplasty,PVP)和心内膜垫缺损修补术(endocardial cushion defect repair,ECDR)]的联合治疗;48例(4.8%)患者同时接受了冠状动脉旁路移植术(coronary artery bypass grafting,CABG)治疗或主动脉手术治疗(AVR+升主动脉置换+CABG,即Bentall手术);其余21例(2.1%)患者接受了其他较不常见的手术,如左房黏液瘤切除术和主动脉窦破裂修复术(aortic sinus rupture repair,ASSR)。见表1。
1.2 分组情况缝合线组483例(48.1%),包括接受Kay氏成形术62例(6.2%),经典或改良De Vega成形术421例(41.9%)。成形环组522例(51.9%),均为接受人工瓣环成形术的患者。缝合线组男175例,女308例,年龄22~65岁,平均(44.98±16.67)岁。成形环组男201例,女321例,年龄25~67岁,平均(50.57±12.68)岁。成形环组年龄大于缝合线组(P<0.05)。两组性别比较,差异无统计学意义(P>0.05)。
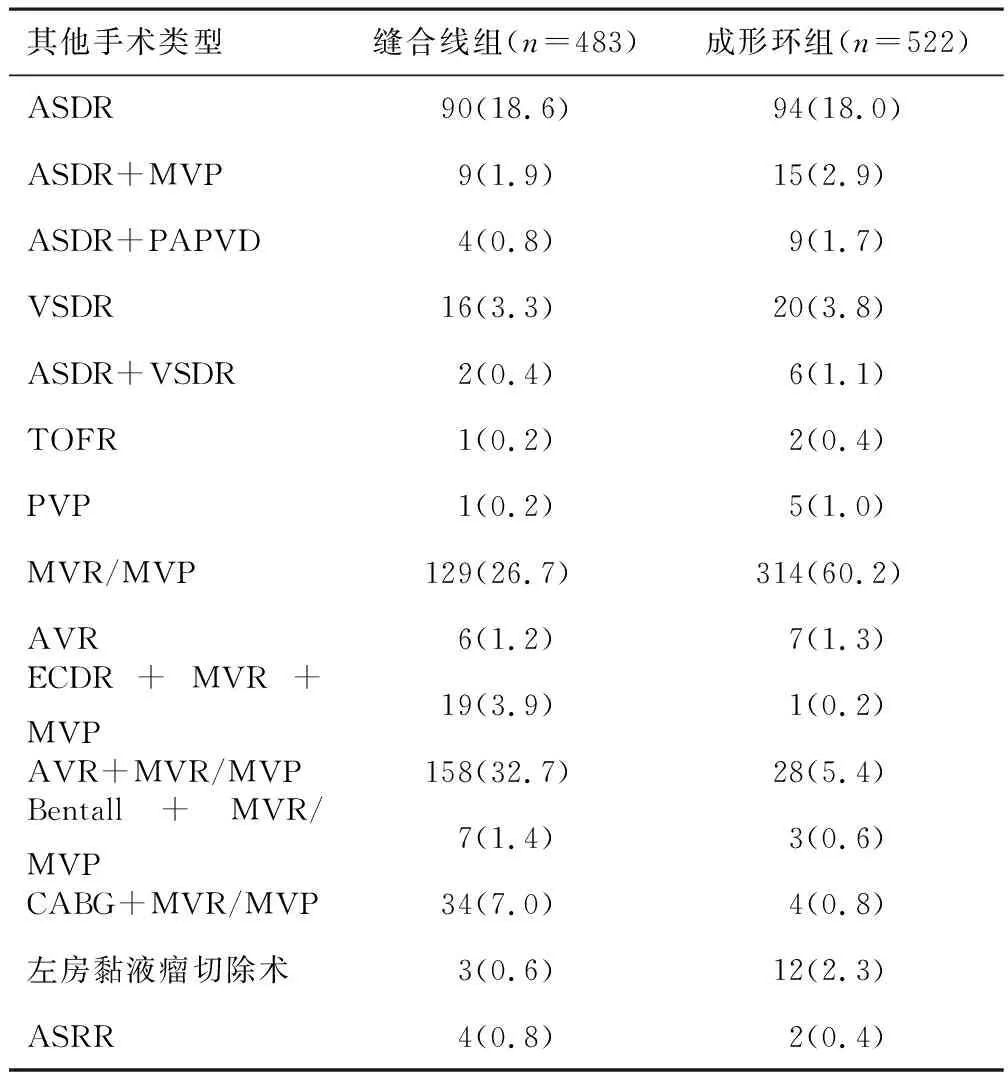
表1 三尖瓣成形术患者同时行其他手术的情况[n(%)]
1.3 手术方法手术均在气管插管全麻下进行。胸骨正中劈开进胸,常规建立体外循环,中度低温,对于时间长的患者应用冰屑局部降温。对缝合线组采用标准的Kay氏法,或标准的De Vega成形术,或改良的De Vega成形术[1]。对成形环组行人工瓣环成形术,使用MC3三尖瓣成形环进行三尖瓣成形。修复完成后均通过三尖瓣进行右室注水评估三尖瓣关闭情况,如不满意则再次修复后测试至满意。
1.4 随访术后通过电话通知患者定时门诊复查,随访时间点包括术后1个月、术后1 a和术后2 a。通过超声心动图评估心脏功能,记录术前、术后1个月、术后1 a和术后2 a的TR级别。三尖瓣反流级别分无/微量、轻度、中度和重度共4个等级[1]。同时记录4个时间点的右心房横径辅助评估三尖瓣功能。将所有随访时间点每例患者的超声心动图参数输入数据库中进行分析。
2 结果
2.1 三尖瓣反流情况(1)缝合线组术后1 a TR分级与术后1个月比较,差异无统计学意义(P>0.05);与术后1 a比较,缝合线组术后2 a三尖瓣反流程度进展(P<0.05)。见表2。(2)成形环组术后1 a TR分级与术后1个月比较,差异无统计学意义(P>0.05);与术后1 a比较,成形环组术后2 a三尖瓣反流程度进展(P<0.05)。见表2。(3)术前、术后1个月,成形环组TR分级较缝合线组严重(P<0.05);术后1 a和术后2 a,成形环组TR分级与缝合线组比较,差异无统计学意义(P>0.05)。见表2。
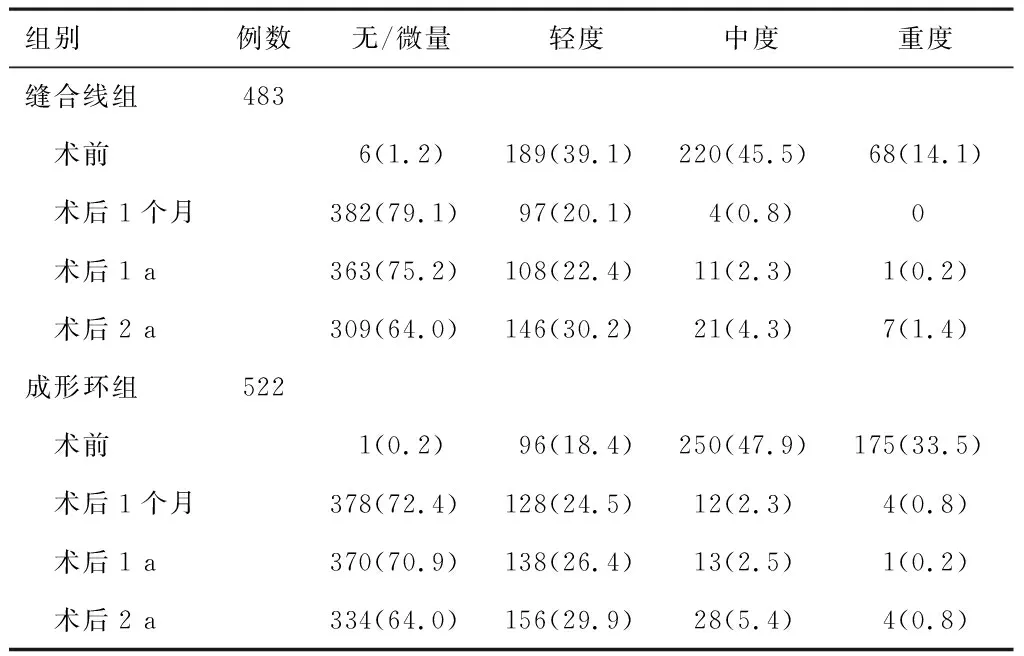
表2 两组在不同时间点三尖瓣反流情况比较[n(%)]
2.2 右心房横径情况重复测量方差分析结果显示,测量时间与手术方式交互作用无统计学意义(P>0.05),测量时间与手术方式主效应均有统计学意义(P<0.05)。两组4个时间点的右心房横径随着时间推移均逐渐缩小,并且两相邻时间点的缩小差异有统计学意义(P<0.05)。术前、术后1个月和术后1 a,成形环组右心房横径大于缝合线组(P<0.05)。术后2 a,成形环组右心房横径与缝合线组比较,差异无统计学意义(P>0.05)。见表3。
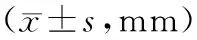
表3 两组不同时间点右心房横径比较
3 讨论
三尖瓣解剖结构复杂,由瓣叶、瓣环、腱索和乳头肌组成。正常的三尖瓣瓣环呈马鞍形[2],并被重要的解剖结构如冠状静脉窦、房室结、右冠状动脉和无冠窦所包绕。三尖瓣通常由3个大小不同的瓣叶组成(隔瓣、前瓣和后瓣)。但在某些患者中也可看到二叶或三叶以上的变异。隔瓣直接附着在三尖瓣瓣环上,最短且移动幅度最小。前瓣面积最大,移动性最大。后瓣面积最小,在约10%的患者中与前瓣有清晰的分界[3]。由于隔瓣相对固定在纤维三角上,因此瓣环扩张主要沿着前瓣和后瓣的附属装置处发生,即右心室的游离壁处,扩张导致瓣环变形,使瓣环变得更加平坦和圆滑。
TR是常见的心脏瓣膜疾病。微量或轻度TR在人群中的发病率约为1%,轻度TR被认为是正常变异[4]。数十年来,TR被认为是无症状性的良性疾病。中等或更高水平的TR也比较常见,占总人口的0.5%,75岁以后患病率上升,尤其是在女性和存在心房颤动的情况下[5],预后往往较差。
传统认为应该对TR进行内科治疗,继发性TR会随着原发病的治疗而得到改善。但是,最近的证据表明,慢性TR导致的右心室容量超负荷,长时间可能导致右心室心肌不可逆转重构。随着对TR的病理生理学研究的深入,现已将TR的处理逐步从保守方法转变为手术干预[6]。超声技术的进步和三维成像技术的发展有助于阐明三尖瓣的形态和TR的机制以及更加详细地评估其严重性和右心室重构程度。
继发性TR是最常见的TR类型。在80%的成年重度TR患者中,病因不是内在的瓣膜病理改变,而是获得性右心室环形扩张所致[7]。最常见的病因是左侧心脏病和(或)肺动脉高压,这会导致环形扩张和瓣叶受牵拉。如果不及时治疗,TR会逐渐进展,从而导致右心衰竭。
约20%接受心脏手术的患者有明显的TR。美国和欧洲的指南一致认为,接受左侧心脏手术的患者应借助手术矫治严重的TR[4]。对于中度TR瓣环扩张≥4 cm且有右心衰竭病史的患者,也建议进行手术治疗。单独三尖瓣手术后的死亡率较高,尽管最近有所改善,但目前的指南并未对单独三尖瓣手术提出具体建议[8]。对手术最佳时间和三尖瓣手术方法一直存在争议。目前心脏外科医生未对成形和置换的效果、成形环成形与缝合线成形术的效果形成共识。尽管指南之间存在不同并且缺乏全球共识,但多年来已经形成了一些习惯。通常首选瓣膜修复,以避免长期抗凝、瓣膜血栓形成或生物瓣膜退变失功的风险[9]。
多在进行左侧瓣膜手术时对继发性TR进行治疗,而很少进行单独的三尖瓣瓣膜手术,但对有症状或进行性加重的右心室重构的严重TR患者仍需开展手术治疗。这些患者中只有不到1%接受了手术治疗[10]。因为通常认为老年患者的手术死亡风险高,患者难以接受,尤其在存在右心室重构的情况下。患者可能长时间无症状,因此难以确定最佳干预时间。但是,对于原发性TR,成形主要取决于瓣膜的损坏程度。在严重三尖瓣瓣膜病变的患者中,置换可能比修复显示出更好的结果。起搏器导线引起的TR影响瓣叶的对合,通常需要重新放置导线,但当导线致瓣叶穿孔时,可能需要进行手术修复三尖瓣。对于继发性TR,目前多倾向于瓣膜修复[4]。虽然Marquis-Gravel等[11]报道与三尖瓣置换(2%)相比,三尖瓣成形术后持续严重TR的发生率更高(13%)。若术后可能有良好自身瓣膜功能的情况下,成形将明显优先于置换[12]。术前和术中需要详细评估每例患者的瓣膜病理情况,从而决定使用何种外科技术。
当前使用的三尖瓣成形技术可以分为人工瓣环成形和缝合线成形技术2种。 1965年Kay等[13]和1972年De Vega等[14]率先引入了早期缝合线技术修复TR。Kay技术是通过在三尖瓣后瓣环进行缝合线缝合,将瓣环缝缩。De Vega技术通过在三尖瓣瓣环周围放置2个半圆形的荷包线缝线来进行环形折叠。尽管最近研究表明,成形环成形术比缝合线成形术具有更好的长期效果,但目前这两种方法仍然在临床实践中广泛使用[15-17]。后来,Carpentier等[18]提出人工瓣环成形术。任何TR修复技术的最终目标均为恢复瓣叶的对合。但是,在1个或多个瓣叶有严重病变的情况下,单独的瓣环成形术将无法有效纠正瓣膜反流,并且可能需要进行扩大前叶[19]和四叶技术[20]等辅助治疗。
心脏外科医生对三尖瓣成形术的适应证、可行性、长期效果和成本-收益比方面仍然存在着较大争论。缝合线成形术的最大优点为技术简单、耗时少、成本低。然而,缝合线技术具有较高的TR复发的风险[21]。较多研究支持成形环成形术[4],但成形环修复术可能会使瓣环撕裂的风险增加。这可能是成形环导致作用于瓣环的剪切力增加所致。
严重的TR经常伴有瓣环扩张。此类患者应考虑进行人工环瓣环成形手术[22]。Navia等[21]对2 277例接受三尖瓣手术的患者进行了回顾性分析,发现与De Vega瓣环成形术相比,人工瓣环成形术的TR复发率更低。Pfannmüller等[16]研究显示,植入人工硬环三尖瓣成形术后瓣环开裂的发生率更高。
在本研究中,成形环组和缝合线组三尖瓣成形术后TR情况每个时间点均较术前有很大改善,但术后1 a和术后2 a三尖瓣反流情况有所进展。右心房横径逐渐减小,提示术后心功能持续恢复。本研究结果显示,成形环组术前TR分级较缝合线组严重,右心房横径大于缝合线组。这是由于更严重的TR病例更易于接受人工瓣环成形术。实际上三尖瓣反流程度和右心房直径是密切相关的2个指标,均反映三尖瓣的反流程度。这些患者通常表现为肺动脉高压,严重的瓣环扩张和右心室重构。一项回顾性研究不能控制术前各因素的分配。两组年龄也存在差异。因为人工瓣环成形术主要在老年患者中进行,而缝合线成形术主要在年轻患者中进行。
术后1个月,两组TR状况均有改善,两组此时的严重TR患者均低于1%。成形环组术后1个月TR分级较缝合线组严重。这种差异为缝合线组术前三尖瓣反流情况比成形环组轻所致,并非成形环组效果差导致的。两组患者术后1个月右心房横径均较术前缩短。术后1 a,两组三尖瓣反流情况相当。尽管缝合线组术后1个月随访时情况较好,但术后2 a随访时,两组三尖瓣反流情况均加重,但成形环组退变较慢,此时三尖瓣反流情况已无显著差异。两组右心房横径均可见进一步缩短。术后2 a,两组三尖瓣反流情况也相当。这说明了缝合线组TR状态的进展速度比成形环组快,这些发现与2 a随访期间TR等级的变化相吻合。许多研究报告了关于缝合瓣环成形术的结果和耐用性的类似发现[23-24]。
通过术后2 a的随访发现,人工瓣环成形术具有更好的效果。部分原因为人工瓣环可以更好地限制瓣环进一步扩大并使其直径保持相对恒定的范围,进而减慢TR的进展速度。另一方面,新一代的成形环具有3D形状,接近三尖瓣环原始的几何形状。这能够使其适应原有的结构,恢复其生理形状并防止瓣环扭曲,并保证人工瓣环和与自身的瓣环相吻合,其运动协调功能更好[25]。这是缝合线成形术所不能达到的。传统的De Vega技术的缺点是缝线可能会从组织上撕脱,从而无法使瓣叶很好地对合并防止环形扩张[26]。
综上所述,人工瓣环成形术和缝合线成形术均有良好的短期效果,能够改善TR,并使右心房横径缩短。但是,缝合线成形术的长期耐久性不如人工瓣环成形术。随着时间的推移,接受缝合线成形术治疗的患者的三尖瓣反流情况会逐渐加重,而人工瓣环成形患者在1~2 a随访期间,三尖瓣反流情况进展较慢。但是,本研究结论仅来自对超声心动图参数的分析,并且随访时间相对较短。未来的研究将结合超声和临床数据进行分析,并延长随访时间,可以更好地弥补当前研究的不足。
