乳腺癌中CBL表达及靶向CBL miRNA的筛选及意义*
2021-09-06刘敏罗昭逊黄健晏娇艳陆景润莫非张姝
刘敏, 罗昭逊, 黄健,3, 晏娇艳, 陆景润, 莫非,3, 张姝,3**
(1.贵州医科大学 医学检验学院, 贵州 贵阳 550004; 2.贵州医科大学 儿科学院, 贵州 贵阳 550004; 3.贵州医科大学附属医院 临床检验中心, 贵州 贵阳 550004; 4.贵阳市第一人民医院 医学检验科, 贵州 贵阳 550004)
乳腺癌是发生在乳腺上皮组织的最常见的恶性肿瘤,2020年已有230万新发BC病例,占所有癌症的11.7%[1]。随着手术、放化疗、内分泌治疗等治疗策略的不断完善及多模态成像设备的应用,BC的治疗疗效得到了极大的改善[2-4],但每年仍有约68万人死于BC。BC的发生发展被认为是一个多因素、多阶段、多基因改变协同调控的复杂网络结构[5]。因此,进一步深入研究BC的发生发展机制,寻找新干预靶点,对提高BC患者的生存质量具有重要的研究意义。Casitas B系淋巴瘤原癌基因(casitas b-lineage lymphoma,CBL),又称c-CBL或CBL2,位于人类染色体11q23.3上,是一种泛素E3连接酶,负责在不同类型的细胞中针对不同类型的刺激进行信号转导[6-8]。研究表明受体酪氨酸激酶(receptor tyrosine kinase,RTK)与胶质母细胞瘤的恶性进展呈正相关[9-10],CBL可导致RTK的泛素化,致使其降解[11-12],抑制肿瘤的发生发展[13-14]。因此CBL可能在人类癌症的发病机制中起抑癌作用。陆景润等[15]的研究发现CBL在BC组织中表达下调,但对其作用机制未作深入了解。为进一步探究CBL在BC中的作用机制,本研究检测了BC组织中CBL的表达水平,并进一步利用生物信息数据库预测与其有相互作用的微核糖核酸(microRNA,miRNA),旨在探讨CBL在BC癌变进程中发挥的作用及其对应的上游调控机制。
1 材料与方法
1.1 材料
1.1.1样本收集 收集2015年1月—2018年12月乳腺外科的30对BC组织及癌旁组织(距肿瘤边缘2~5 cm),均为女性,36~69岁、平均55.5岁,所有患者均经病理学分析证实为BC,且为初次诊断。
1.1.2主要试剂 TRIzol试剂及引物合成(上海生工生物工程有限公司),逆转录Kit及实时荧光定量PCR试剂[宝日医生物技术(北京)有限公司],RIPA裂解液、BCA试剂盒及蛋白Marker(北京索莱宝科技有限公司),兔抗人CBL抗体(abcam公司),兔抗人GAPDH一抗(沈阳万类生物科技有限公司),羊抗兔二抗(Proteintech公司)。
1.1.3主要仪器 普通PCR仪(美国Thermo Scientific公司),实时荧光定量PCR仪(Roche),Western blot电泳仪、转印系统、曝光仪[伯乐生命医学产品(上海)有限公司]。
1.2 方法
1.2.1逆转录-实时荧光定量聚合酶链式反应(quantitative and reverse transcription polymerase chain reaction, qRT-PCR)验证CBL基因及hsa-let-7e-5p的表达 在BC组织和癌旁组织中检测CBL和hsa-let-7e-5p的表达情况:TRIzol法提取BC组织及癌旁组织总RNA,总RNA逆转录为cDNA后用于qRT-PCR,所用的引物序列见表1。

表1 引物序列Tab.1 Primer sequence
1.2.2Western blot验证CBL蛋白的表达 在BC组织和癌旁组织中检测CBL蛋白的表达情况:RIPA裂解BC组织及癌旁组织并提取总蛋白,BCA法测定蛋白浓度;使用SDS-PAGE凝胶进行电泳,200 mA恒定电流转膜2 h,5%脱脂牛奶封闭2 h,使用相应的一抗在4 ℃条件下孵育过夜,TBST洗膜3次后,将二抗于室温下孵育1 h,孵育完成后TBST洗膜3次进行曝光。
1.2.3CBL基因的生存分析 Kaplan-Meier Plotter(http://kmplot.com/analysis/)[16]数据库是一个与恶性肿瘤预后相关的在线分析数据库,可以评估54 000多个基因在21种癌症类型中对于患者预后的影响。以KaplanMeierPlotter数据库为基础,评价CBL基因在BC患者中的预后价值,并绘制了KaplanMeier生存曲线。
1.2.4TIMER数据库分析CBL与多种免疫细胞的相关性 肿瘤免疫评估资源数据库(tumor immune estimation resource, TIMER)可全面研究肿瘤与免疫相互作用的分子特征[17]。使用该数据库对CBL与BC中6种免疫细胞的相关性进行分析,包含B细胞、CD8+T细胞、CD4+T细胞、巨噬细胞、中性粒细胞和树突状细胞。检索条件如下:(1)Gene Symbol,CBL;(2)Cancer Types,BRCA。
1.2.5靶向CBLmiRNAs的预测 通过TarBase(http://carolina.imis.athena-innovation.gr/diana_tools/web/index.php?r=tarbasev8/index)和miRWalk(http://mirwalk.umm.uni-heidelberg.de/)[18]数据库预测与CBL相关的miRNAs,将结果分别上传到Venn在线工具(http://bioinformatics.psb.ugent.be/webtools/Venn/)中,将两个数据库的预测结果取交集后,获得重叠的miRNAs。
1.2.6CBL与靶向CBLmiRNA结合位点的预测 将CBL3′非翻译区(untranslated Regions, UTR)的序列与hsa-let-7e-5p的序列输入RNAhybrid 2.2[19]软件,依据该网站的运算规则,对结合位点进行预测,选取最小配对自由能对应的位点作为CBL3′ UTR与hsa-let-7e-5p的结合位点。
1.2.7生物信息学工具分析miRNAs的表达情况 UCSC Xena网站[20](https://xenabrowser.net/datapages/)集合了包括TCGA、CCLE等在内的200多个数据集,利用该网站从TCGA数据库下载756例BC组织样本和76例正常乳腺组织中预测的5种miRNAs的表达谱,并对其表达进行分析。
1.3 统计学分析
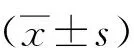
2 结果
2.1 CBL在BC组织中的表达
qRT-PCR检测结果显示,与癌旁组织比较,BC组织中CBL表达下调(P<0.05)。见图1A。Western blot检测结果显示,与癌旁组织比较,BC组织中CBL蛋白表达下调(P<0.05)。见图1B。与qRT-PCR结果趋势一致。
注:A为qRT-PCR结果,B为Western blot结果;(1)与癌旁组比较,P<0.05。图1 qRT-PCR及Western blot检测CBL在BC组织中的表达Fig.1 Detection of CBL expression in BC by qRT-PCR and Western blot
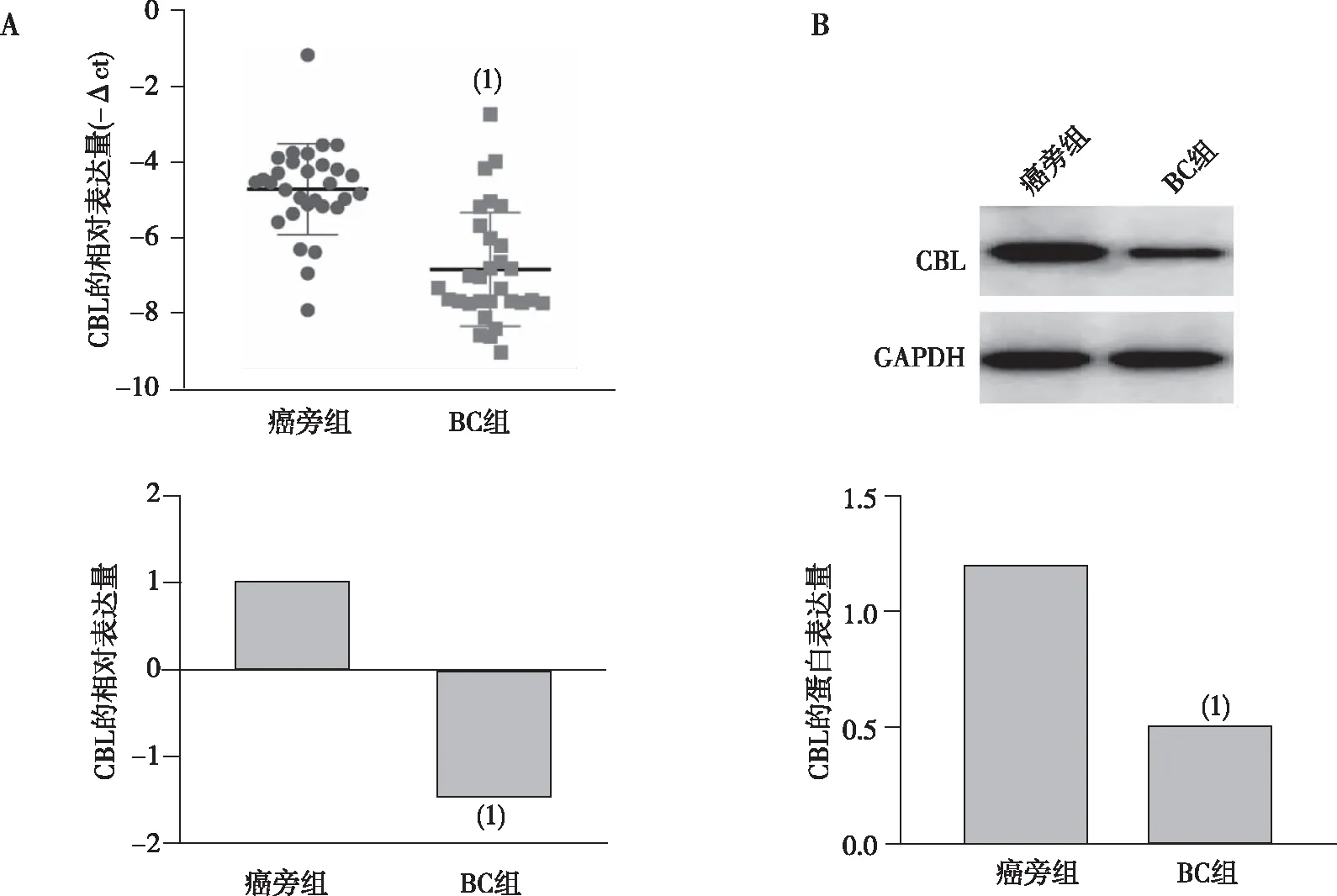
2.2 BC患者肿瘤组织中CBL的表达与临床资料的关系
CBL的表达水平与患者的转移情况显著相关(P<0.05),而与BC患者的pTNM分期、分子分型及年龄无关。见表2。
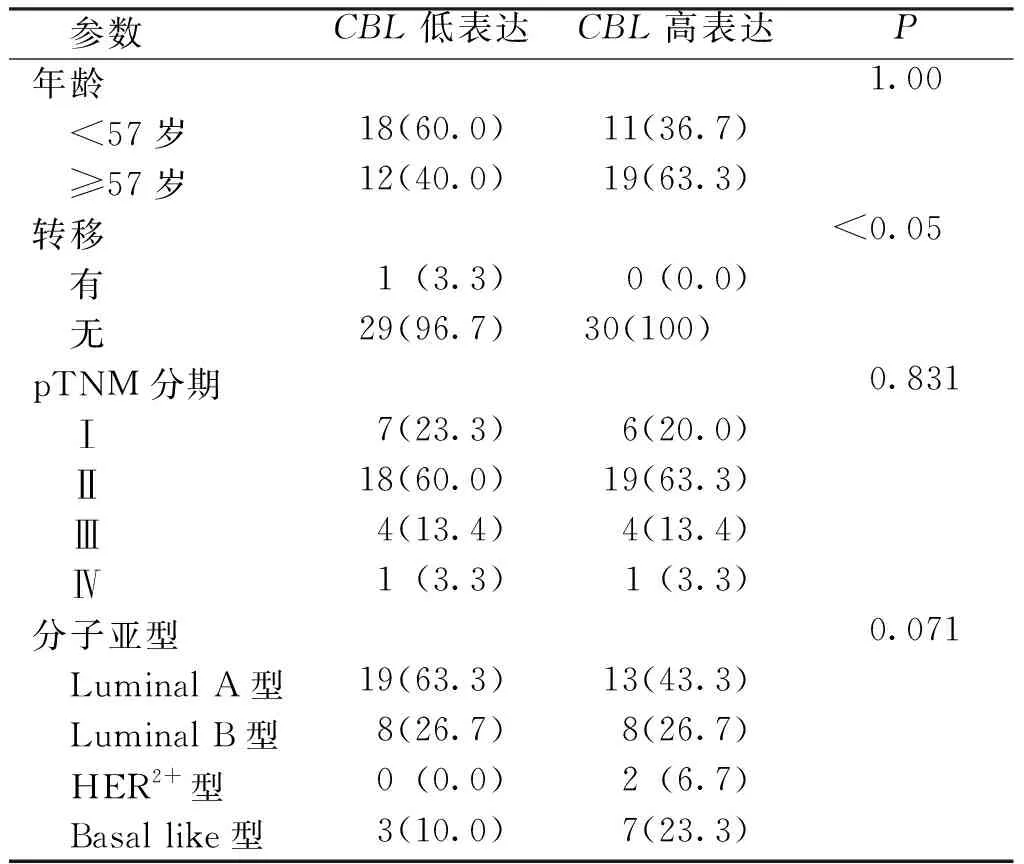
表2 CBL的表达与BC患者临床资料的关系[n(%)]Tab.2 Correlation between the expression of CBL and the clinical data of patients with BC[n(%)]
2.3 CBL高表达与BC患者的预后的相关性
CBL与BC患者的总生存期(overall survival,OS)有关,差异有统计学意义(P<0.05),高表达CBL的BC患者OS较短,预后较差。见图2。
图2 CBL与BC患者的预后相关性Fig.2 Correlation of CBL and the prognosis of BC patients
2.4 CBL的表达与BC的肿瘤纯度和免疫浸润水平相关性
CBL的表达与肿瘤的纯度呈负相关性,差异有统计学意义(r=-0.118,P<0.05);与B细胞(r=0.183,P<0.05)、CD8+T细胞(r=0.392,P<0.05)、CD4+T细胞(r=0.329,P<0.05)、巨噬细胞(r=0.34,P<0.05)、中性粒细胞(r=0.404,P<0.05)和树突状细胞(r=0.333,P<0.05)呈正相关性。见图3。
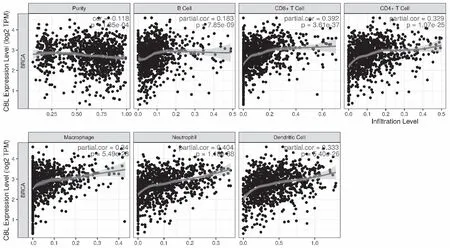
注:Purity为肿瘤纯度,B Cell为B细胞,CD8+ T Cell为CD8+ T细胞,CD4+ T Cell为CD4+ T细胞,Macrophage为巨噬细胞,Neutrohil为中性粒细胞,Dendritic Cell为树突状细胞。图3 BC中CBL的表达与肿瘤纯度和免疫细胞浸润水平的相关性Fig.3 Correlation of CBL expression in BC with tumor purity and immune cell infiltration level
2.5 靶向CBL miRNA的预测
为进一步探索CBL的作用机制,本研究利用TarBase和miRWalk数据库预测与CBL相关的miRNAs,分别有20个和958个;利用Venn在线工具将两者取交集共获得5个miRNAs,分别为hsa-miR-7-5p、hsa-miR-28-5p、hsa-miR-378a-3p、hsa-miR-876-3p及hsa-let-7e-5p。见图4。

注:深色为TarBase预测的作用于CBL miRNAs,浅色为miRWalk预测的作用于CBL miRNAs。图4 韦恩图获取预测的miRNAs的交集Fig.4 Venn diagram to obtain the intersection of predicted miRNAs
2.6 hsa-let-7e-5p与CBL结合位点的预测
通过RNAhybrid 2.2软件对CBL3′UTR的序列与hsa-let-7e-5p的结合位点进行预测,发现在CBL的3′ UTR的第5017个核苷酸处存在结合位点,表明hsa-let-7e-5p可能通过与CBL结合发挥生物学功能。见图5。

图5 预测的CBL 3′UTR与hsa-let-7e-5p的结合位点Fig.5 Predicted binding site of CBL 3′UTR and hsa-let-7e-5p
2.7 靶向CBL miRNAs在BC组织中的表达
为进一步验证与靶向CBLmiRNAs,本研究从TCGA数据库下载并分析5个miRNAs在BC组织中的表达,结果显示hsa-miR-28-5p、hsa-miR-378a-3p和hsa-miR-876-3p在BC组织中低表达,而hsa-let-7e-5p和hsa-miR-7-5p在BC组织中高表达(P<0.05)。见图6A。结合miRNA-mRNA的负调控机制以及文献检索[21],本研究将hsa-let-7e-5p作为后续研究对象,利用qRT-PCR对30例BC组织及相应的癌旁组织进行检测,发现hsa-let-7e-5p在BC组织中高表达(P<0.05)。见图6B。这一结果与生物信息学所得趋势一致。

注:A为TCGA数据库中5种miRNAs的表达,B为hsa-let-7e-5p在BC组织中的qRT-PCR验证结果;(1)与正常组比较,P<0.05;(2)与癌旁组织比较,P<0.05。图6 miRNAs在正常组织或癌旁组织及BC组织中的表达Fig.6 The expression of miRNAs in normal tissues or adjacent tissues and BC tissues
3 讨论
BC是女性最为常见的恶性肿瘤之一,且发病率和病死率逐年增长[22],成为威胁女性健康的“头号杀手”。由于BC发病早期缺乏典型性和特异性临床症状及体征,多数患者确诊时已有淋巴结、骨及脑等远处转移的中晚期体征,严重威胁女性的身心健康,成为女性癌症死亡的最大原因。因此,寻找干预BC发生发展的靶标已成为当代学者研究的热点。CBL是一种蛋白质编码基因,可编码含有RING (really interesting new gene)指结构域的E3泛素-蛋白质连接酶。编码的CBL蛋白可介导泛素从E2泛素结合酶转移至特定底物。此外还包含一个N末端磷酸酪氨酸激酶结合域,该结构域可使其与众多酪氨酸磷酸化的底物相互作用,并使得蛋白酶体降解。因此,CBL可充当许多信号转导途径的负调节剂。研究表明,CBL在胰腺导管腺癌[23]、非小细胞肺癌[11]及结直肠癌[12]的发生、发展、治疗及预后中发挥重要作用。Jing等[24]在神经胶质瘤患者样本中通过免疫组织化学、Western blot和qRT-PCR实验,绘制KaplanMeier生存曲线,并进行Cox回归分析表明胶质瘤中c-Cbl高表达与肿瘤进展和不良预后有关。Yu等[12]发现miRNA-155可靶向作用于CBL调控结肠癌细胞的增殖、细胞周期、凋亡和迁移。以上研究说明CBL与癌症的发生发展存在密切的关系。为进一步探究CBL在BC中的作用,本研究利用qRT-PCR和Western blot从mRNA和蛋白层面检测了BC组织中CBL的表达,两者结果均显示BC组织中CBL表达下调。KaplanMeier分析显示CBL低表达,患者预后好。对BC患者临床病理资料与CBL相对表达量相关性分析显示,CBL与转移情况有关。本研究表明BC组织中可见大量免疫细胞浸润,参与BC的发生发展[25]。不仅如此,CBL的表达与肿瘤的纯度呈负相关性,与B细胞、CD8+T细胞、CD4+T细胞、巨噬细胞、中性粒细胞和树突状细胞呈正相关性,提示CBL与BC的免疫浸润相关,可能通过与免疫细胞相互作用而影响BC的进展,但具体的作用机制仍需进一步探索。
miRNA是一类长度约20~22个寡核苷酸的短小单链非编码RNA。miRNA可通过与其靶基因的mRNA的3′UTR结合,降解靶基因mRNA或抑制靶基因的翻译,最终起到调控靶基因蛋白表达的作用,在癌症中间接发挥抑癌因子或促癌因子的作用[26-27]。生物信息学分析与qRT-PCR结果均显示hsa-let-7e-5p在BC组织中高表达,这与Oztemur[28]和Silva等[29]的报道一致。hsa-let-7e-5p在BC组织中高表达而CBL低表达,且hsa-let-7e-5p与CBL的3′UTR之间存在结合位点,以上结果提示hsa-let-7e-5p可负调控CBL。因此,本研究推测hsa-let-7e-5p通过负向调控CBL的表达,影响BC的发生发展。
综上所述,CBL可作为BC的潜在生物标志物,其低表达与BC患者的预后相关。hsa-let-7e-5p可能通过负向调控CBL的表达来发挥生物学功能,但具体作用机制有待进一步探索和研究。
