乳腺癌中关键基因及靶向治疗化合物的筛选*
2021-09-06刘敏黄健晏娇艳杨烨袁艳何芸宋孝晗莫非罗昭逊张姝
刘敏, 黄健,, 晏娇艳, 杨烨, 袁艳, 何芸, 宋孝晗, 莫非,, 罗昭逊, 张姝,**
(1.贵州医科大学 医学检验学院 临床检验基础与血液学教研室, 贵州 贵阳 550004; 2.贵州医科大学附属医院 临床检验中心, 贵州 贵阳 550004; 3.贵州医科大学 儿科学院, 贵州 贵阳 550004)
乳腺癌(breast cancer, BC)是发生在乳腺上皮组织的恶性肿瘤[1],由于其发病早期缺乏典型性和特异性临床症状及体征,多数患者临床确诊时已发展至中晚期,成为导致女性BC死亡的最大原因[2]。目前临床诊断BC常用的病理学、影像学及血清肿瘤标志物等方法存在的某些不足,限制了它们在BC诊断中的应用。随着基因组技术的发展,生物信息学广泛应用于基因表达谱分析,可以有效地识别差异表达基因(differentially expressed genes, DEGs)及其作用的相关通路,也发现某些疾病特异性的生物标志物[3-4]。因此,本研究利用生物信息学相关工具从基因表达数据库(gene expression omnibus,GEO)中检索并整合分析与BC相关的数据集获得DEGs,预测其功能及在BC中的作用;选取乳腺外科30对BC组织及癌旁组织,从mRNA水平和蛋白质层面验证其表达,同时采用Cmap (connectivity map, Cmap)数据库分析和挖掘与DEGs具有相互作用的候选化合物,以期为研发治疗BC的潜在化合物提供新的思路。
1 材料与方法
1.1 材料
1.1.1数据集 从GEO数据库下载3个独立的BC微阵列数据集GSE109169、GSE42568和GSE15852。GSE109169数据集基于GPL5175(HuEx-1_0-st) Affymetrix Human Exon 1.0 ST Array[transcript (gene) version] 平台,包括25例BC组织样本和25例正常乳腺组织;GSE42568中有104例BC组织样本和17例正常乳腺组织,是基于GPL570(HG-U133_Plus_2) Affymetrix Human Genome U133 Plus 2.0 Array平台检测的;GSE15852数据集基于GPL96(HG-U133A) Affymetrix Human Genome U133A Array平台,包含的BC组织样本和正常乳腺组织均为43例。
1.1.2样本收集 收集2015年1月—2018年12月乳腺外科30对BC组织及癌旁组织(距肿瘤边缘2~5 cm),均为女性,36~69岁、平均55.5岁,所有患者均经病理学分析证实为BC,且为初次诊断。
1.1.3主要试剂及仪器 TRIzol试剂及引物合成(上海生工生物工程有限公司),PrimeScriptTMⅡ 1st Strand cDNA Synthesis Kit及实时荧光定量PCR试剂[宝日医生物技术(北京)有限公司],RIPA裂解液、BCA试剂盒及蛋白Marker(北京索莱宝科技有限公司),兔抗人的11个关键基因(Hub)基因编码的蛋白一抗(abcam公司,基因中英文名见表1),兔抗人GAPDH一抗(沈阳万类生物科技有限公司),羊抗兔二抗(Proteintech公司)。普通PCR仪(美国Thermo Scientific公司),实时荧光定量PCR仪(Roche),Western blot电泳仪、转印系统、曝光仪[伯乐生命医学产品(上海)有限公司]。
1.2 方法
1.2.1DEGs的识别 通过GEO2R筛选和鉴定BC组织和正常乳腺组织之间满足条件的DEGs,以P<0.05和|log2FC|≥1为截断值,其中log2FC<-1的DEGs认为是下调DEGs,log2FC≥1的DEGs认为是上调DEGs。使用Venn在线工具(http://bioinformatics.psb.ugent.be/webtools/Venn/)对3个独立数据集中上调和下调的DEGs进行可视化,并将3者交集部分的重叠DEGs用于后续分析。
1.2.2DEGs的富集分析 利用DAVID数据库(版本6.8,https://david.ncifcrf.gov/)[5]进行基因本体论(gene ontology, GO)功能和京都基因与基因组百科全书(kyoto encyclopedia of genes and genome, KEGG)富集分析,了解重叠DEGs的生物学功能和作用的途径。通过EXCEL和R软件包“ggplot2”对结果进行可视化,P<0.05认为差异具有统计学意义。

表1 11个Hub基因中英名全称Tab.1 Identified 11 Hub genes
1.2.3蛋白互作(protein protein interaction, PPI)网络的构建与模块化分析 将筛选出的所有DEGs导入到STRING中进行蛋白质相互作用分析,采用Cytoscape (https://cytoscape.org/)软件将PPI网络可视化后,使用MCODE插件筛选PPI网络中score>10的模块,此外,将该模块中Degree≥10的基因作为后续研究对象。
1.2.4Hub基因的生存分析与验证 (1)以Kaplan Meier Plotter(http://kmplot.com/analysis/)在线工具为基础,评价Hub基因在BC患者中的预后价值,并绘制Kaplan Meier生存曲线;利用基因表达谱交互分析(gene expression profiling interactive analysis, GEPIA)数据库从基因层面验证Hub基因在BC组织和正常乳腺组织中的表达情况,并将结果显示在箱线图中。(2)逆转录-实时荧光定量聚合酶链式反应(quantitative and reverse transcription polymerase chain reaction, qRT-PCR)验证11个Hub基因在BC组织和癌旁组织中的表达:TRIzol法提取BC组织及癌旁组织总RNA,并使用 Nanodrop 2000 进行定量及纯度测定,所得RNA均于-80 ℃保存;使用PrimeScriptTMⅡ 1st Strand cDNA Synthesis Kit将总RNA逆转录为cDNA后用于qRT-PCR,所用的引物序列见表2。(3)Western blot验证11个Hub基因编码的蛋白在BC组织和癌旁组织中的表达:RIPA裂解BC组织及癌旁组织并提取总蛋白,BCA法测定蛋白浓度;使用SDS-PAGE凝胶进行电泳,200 mA恒定电流转膜2 h,5%脱脂牛奶封闭2 h,使用相应的一抗在4 ℃条件下孵育过夜,TBST洗膜3次后,将二抗于室温下孵育1 h,孵育完成后TBST洗膜3次进行曝光。

表2 引物序列Tab.2 Primer sequences
1.2.5Hub基因编码蛋白的免疫组织化学分析 (1)利用人类蛋白质图谱(the human protein atlas, HPA)数据库:明确Hub基因编码的蛋白在BC组织和正常乳腺组织中的表达,并获得具有代表性的免疫组织化学染色图像。(2)免疫组织化学染色分析11个Hub基因编码蛋白在BC组织和癌旁组织中的表达情况:将BC组织和癌旁组织用石蜡包埋,制成4 mm厚的切片,将切片脱腊、加热修复抗原,使用山羊血清进行封闭,一抗4 ℃过夜、PBS清洗后加二抗37 ℃孵育30 min,使用二氨基联苯胺(DAB)显色,苏木素复染30 s使细胞核显色、脱水、中性树胶封片,最后观察11个Hub基因编码蛋白的表达。
1.2.6候选化合物的鉴定 将筛选出的DEGs上传到Cmap数据库(https://portals.broadinstitute.org/cmap)。在排列的结果中,分数从-1~1表示药物与上传DEGs之间的相关性;负值高的化合物表明其与DEGs的相关性越高,并且更有可能用于治疗[6]。本研究保留P<0.05且值为-0.8~-1的化合物,并将这些化合物导入PubChem Compound网站绘制它们的三维结构。
1.3 统计学方法
采用SPSS 24.0软件进行统计分析,用非参数检验分析Hub基因或其编码蛋白在BC中的表达,Kaplan-MeierPlotter数据库分析Hub基因与BC患者预后的关系,P<0.05差异有统计学意义。
2 结果
2.1 DEGs筛选结果
共筛选出294(110个上调、184个下调)、2 854(1 345个上调、1 509个下调)及818个(353个上调、465个下调)DEGs,这些DEGs在BC组织和正常乳腺组织中表达比较,差异有统计学意义(图1A~C)。经Venn在线工具取交集,共鉴定出115个重叠的DEGs,其中26个上调、89个下调(图1D~E)。
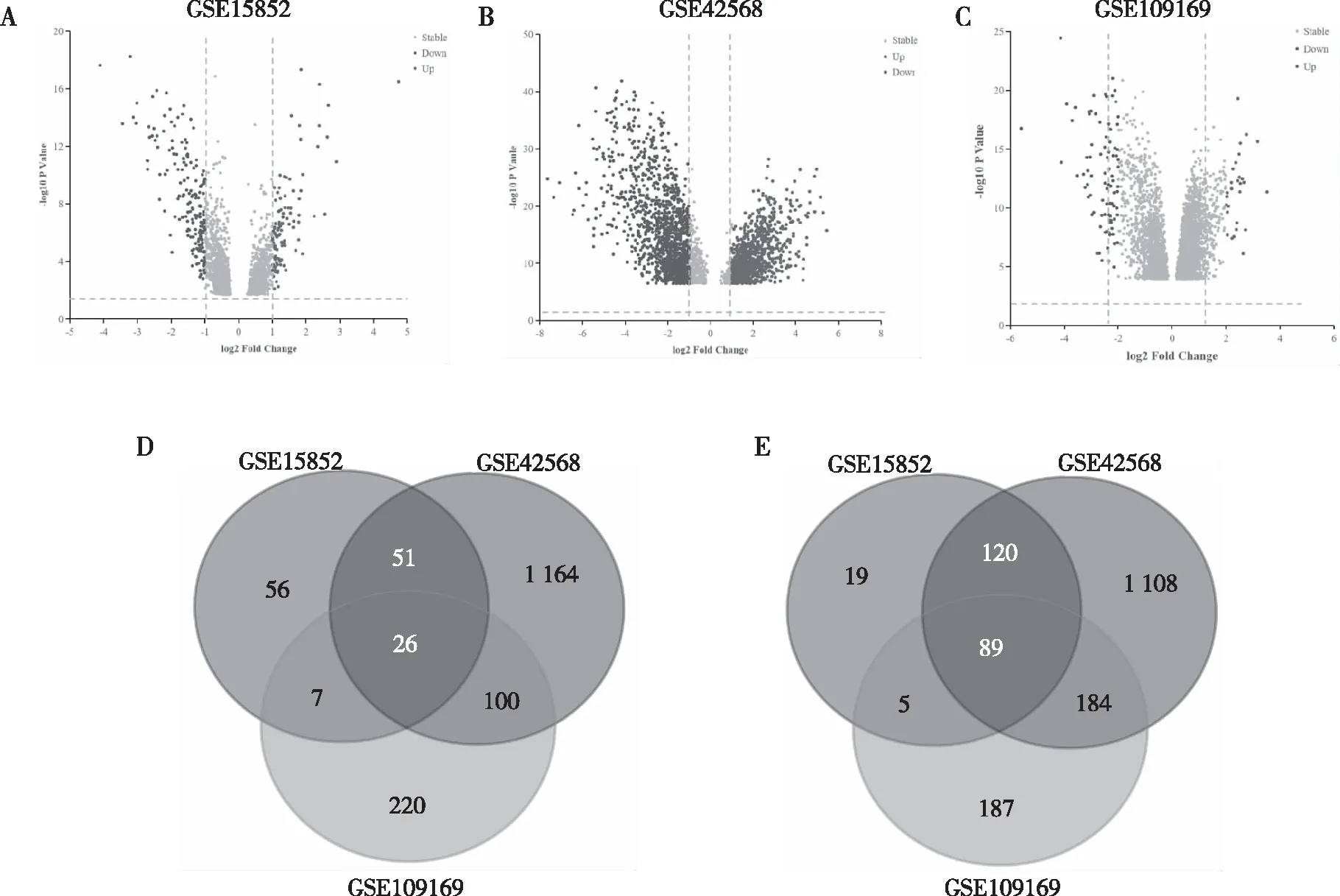
注:A~C分别为GSE15852(A),GSE42568(B)和GSE109169(C)的DEGs的火山图,D~E为3个数据集中重叠DEGs的Venn图,包括26个上调的DEGs (D)和89个下调的DEGs (E)。图1 正常乳腺组织与BC组织中DEGs筛选结果Fig.1 Screening results of DEGs in normal breast tissue and BC tissue
2.2 DEGs的功能富集分析
2.2.1分子功能(molecular function, MF) 上调的基因主要富集在蛋白质结合和染色质结合,下调的基因主要富集在肝素结合和酮类固醇单加氧酶活性等。
2.2.2细胞组分(cellular component, CC) 上调的基因主要涉及纺锤体微管、微管细胞骨架和核染色质等,下调的基因主要涉及细胞外间隙和细胞外基质等。
2.2.3生物过程(biological process, BP) 上调的基因主要富集在细胞有丝分裂G2/M期过渡、DNA复制、细胞增殖的正调控和有丝分裂姐妹染色单体分离涉及的转录调控等,下调的基因主要富集在血管生成、磷脂酰肌醇3-激酶信号的正调控和肽基酪氨酸磷酸化的正调控中(图2A~B)。
2.2.4KEGG pathway结果 上调的DEGs富集在2条通路中(P>0.05,图2C),下调的DEGs主要富集在PPAR signaling pathway(hsa03320)、AMPK signaling pathway(hsa04152)和Adipocytokine signaling pathway(hsa04920)等通路中(图2D)。
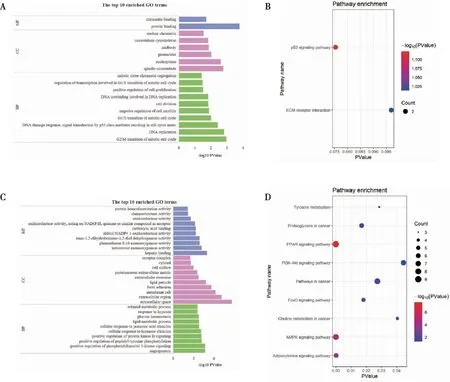
注:A~B分别为上、下调DEGs显著富集的GO条目,C~D分别为上、下调DEGs显著富集的KEGG条目,DEGs为差异表达基因,GO为基因本体论,KEGG为京都基因和基因组百科全书。图2 BC中上调和下调差异表达基因的GO与KEGG富集结果Fig.2 GO annotation and KEGG enrichment results of up-regulated and down-regulated DEGS in BC
2.3 PPI网络的构建与Hub基因的识别
构建115个重叠DEGs的PPI网络,共包含115个节点和368条边(图3A),此外,识别了MCODE得分>10的子模块(图3B),该模块包含20个点,94条边。同时,用模块中Degree>10的11个Hub基因绘制PPI网络图(表1,图3C),并将以上基因作为Hub基因进行进一步的生存分析。
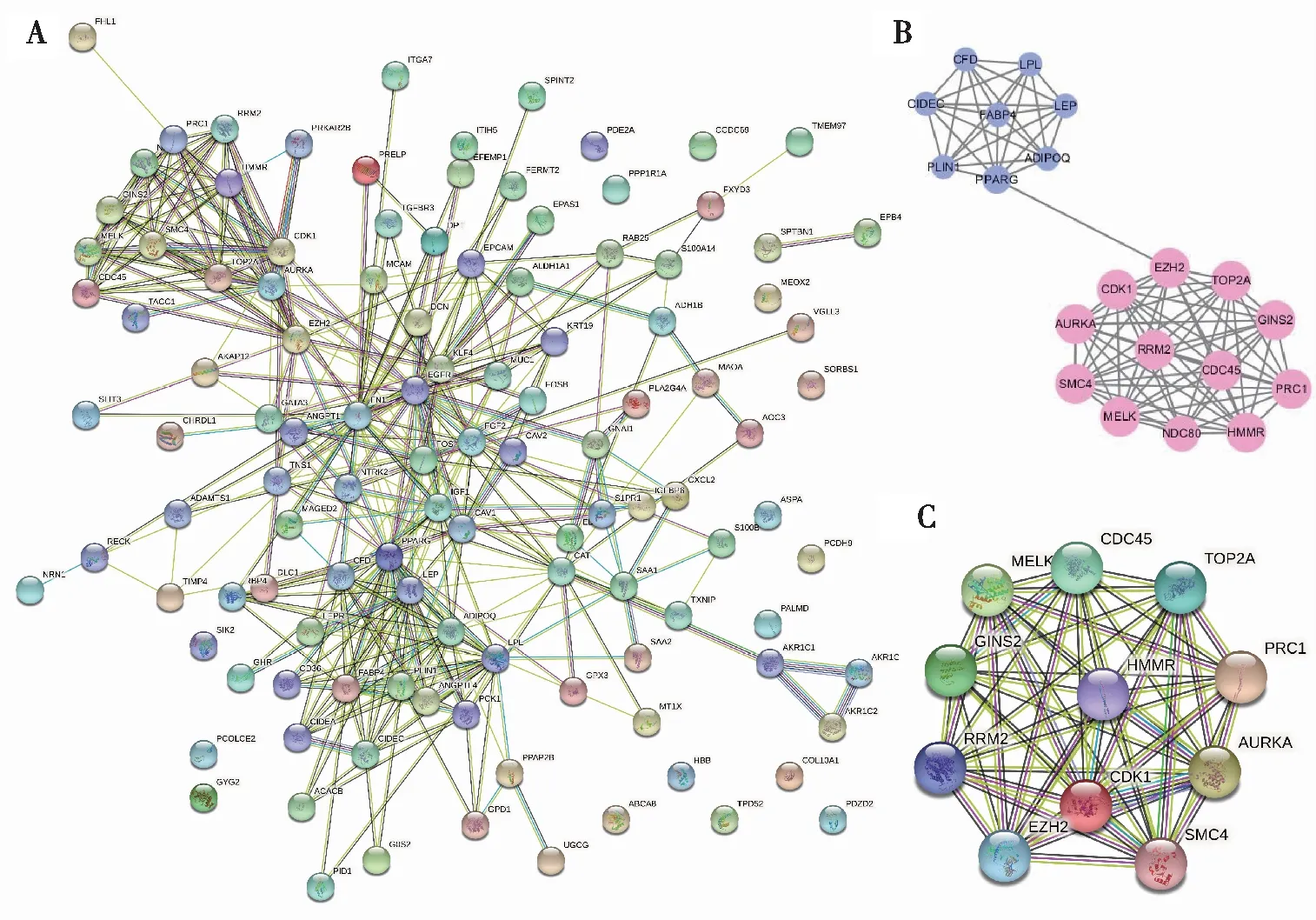
注:A为3个数据集的DEGs构成的PPI网络,B为MCODE得分>10的子模块,红色节点表示上调的DEGs,蓝色节点表示下调的DEGs,C为子模块中Degree>10的Hub基因,DEGs为差异表达基因,PPI为蛋白互作。图3 蛋白质-蛋白质相互作用网络的构建和Hub基因的鉴定Fig.3 Construction of protein-protein interaction network and identification of Hub genes
2.4 Hub基因mRNA和蛋白的表达及生存分析
与癌旁组织或正常乳腺组织比较,BC组织中上述11个HubmRNA的表达上调,且其编码的蛋白表达也上调,这与GEPIA数据库分析所得结果趋势一致(P<0.05,图4A~C)。如图4D所示,Kaplan-Meier-Plotter分析表明11个Hub基因均与BC患者的总体生存期(overall survival, OS)相关(P<0.05)。

注:A为qRT-PCR检测EZH2在BC及相应的癌旁组织中的表达,B为EZH2的Western blot表征结果,C为GEPIA数据库中EZH2的表达,红色代表BC组织,灰色代表正常乳腺组织,D为EZH2的生存曲线;(1)与癌旁组比较,P<0.05。图4 BC患者中11个Hub基因及其编码蛋白的验证结果及生存曲线(以EZH2为例)Fig.4 Verification results and survival curves of 11 Hub genes and their encoded proteins in BC patients (take EZH2 as an example)
2.5 Hub基因编码的蛋白免疫组织化学分析
免疫组织化学染色结果显示,11个Hub基因编码的蛋白在正常乳腺组织中呈现弱染色,而在BC组织中呈现强染色,这与HPA数据库观察到的11个Hub基因编码的蛋白表达情况一致(图5A~B)。
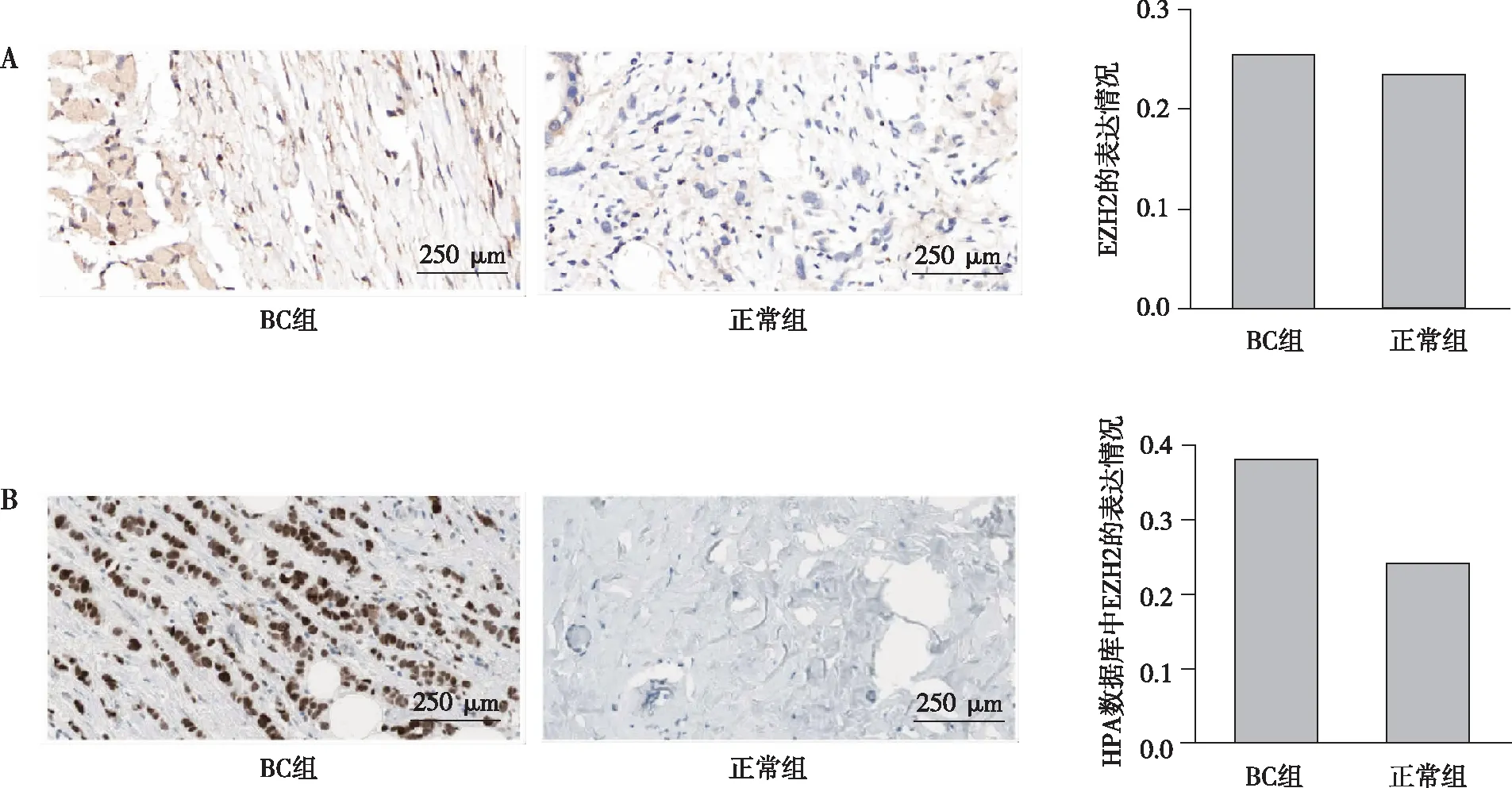
注:A为EZH2免疫组化结果,B为HPA数据库所得EZH2的免疫组化结果;(1)与BC组比较,P<0.05。 图5 HPA数据库及免疫组化分析11个Hub基因的表达(以EZH2为例)Fig.5 HPA Database and Immunohistochemical analysis of the expression of 11 Hub genes and their encoded proteins(take EZH2 as an example)
2.6 候选化合物的鉴定
基于Cmap数据库的预测,本研究以P<0.05和连接性分数为-8~-1为截断标准,共获得6个化合物,分别为DL-thiorphan、repaglinide、phenoxybenzamine、cortisone、rottlerin和gliclazide (表3),这些化合物的负值较高,提示这些化合物具有逆转BC相关的DEGs的能力。此外,图6中展示了这些排名靠前的化合物的3D分子结构示意图。
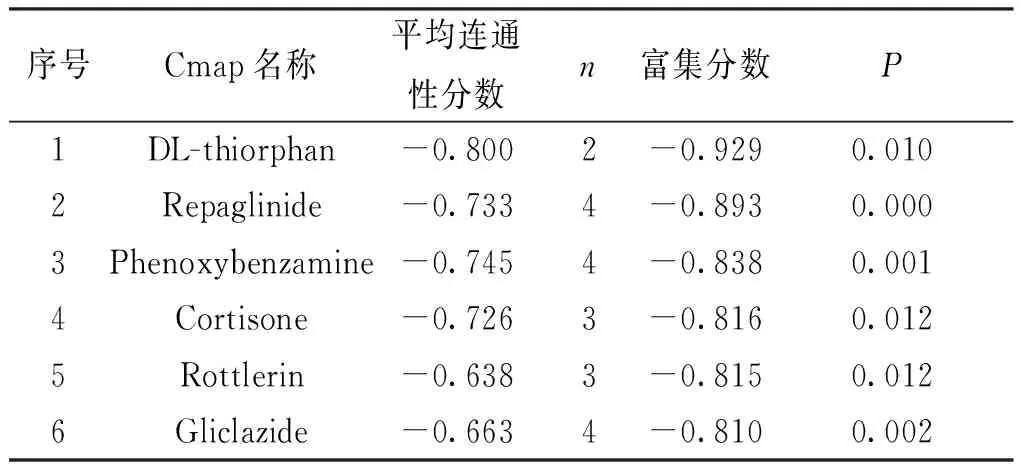
表3 Cmap数据库识别的潜在的具有抗BC功能的化合物Tab.3 Potential compounds with anti-BC function identified by Cmap database

注:A为DL-thiorphan,B为Repaglinide,C为Phenoxybenzamine,D为Cortisone,E为Rottlerin,F为Gliclazide。图6 Cmap数据库分析获得的6个候选化合物的3D化学构象Fig.6 3D chemical conformation of 6 candidate compounds obtained by Cmap database analysis
3 讨论
BC是女性最为常见的恶性肿瘤之一,且发病率逐年增长,成为威胁女性健康的“头号杀手”,BC的诊断、治疗及预后已成为当代学者研究的热点。为了解BC患者DEGs的潜在生物学功能及它们与患者预后的关系,本研究利用综合的生物信息学分析筛选出115个重叠的DEGs,其中26个上调、89个下调。为挖掘DEGs的关联性及其中的Hub基因,本研究进行了PPI分析和模块分析,共获得11个Hub基因(SMC4、GINS2、CDC45、EZH2、RRM2、MELK、PRC1、CDK1、HMMR、TOP2A和AURKA)。利用GEPIA数据库分析这些Hub基因的表达差异,通过qRT-PCR进行验证,发现它们在BC中的表达均上调,这一结果与GEO数据库中的趋势一致,本研究通过HPA数据库、Western blot和免疫组织化学染色进一步观察并验证上述基因编码的蛋白质在BC中的表达,也呈现相同的表达趋势。为进一步研究其生物学功能和作用途径,本研究通过DAVID数据库对这些重叠的DEGs进行GO与KEGG富集分析,结果表明它们富集的GO条目主要有蛋白质结合(protein binding)、肝素结合(heparin binding)、细胞增殖的正调控和血管生成等方面;KEGG pathway分析结果主要包含p53信号通路、PPAR信号通路(hsa03320)和AMPK信号通路(hsa04152),研究表明这些通路与BC的发生发展有关[7-9]。以上结果说明DEGs可能通过这些信号通路来发挥作用。
本研究发现11个Hub基因与肿瘤密切相关,其中EZH2可以调控蛋白质的磷酸化过程。EZH2是PRC2的核心成分,在早期发育中具有重要作用,其失调与各种肿瘤的发生密切相关,可通过组蛋白修饰和沉默表观遗传基因而促进上皮恶性肿瘤[10]。Moore等[11]发现EZH2通过磷酸化p38蛋白,促进BC转移。Zheng等[12]发现EZH2在口腔鳞状细胞癌中表达上调,过表达的EZH2通过在pY705位点磷酸化STAT3,减少了FoxO1的表达,促进口腔鳞癌细胞上皮-间充质转化、迁移和侵袭。李朝夕等[13]的结果显示EZH2与BC密切相关,相对于癌旁组织,EZH2蛋白在BC组织中的表达上调,其可能是BC细胞增殖、浸润和转移的关键分子。GO分析表明MELK、CDK1、HMMR和AURKA这4个基因均与细胞周期调控相关,其中,MELK是一种新的癌基因,属于丝氨酸/苏氨酸激酶Snfl/AMPK家族中的成员。大量研究表明,MELK是细胞周期调控因子,对有丝分裂过程至关重要[14]。Tang等[15]通过Transwell实验和Western blot发现MELK可能通过上调Twsit1、Slug、MMP7和N-cadherin促进肺腺癌的迁移和侵袭,此外,他们还发现抑制MELK的表达可诱导肺癌细胞的凋亡。CDK1的激活可以磷酸化靶蛋白并产生相应的生理效应,如调节细胞周期和促进细胞增殖。李振淼等[16]发现miR-383通过下调CDK1等细胞周期相关蛋白的表达抑制小鼠卵泡颗粒细胞的增殖。HMMR是一种致癌基因,在多种肿瘤中高表达,不仅在肿瘤的发生发展中发挥重要作用,还可以促进肺腺癌的转移[17]。AURKA属于丝氨酸/苏氨酸激酶家族,它作为一种致癌基因,在多种癌症中高表达,如肾上腺皮质癌、肝细胞癌和前列腺癌等。研究报道称AURKA的上调可促进细胞增殖,与膀胱癌的不良预后相关[18]。
本研究还发现GINS2、RRM2和CDC45这3个基因均与DNA的复制或修复相关。GINS2是GINS复合物的成员,在DNA复制过程中发挥重要作用[19]。研究报道称GINS2在多种侵袭性肿瘤中表达上调,Yu等[20]通过综合的生物信息学分析表明GINS2可作为BC患者预后的生物标志物,这与本研究的结果一致。RRM2是一种参与DNA修复和合成的限速酶,在Mazzu等[21]的研究中,他们在前列腺癌细胞中敲低RRM2,发现其致癌能力受到抑制,而过表达RRM2则促进前列腺癌细胞的上皮-间充质转化,此外,他们还在临床队列中证实了RRM2的高表达与前列腺癌患者的不良预后相关。CDC45作为DNA复制的起始因子,研究表明在非小细胞肺癌(non-small-cell lung cancer,NSCLC)中,CDC45的下调诱导G2/M期细胞周期阻滞并在体外和体内抑制细胞增殖,它可能是NSCLC中的致癌基因[22]。此外,SMC4、PRC1和TOP2A均被报道在细胞分裂过程中发挥重要作用。SMC4是SMC家族中的一员,在细胞分裂中起着至关重要的作用[23],研究表明,SMC4在舌鳞癌细胞、结直肠癌、肝癌和BC等多种癌症中表达上调。郑世杨等[24]的研究表明敲低SMC4基因的表达可抑制MDA-MB-231细胞的增殖、迁移及侵袭能力,其机制可能与PI3K/AKT信号通路的激活相关。PRC1蛋白是一种微管相关蛋白,与细胞的有丝分裂相关,它被报道在包括宫颈癌和BC在内的多种癌症中表达上调,且韩兆东等[25]发现PRC1的高表达与前列腺癌的恶性程度及患者的预后相关,但其具体机制有待进一步探索。TOP2A在DNA合成,转录以及有丝分裂过程中染色体分离时起重要作用[26]。TOP2A基因位于17q12-21,其表达与细胞增殖[27]和细胞周期[28]有关。
由于新药开发是一个耗时、高风险的过程,在这种情况下,通过基因表达谱技术寻找抗BC的药物靶点,利用药物重新定位技术探索现有药物的新疗效,可成为提高药物开发投入产出比、降低失败风险的有效措施[29]。本研究共鉴定了6个候选的化合物,其中Rottlerin是一种从天然植物中提取的多酚类化合物,具有抗肿瘤活性,常用作PKCδ的特异性抑制剂。研究表明抑制基质金属蛋白酶(matrix metalloproteinase, MMP)的表达可以抑制癌症的转移[30]。Lin等[31]发现使用Rottlerin阻断PKCδ的表达可减弱MMP-9的表达并使细胞迁移能力减低,从而达到治疗BC的目的。临床上对于三阴性BC患者常选择顺铂作为化疗药物,Pabla在顺铂诱导的肾损伤的研究中发现Rottlerin可以改善这一现象[32],该药是否可用于减弱顺铂对BC患者所致的肾损伤还有待进一步研究。基于这些观察结果,本研究认为Rottlerin有望成为治疗BC的候选化合物。其他5个化合物在BC中的作用目前尚未报道,其药理作用有待进一步验证。
综上所述,本研究利用生物信息学和实验验证鉴定出的11个Hub基因可作为BC患者预后的生物靶标,其中GINS2、RRM2和CDK1在DNA复制中发挥重要作用,MELK、CDC45、HMMR和AURKA均参与细胞周期的调控,SMC4、PRC1和TOP2A在细胞分裂中发挥重要作用,Rottlerin有望成为治疗BC的候选化合物,但其作用的具体机制仍需要进一步的实验验证。
