联用不同主要有效成分的注射用红花黄色素对冠心病患者血脂指标的影响:基于11项随机对照试验的Meta分析
2021-09-06李洪峥滕羽鸥杨光赵鑫傅梦薇陈恒文
李洪峥,滕羽鸥,杨光,赵鑫,傅梦薇,陈恒文
冠心病是我国常见的心血管疾病类型之一[1],其年患病人数高达2 290.4万,年死亡人数达172.3万,且其发病率呈上升趋势[2]。总胆固醇(total cholesterol,TC)和低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)与心血管疾病发生风险呈正相关,故既往共识与指南提出将降低LDL-C水平作为调脂治疗的首要干预靶标[3-5]。此外,TC及高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)还是我国心血管疾病风险评估模型中的重要因素[6]。目前,临床上治疗冠心病仍以降脂药物为主。冠心病属中医学中“胸痹病血瘀证”或“痰瘀互结证”范畴[7],既往研究表明,痰瘀互结证与HDL-C降低有关[8],故通过中医辨证治疗可能提高冠心病患者治疗效果、减少不良反应的发生[9]。注射用红花黄色素是由中药红花提取出的有效成分红花总黄酮等组成的中药注射液,具有活血、化瘀、通络等功效。现代药理学研究表明,红花黄色素具有扩张冠状动脉、抗凝、降血压、降血脂等作用[10-11]。既往研究表明,红花黄色素可提高冠心病不稳定型心绞痛患者的治疗效果[12],且未观察到明显的药物相关不良反应[13]。目前,联用注射用红花黄色素治疗冠心病患者的临床疗效尚无系统评价,且未进一步分析不同主要有效成分的注射用红花黄色素治疗效果的差异。基于此,本研究采用Meta分析方法评价联用不同主要有效成分的注射用红花黄色素对冠心病患者血脂指标的影响,旨在为注射用红花黄色素的临床应用提供循证依据。
1 资料与方法
1.1 文献纳入与排除标准
1.1.1 文献纳入标准 (1)研究类型:随机对照试验(randomized controlled trial,RCT),语种仅限中、英文。(2)研究对象:冠心病患者,年龄、性别、病程、疗程不限。(3)干预措施:对照组患者给予常规治疗,试验组患者在对照组基础上联用注射用红花黄色素。(4)结局指标:主要结局指标:LDL-C、TC、HDL-C;次要结局指标:三酰甘油(triglyceride,TG);安全性指标:胃肠道反应、转氨酶升高、低血压等不良反应发生率。
1.1.2 文献排除标准 (1)诊断标准或纳入、排除标准不明确;(2)除心血管疾病外,患者还合并严重血液系统疾病、恶性肿瘤等;(3)同时使用其他中药制剂治疗;(4)重复发表文献;(5)不包含主要结局指标的文献;(6)非临床研究;(7)数据不全或缺失,且联系作者无法获取。
1.2 文献检索策略 计算机检索中国知网、万方数据知识服务平台、维普网、中国生物医学文献数据库(Chinese Biomedical Database,CBM)、Cochrane Library、PubMed、Embase数据库,检索公开发表的注射用红花黄色素治疗冠心病的RCT,检索时限为2005-02-21(注射用红花黄色素上市)[14]至2020-04-30。采用主题词结合自由词方式进行检索,其中中文检索词:红花黄色素、冠心病、冠状动脉粥样硬化性心脏病、心绞痛、胸痹、胸痛、心痹、心痛。英文检索词:honghuahuang,safflower yellow,coronary atherosclerosis disease,xiongbi,xintong。
1.3 文献筛选、资料提取及纳入研究的偏倚风险评价 由两位评价员独立进行文献筛选和资料提取,并交叉核对,若遇分歧则由第3位评价员裁决。采用自制的资料提取表提取相关资料,包括:(1)纳入研究的基本信息:第一作者、发表时间;(2)研究对象的基本特征:各组样本量、年龄、病程;(3)干预措施:具体用药方案、剂量及疗程;(4)结局指标的测量数据;(5)评价研究偏倚风险的关键要素。采用Cochrane手册中的偏倚风险评价工具[15]评价RCT偏倚风险。
1.4 统计学方法 采用RevMan 5.3软件进行Meta分析。计量资料以均数差(mean deviation,MD)为效应指标,计数资料以优势比(odds ratio,OR)或相对危险度(relative risk,RR)为效应指标,并计算其95%CI。采用χ2检验结合I2检验评估各研究间的统计学异质性,以P<0.10和I2>50%为各研究间有统计学异质性,进一步分析异质性来源,排除明显临床异质性影响后采用随机效应模型进行Meta分析;以P≥0.10或I2≤50%为各研究间无统计学异质性,采用固定效应模型进行Meta分析。根据注射用红花黄色素主要有效成分不同分为以红花总黄酮为主要有效成分的注射用红花黄色素(红花总黄酮亚组)和以羟基红花黄色素A为主要有效成分的注射用红花黄色素(羟基红花黄色素A亚组),并进行亚组分析及敏感性分析。双侧检验水准α=0.05。
2 结果
2.1 文献检索流程及结果 初检获得相关文献738篇,逐层筛选后最终纳入11项RCT[16-26],均为中文文献,共计1 096例患者,其中试验组554例,对照组542例。对照组患者常规治疗药物包括阿司匹林肠溶片、他汀类或贝特类降脂药、硝酸酯类药物;试验组患者在对照组治疗基础上联用注射用红花黄色素。文献筛选流程及结果见图1,纳入研究的基本特征见表1。
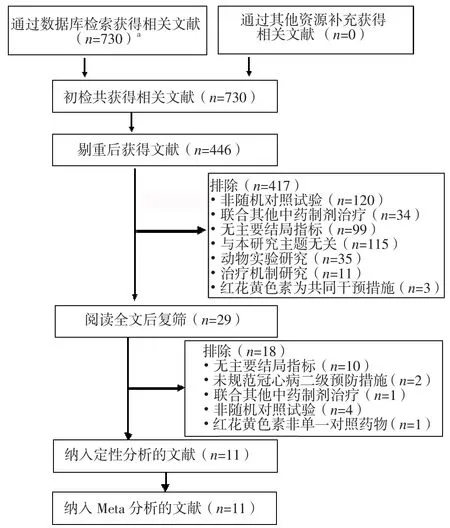
图1 文献筛选流程及结果Figure 1 Process and results of literature screening
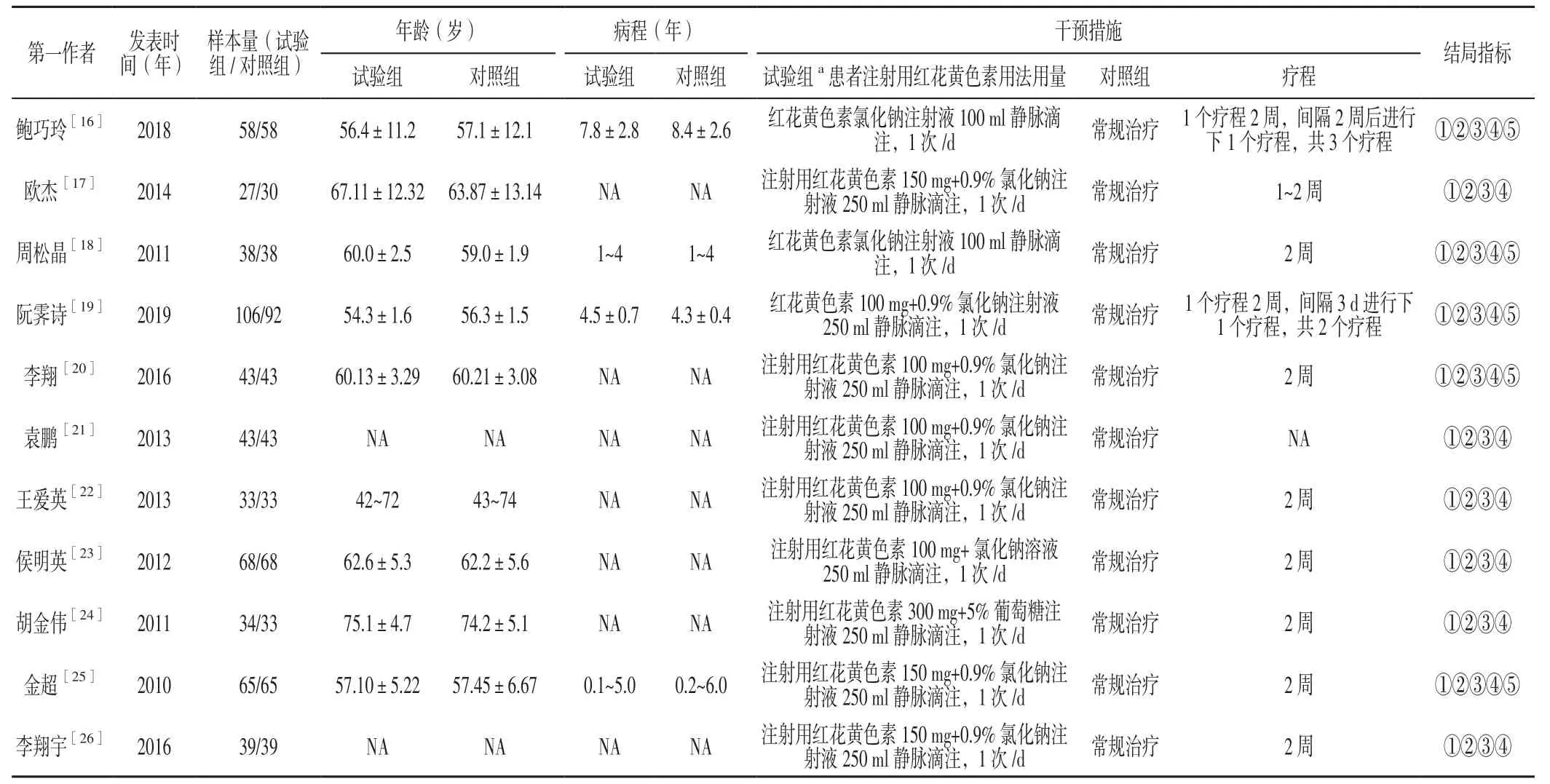
表1 纳入研究的基本特征Table 1 Basic characteristics of included studies
2.2 纳入研究的偏倚风险评价结果 11项研究[16-26]基线资料均具有可比性。4项研究[16-17,20,23]明确了具体的随机分组方法,其中3项研究[16-17,20]采用随机数字表法、1项研究[25]采用简单随机(抽签法),故选择性偏倚评价为低风险;其他7项研究[18-19,21-22,24-26]仅提及随机,故选择性偏倚评价为不清楚。1项研究[19]使用信封法进行分配隐藏,评价为低风险;其余10项研究[16-18,20-26]均未提及分配隐藏方法,故因未隐藏分组导致的选择性偏倚评价为不清楚。11项研究[16-26]均未提及是否使用盲法,故实施偏倚及测量偏倚均评价为不清楚。1项研究[17]除明确纳入、排除标准外,还明确指出脱落与剔除标准,且严格按照标准执行,研究数据完整;其他10项研究[16,18-26]的结果数据的完整性评价为不清楚。11项研究[16-26]均无选择性报告。1项研究[22]LDL-C标准差过大,通过邮件与作者联系后明确数据录入错误,其余数据准确,故其他偏倚评价为有;1项研究[26]的图表行列表头错误,通过邮件与作者联系后明确数据,故其他偏倚评价为有;其他9项研究[16-21,23-25]无法判断是否存在其他偏倚,故评价为无。纳入研究的偏倚风险评估结果见表2,偏倚风险条形图见图2。
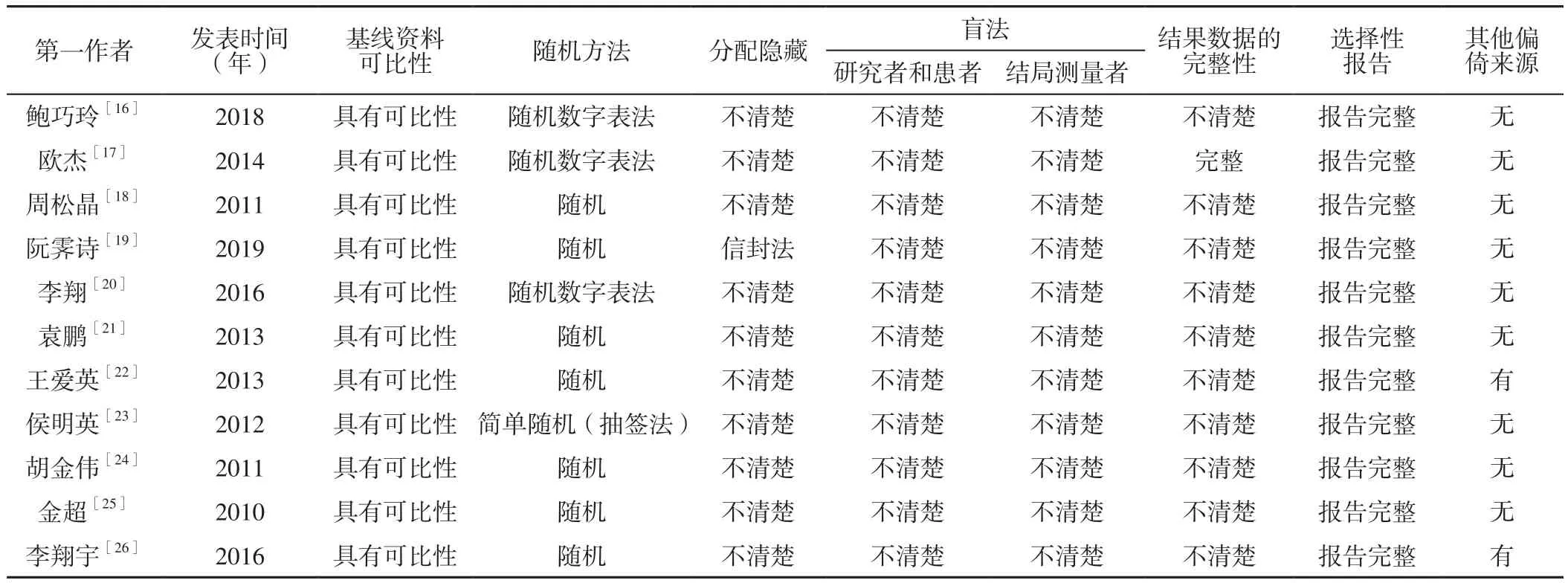
表2 纳入研究的偏倚风险评估结果Table 2 Bias risk assessment results of included studies
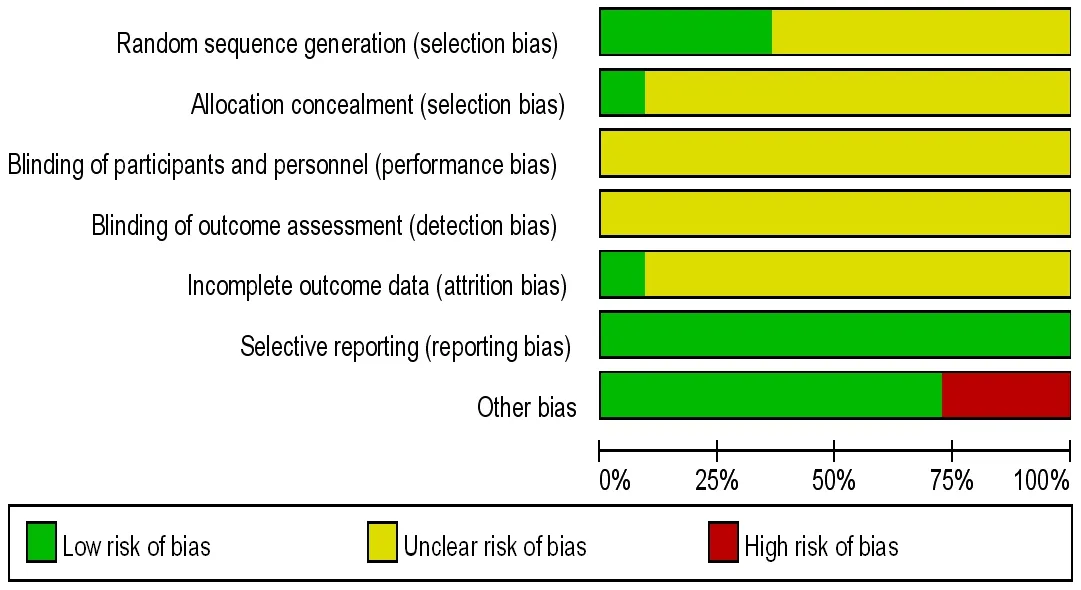
图2 纳入研究的偏倚风险条形图Figure 2 Bar graph of bias risk for included studies
2.3 Meta分析结果
2.3.1 LDL-C 11项研究[16-26]报道了 LDL-C,其中 1项研究[22]因联系作者确认标准差录入错误而去除,最终纳入10项研究[16-21,23-26]。各研究间有统计学异质性(I2=80%,P<0.000 01),采用随机效应模型进行Meta分析,结果显示,试验组患者LDL-C降低幅度大于对照组,差异有统计学意义〔MD=-0.60,95%CI(-0.72,-0.49),P<0.000 01〕,见图3。亚组分析结果显示,3项研究[16-18]联用以红花总黄酮为主要有效成分的注射用红花黄色素治疗,各研究间有统计学异质性(I2=71%,P=0.03),去除文献[17]后各研究间无统计学异质性(I2=53%,P=0.14),结果显示,红花总黄酮亚组患者LDL-C降低幅度大于对照组,差异 有 统 计 学 意 义〔MD=-0.69,95%CI(-0.83,-0.56),P<0.000 01〕;7项研究[19-21,23-26]联用以羟基红花黄色素A为主要有效成分的注射用红花黄色素治疗,各研究间有统计学异质性(I2=84%,P<0.000 01),去除两项未明确患者年龄的研究[21,26]后各研究间无统计学异质性(I2=0%,P=0.42),结果显示,羟基红花黄色素A亚组患者LDL-C降低幅度大于对照组,差异有统计学意义〔MD=-0.60,95%CI(-0.66,-0.54),P<0.000 01〕;红花总黄酮亚组和羟基红花黄色素A亚组间无统计学异质性(I2=29.9%,P=0.23),见图4。
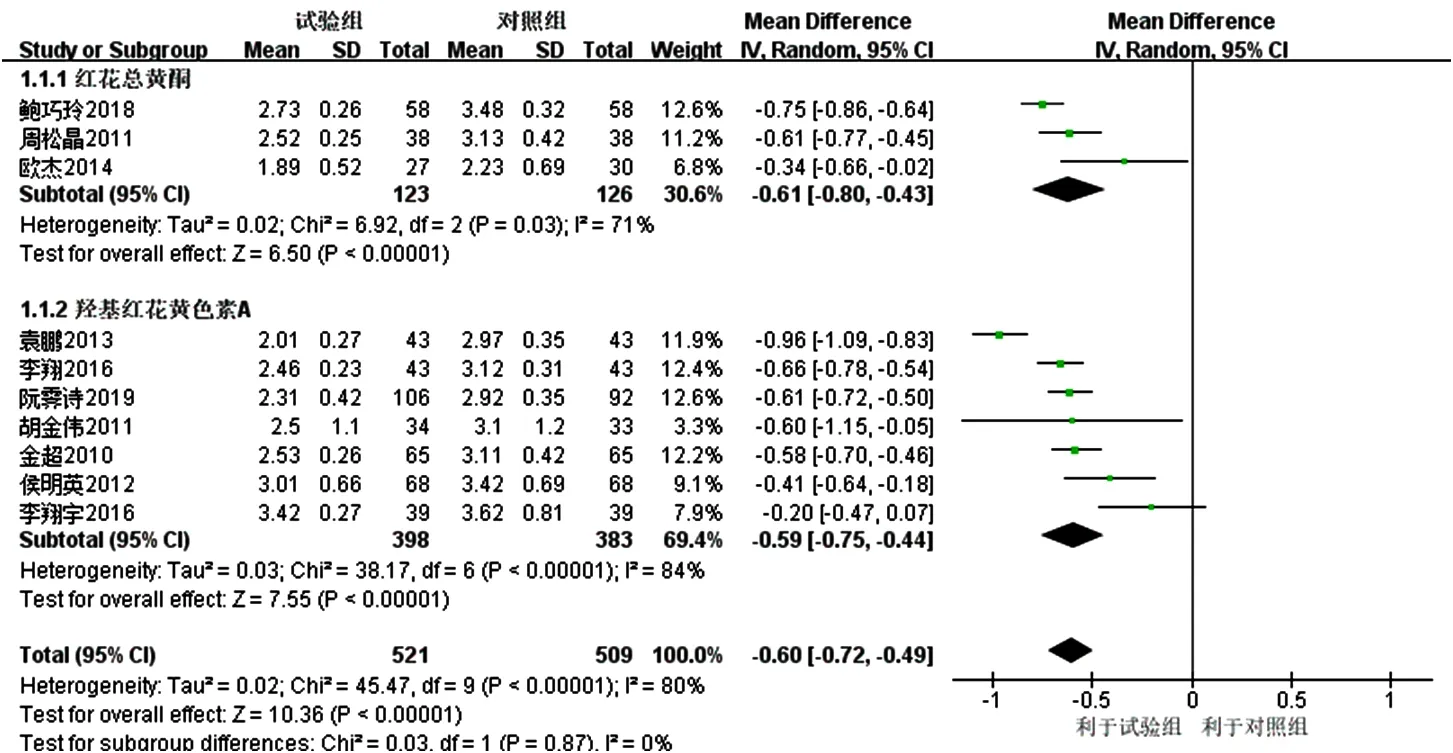
图3 对照组和试验组患者LDL-C降低幅度比较的森林图Figure 3 Forest map for comparison of LDL-C decrease between the control group and the experimental group
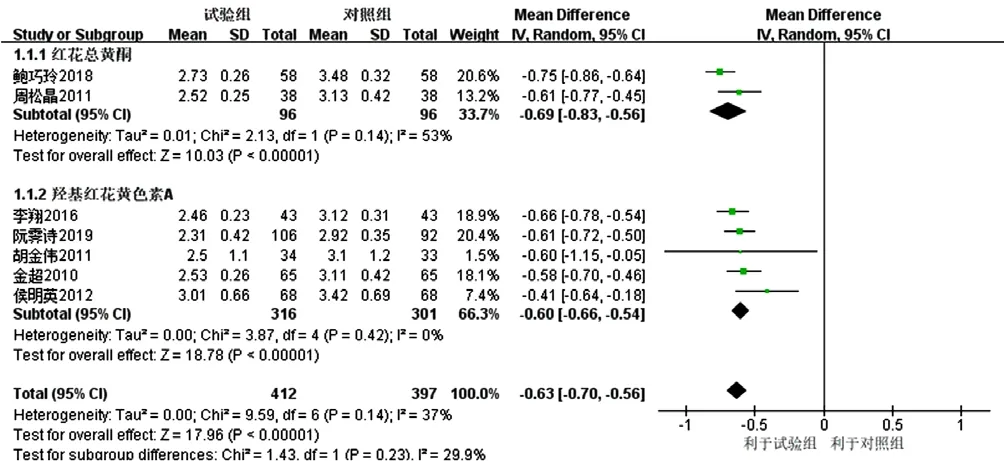
图4 经敏感性分析的对照组和试验组患者LDL-C降低幅度比较的森林图Figure 4 Forest map for comparison of LDL-C decrease between the control group and the experimental group with sensitive analysis
2.3.2 TC 11项研究[16-26]报道了TC,各研究间有统计学异质性(I2=90%,P<0.000 01),采用随机效应模型进行Meta分析,结果显示,试验组患者TC降低幅度大于对照组,差异有统计学意义〔MD=-0.79,95%CI(-0.98,-0.59),P<0.000 01〕。亚组分析结果显示,3项研究[16-18]联用以红花总黄酮为主要有效成分的注射用红花黄色素治疗,各研究间有统计学异质性(I2=91%,P<0.000 01),且去除任意一项研究均未明显降低统计学异质性,结果显示,红花总黄酮亚组患者TC降低幅度大于对照组,差异有统计学意义〔MD=-0.66,95%CI(-1.06,-0.26),P=0.001〕;8 项研究[19-26]联用以羟基红花黄色素A为主要有效成分的注射用红花黄色素治疗,各研究间有统计学异质性(I2=86%,P<0.000 01),但去除任意一项研究均不能明显降低统计学异质性,结果显示,羟基红花黄色素A亚组患者TC降低幅度大于对照组,差异有统计学意义〔MD=-0.84,95%CI(-1.06,-0.62),P<0.000 01〕;红花总黄酮亚组和羟基红花黄色素A亚组间无统计学异质性(I2=0,P=0.45),见图5。
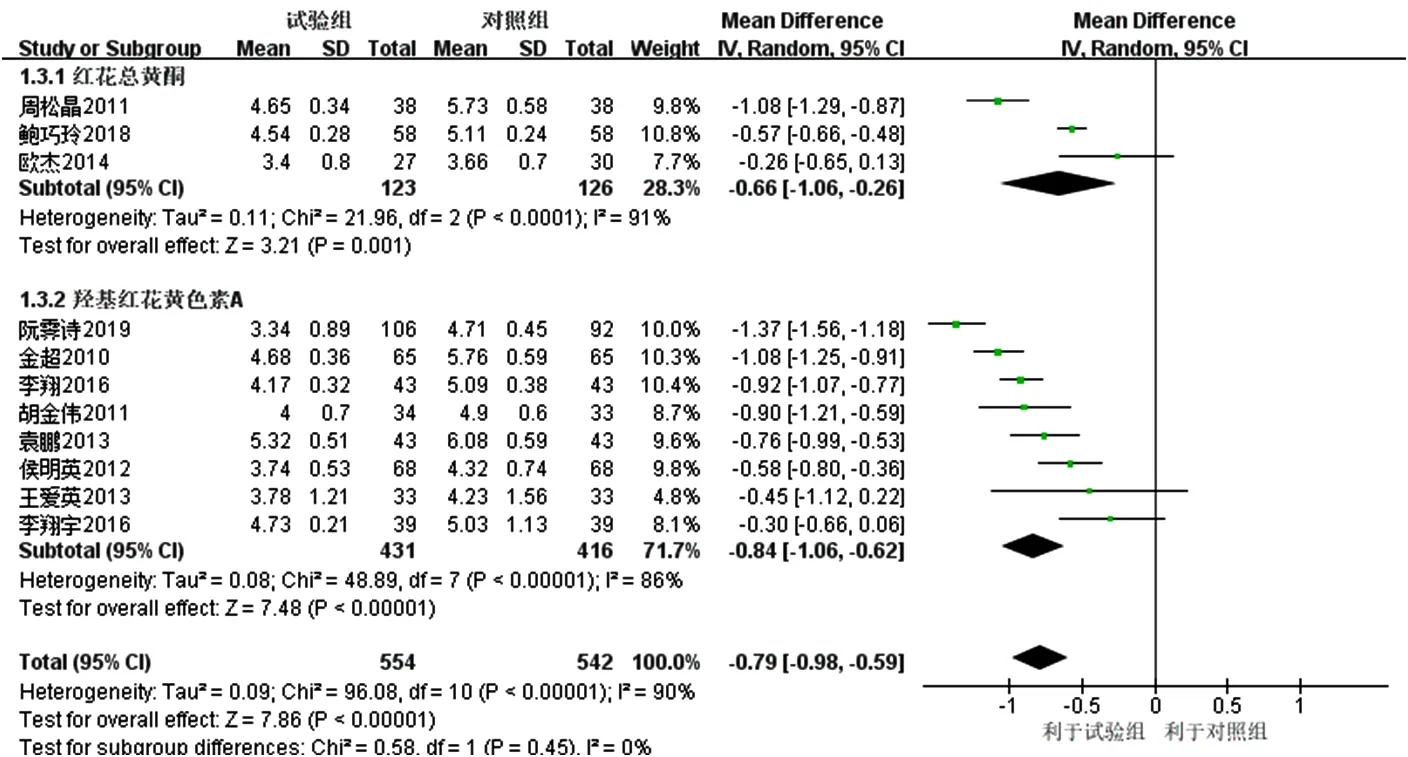
图5 对照组和试验组患者TC降低幅度比较的森林图Figure 5 Forest map for comparison of TC decrease between the control group and the experimental group
2.3.3 HDL-C 11项研究[16-26]报道了HDL-C,各研究间有统计学异质性(I2=92%,P<0.000 01),采用随机效应模型进行Meta分析,结果显示,试验组患者HDL-C升高幅度大于对照组,差异有统计学意义〔MD=0.28,95%CI(0.17,0.40),P<0.000 01〕,见图6。亚组分析结果显示,3项研究[16-18]联用以红花总黄酮为主要有效成分的注射用红花黄色素治疗,各研究间有统计学异质性(I2=77%,P=0.01),去除1项研究[18]后各研究间无统计学异质性(I2=0,P=0.60),结果显示,红花总黄酮亚组HDL-C升高幅度大于对照组,差异有统计学意义〔MD=0.14,95%CI(0.06,0.21),P=0.000 2〕。8项研究[19-26]联用以羟基红花黄色素A为主要有效成分的注射用红花黄色素治疗,各研究间有统计学异质性(I2=94%,P<0.000 1),但去除任意1项研究均未明显降低统计学异质性,结果显示,羟基红花黄色素A亚组患者HDL-C升高幅度高于对照组,差异有统计学意义〔MD=0.32,95%CI(0.16,0.48),P<0.000 01〕;红花总黄酮亚组和羟基红花黄色素A亚组间有统计学异质性(I2=77.6%,P=0.03),见图7。
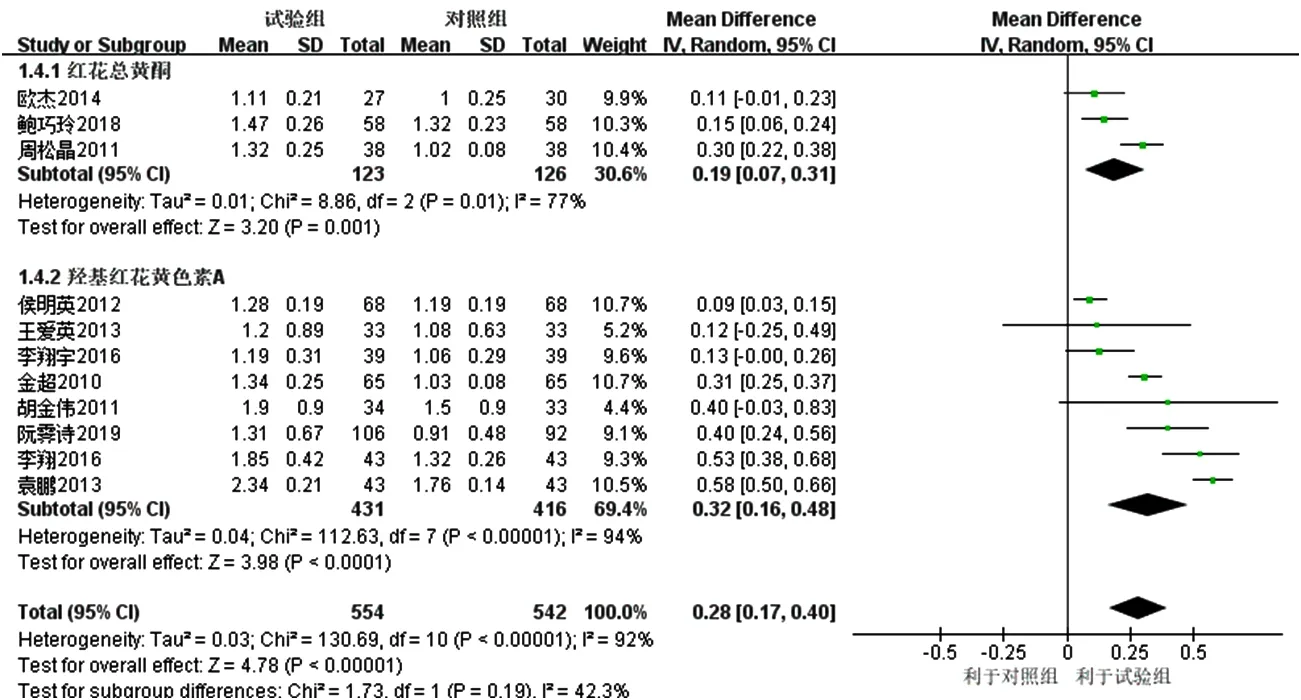
图6 对照组和试验组患者HDL-C升高幅度比较的森林图Figure 6 Forest map for comparison of HDL-C between the control group and the experimental group
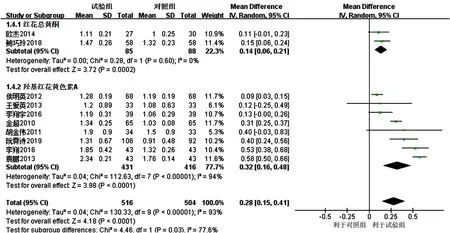
图7 经敏感性分析的对照组和试验组患者HDL-C升高幅度比较的森林图Figure 7 Forest map for comparison of HDL-C between the control group and the experimental group with sensitive analysis
2.3.4 TG 11项研究[16-26]均报道了TG,各研究间有统计学异质性(I2=89%,P<0.000 01),采用随机效应模型进行Meta分析,结果显示,试验组患者TG降低幅度大于对照组,差异有统计学意义〔MD=-0.57,95%CI(-0.73,-0.41),P<0.000 01〕,见图8。亚组分析结果显示,3项研究[16-18]联用以红花总黄酮为主要有效成分的注射用红花黄色素治疗,各研究间有统计学异质性(I2=83%,P=0.003),去除1项研究[16]后各研究间无统计学异质性(I2=0,P=0.34),结果显示,红花总黄酮亚组TG降低幅度大于对照组,差异有统计学意义〔MD=-0.58,95%CI(-0.75,-0.42),P<0.000 01〕。8项研究[19-26]联用以羟基红花黄色素A为主要有效成分的注射用红花黄色素治疗,各研究间有统计学异质性(I2=79%,P<0.000 1),但去除任意一项研究均未明显降低统计学异质性,结果显示,羟基红花黄色素A亚组患者TG降低幅度大于对照组,差异有统计学意义〔MD=-0.63,95%CI(-0.78,-0.48),P<0.000 1〕;红花总黄酮亚组和羟基红花黄色素A亚组间无统计学异质性(I2=0,P=0.70),见图9。
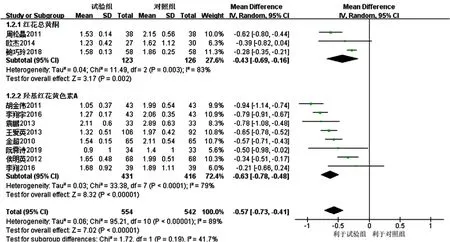
图8 对照组和试验组患者TG降低幅度比较的森林图Figure 8 Forest map for comparison of TG decrease between the control group and the experimental group
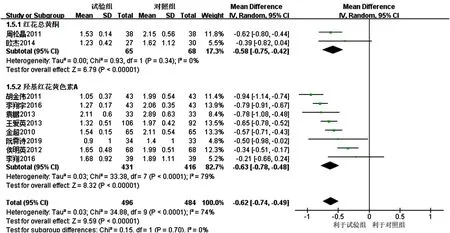
图9 经敏感性分析的对照组和试验组患者TG降低幅度比较的森林图Figure 9 Forest map for comparison of TG decrease between the control group and the experimental group with sensitive analysis
2.3.5 不良反应发生率 5项研究[16,18-20,25]报道了不良反应发生率,常见不良反应包括胃肠道反应〔RR=1.28,95%CI(0.29,5.55),P=0.74〕、转氨酶升高〔RR=1.33,95%CI(0.31,5.70),P=0.70〕、低血压〔RR=2.61,95%CI(0.11,63.24),P=0.56〕,见表3。各研究间无统计学异质性(I2=0,P=0.87),采用固定效应模型进行Meta分析,结果显示,试验组和对照组患者不良反应发生率比较,差异无统计学意义〔RR=1.46,95%CI(0.54,3.93),P=0.45〕,见图 10。
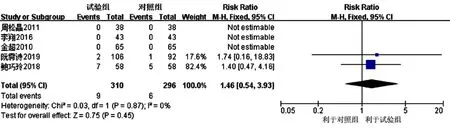
图10 对照组和试验组患者不良反应发生率比较的森林图Figure 10 Forest map for comparison of incidence rate of adverse reactions between the control group and the experimental group
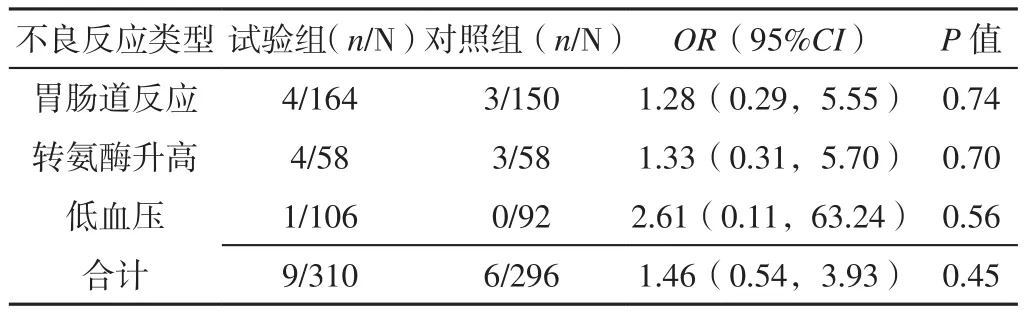
表3 试验组和对照组患者不良反应发生情况Table 3 Adverse reactions in the experimental group and the control group
3 讨论
研究表明,血脂异常是心血管疾病风险增加的主要原因之一[27]。目前,临床上对于冠心病患者在明确个体风险程度后,常采用饮食、运动或调脂药物进行干预,但调脂药物可能引发Q-T间期延长、转氨酶升高等不良反应。既往临床证据表明,联用注射用红花黄色素能有效改善稳定型心绞痛患者的临床症状并提高其心电图疗效[28],此外还可提高不稳定型心绞痛患者硝酸甘油减停量、有效率、心电图疗效、肌钙蛋白T降低程度等[29]。但目前尚无研究分析不同主要有效成分的注射用红花黄色素治疗效果的差异,而这对于注射用红花黄色素的临床适用范围具有一定影响。
3.1 本次Meta分析结果 本次Meta分析最终纳入11项RCT,结果显示,试验组患者LDL-C降低幅度、TC降低幅度、TG降低幅度、HDL-C升高幅度大于对照组,提示常规治疗联合注射用红花黄色素能有效改善冠心病患者血脂指标,平均降低LDL-C水平0.63 mmol/L、TC水平0.79 mmol/L、TG水平0.62 mmol/L,平均升高HDL-C水平0.28 mmol/L;亚组分析结果显示,以羟基红花黄色素A为主要成分的注射用红花黄色素和以红花总黄酮为主要成分的注射用红花黄色素在降低LDL-C、TC、TG水平方面无明显差异,但以羟基红花黄色素A为主要成分的注射用红花黄色素在升高HDL-C水平方面临床获益更大。本次Meta分析结果还显示,试验组和对照组患者不良反应发生率比较差异无统计学意义,提示联用注射用红花黄色素不会增加胃肠道反应、转氨酶升高、低血压等不良反应发生风险。
3.2 本次Meta分析的局限性 (1)本次Meta分析纳入的文献质量不高,异质性较大。11项研究总样本量为1 096例,其中最大样本量198例、最小样本量57例;纳入的研究均未描述是否采用盲法,冠心病临床分型不一致且未进行亚组分析。(2)仅1项研究[10]是病证结合理论指导下的RCT,招募的患者以血瘀证为主,符合注射用红花黄色素的用药要求,余研究未分析证候分型,故无法避免因未对证用药而产生的不良反应。(3)世界卫生组织根据血浆LP谱将血脂异常分为5类,但纳入研究均未指出患者血脂异常所属分型,也未将极低密度脂蛋白(very low density lipoprotein,VLDL)、血浆乳糜微粒(chylomicrons,CM)作为结局指标,不利于分析联用注射用红花黄色素干预冠心病的适用范围。(4)本研究未检索灰色文献,且各研究间存在药物使用剂量、药物有效成分等多维度差异,故存在一定发表偏倚。
综上所述,联用注射用红花黄色素可有效降低冠心病患者LDL-C、TC、TG水平,升高HDL-C水平,纠正血脂异常,且不同主要有效成分的注射用红花黄色素对冠心病患者血脂指标的改善作用无明显差异,且不增加不良反应,但上述结论仍需高质量研究进一步支持。首先,建议在未来的研究中参考药物说明书,在病证结合理论体系下进行中药注射剂的RCT,并增设与出血风险相关的不良反应观察指标。其次,可考虑增加VLDL、CM等指标,明确血脂异常患者的临床分型及注射用红花黄色素的适用范围。最后,对于同类RCT,仍需要明确样本量的计算方法,病例脱落、剔除标准,常规用药类型及剂量,以减少文献的相关偏倚风险,提高证据质量。
作者贡献:李洪峥、滕羽鸥、赵鑫进行文章的构思与设计;李洪峥、杨光、陈恒文进行研究的实施与可行性分析;李洪峥、滕羽鸥、赵鑫、傅梦薇进行数据收集、整理、分析;李洪峥、滕羽鸥、杨光、赵鑫、陈恒文进行结果分析与解释;李洪峥负责撰写、修订论文;陈恒文负责文章的质量控制及审校,对文章整体负责、监督管理。
本文无利益冲突。
