罕见双侧同时性乳腺浸润性导管癌伴微乳头状癌1例及文献复习
2021-09-04王登阚艳芳李艳袁静萍
王登,阚艳芳,李艳,袁静萍
(1武汉大学人民医院病理科,武汉 430060;2恩施市中心医院病理科,恩施 445000;3通山县人民医院病理科 咸宁 437600)
乳腺癌是临床上女性发病率较高的恶性肿瘤之一,以单侧发病较为常见。同时性双侧原发性乳腺癌(simultaneous bilateral primary breast cancer,SBPBC)是指双侧乳腺同时独立发生的乳腺癌[1],其发病率较低。近年来随着乳腺癌筛检的普及、检查方法的改进以及单侧乳腺癌患者的生存时间延长,双侧乳腺癌的发病率有所增加[2]。据文献报道,欧美国家SBPBC的发病率呈逐年上升的趋势[3]。武汉大学人民医院近日收治1例双侧乳腺浸润性导管癌伴微乳头状癌的会诊患者,结合该病例临床特征、病理特点,查阅相关资料,汇总如下,拟进一步加深对SBPBC的认识。
材料与方法
1 临床资料
患者,女性48岁。发现双乳肿块5天入院,双侧乳腺6点钟方向均可触及一大小约1.0cm的肿块,边界不清,有压痛。彩超示:右侧乳腺6点钟处可见一大小1.0cm×0.8cm低回声区,边界不清。左侧乳腺可见多个低回声区,边界尚清,其中6点钟处可见一大小约为0.5cm×0.7cm低回声区。血肿瘤标记物:甲胎蛋白(AFP):2.345 ng/ml,癌胚抗原(CEA):9.295 ng/ml,糖类抗原125(CA125):71.53U/ml,糖类抗原19-9(CA199):1 U/ml,糖类抗原153(CA153):189.2 U/ml,CA125、CA153及CEA均升高。
2 染色方法
乳腺肿瘤标本均经10%的中性福尔马林溶液固定过夜,常规取材、脱水、石蜡包埋、制片,切片厚度为3μm,进行常规HE染色,光镜下观察。免疫组织化学染色采用SP 法进行,严格按照试剂盒说明书步骤操作,一抗包括CK5/6、E-cadherin、ER、HER-2、Ki67、 P120、PR、D2-40,均购于DAKO公司。
结 果
1 巨检
第一次活检组织:左侧乳腺肿块组织蚕豆大1块,花生米大3块,切面灰白淡黄,质地软、脆;右侧乳腺肿块组织约3cm×2cm×1cm零碎组织一堆,呈灰红灰褐色。根治术标本:送检“左侧乳腺”皮处可见一约0.8cm 大手术切口,6点钟方向切开,可见一灰白色区域,质地较硬;送检“右侧乳腺”皮处可见一约0.5cm 大手术切口,约6点钟方向可见一缺损区域,周边可见部分灰白色质硬区。
2 镜检
镜下形态相似,肿瘤界限欠清,呈浸润性方式生长,镜下见大部分肿瘤细胞排列呈索状,簇状,多处脉管内可见癌细胞团,局部类似脉管腔隙内可见癌细胞团,腔隙之间有多少不等的间质,癌细胞团排列呈簇状或微乳头状,细胞团中央缺乏纤维血管轴心(图1A),其外缘呈锯齿状,细胞团与周围间质之间有大小不等腔隙,其内缺乏内容物,低倍镜下形态类似于微小乳头,两侧乳腺肿块镜下均可见高级别导管原位癌(图1B)。高倍镜下癌细胞呈立方或柱状,细胞质较丰富、呈细颗粒状、均质红染,细胞核为中-高级别,核较大。
3 免疫组织化学表型
双侧乳腺均显示ER(+,约90%),PR(+,约70%),HER-2 (1+),Ki67(+,约20%),P120(膜+),D2-40(淋巴管+),CK5/6(-),CD31阴性(图1C),E-cadherin(+)(图1D)。
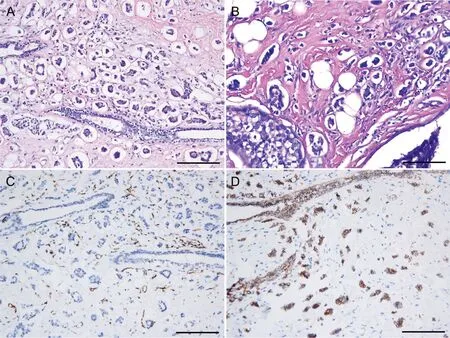
图1 乳腺浸润性微乳头状癌病理学观察。A,癌细胞呈微乳头状,无纤维血管轴心,浸润性生长;B,可见导管原位癌;C, CD31血管腔样裂隙阴性图;D,E-cadherin染色显示微乳头状细胞团边缘毛刺状,边缘表达缺失。比例尺:A、C和D,200μm;B,100μmFig. 1 The pathological observation of invasive micropapillary carcinoma of the breast. A, the tumor cells are arranged in a micropapillary form, showing an invasive growth pattern without fibrous vascular axis; B, the ductal carcinoma in situ structures can be observed; C, the vascular like cavity is CD31 negative; D, E-cadherin staining shows the spiculate boundary of micropapillary form cell masses with marginal expression loss. Scale bar: A, C,and D, 200μm; B, 100μm
4 临床诊断
病理诊断:①(双侧)乳腺浸润性癌,非特殊类型(WHO Ⅲ级),局部伴微乳头状癌(占比约30%),伴高级别导管原位癌,多处脉管内可见癌栓。②(左侧)腋窝淋巴结9/11枚可见癌转移,(右侧)淋巴结23/23可见癌转移。
5 治疗方法及结果
根据中国临床肿瘤学会乳腺癌诊疗指南,在乳腺穿刺组织诊断为(双侧)乳腺浸润性癌后,于2019年7月19日给予双侧乳腺改良根治术治疗,术后给予化疗,由于随访时间较短,患者目前处于完全缓解状态。
讨 论
双侧原发性乳腺癌的发病率占同期乳腺癌患者的1.4%~11.8%[4]。根据双侧乳腺癌发生的时间,双侧原发性乳腺癌可分为同时性(≤6个月)和异时性(﹥6个月),在临床上,同时原发性双侧乳腺癌更为少见[5],本例患者双侧乳腺肿块内均可见高级别导管原位癌,提示是双侧乳腺同时发生独立乳腺癌,不是从一侧转移到另一侧,且病理类型均伴有乳腺浸润性微乳头状癌,在临床上较为罕见。
乳腺浸润性微乳头状癌是乳腺浸润性癌中具有微乳头状结构的一种特殊亚型,在临床上发病率较低,占所有乳腺浸润性癌的3%~6%,大多病例表现为合并浸润性导管癌,即浸润性乳腺癌的局部表现[6]。乳腺浸润性微乳头状癌的病理学特征为中空或桑葚状癌细胞团构成的癌,呈浸润性导管癌形态,缺乏无轴心的微乳头状结构,与间质之间存在透明裂隙[7]。乳腺浸润性微乳头状癌相比其他类型的乳腺浸润性癌,具有更高的血道、淋巴结转移率和更强的淋巴管侵袭性。有研究表明,伴微乳头状癌的浸润性乳腺癌中,其淋巴结转移率高达91.7%[8],可见其恶性程度较高,预后较差,多数病例在发现乳腺浸润性微乳头状癌时已经有淋巴结转移,甚至出现远处转移。本例患者两侧乳腺均出现多个淋巴结转移,而淋巴结转移、淋巴管侵犯等均在恶性生物学行为中发挥了较大的作用,提示本例患者乳腺浸润性微乳头状癌侵袭程度高。
在乳腺浸润性微乳头状癌临床病理诊断中,有关微乳头状癌成分所占的比例与确诊为乳腺浸润性微乳头状癌还未形成统一的标准。有学者认为,乳头状癌成分所占比例达10%即可诊断为乳腺浸润性微乳头状癌;又有学者认为,只要病灶内出现微乳头状癌成分就应该诊断为浸润性微乳头状癌,并注明其所占的比例[9]。本例患者浸润性癌中微乳头状癌成分所占比例最高达30%,且双侧乳腺同时独立发生,作者在诊断时标注了浸润性微乳头状癌的比率。
大多数乳腺浸润性微乳头状癌患者ER、PR为阳性,无Her-2蛋白过表达,Ki67增殖指数低[10]。本例患者的免疫组化指标显示两侧乳腺肿瘤组织中,ER表达水平约为90%,PR表达水平约为70%,Her-2蛋白表达阴性,Ki67增殖指数约为20%,与多数普通单侧乳腺浸润性微乳头状癌的免疫表型相符合。有研究表明SBPBC患者两侧乳腺癌组织的ER、PR、Her-2表达具有较高的一致性[11],ER、PR阳性率大于69%,Her-2阳性率小于21%[12,13],本例患者两侧乳腺肿瘤组织免疫组化分子表型一致,且ER、PR、Her-2表达情况与SBPBC临床分子病理特征文献报道相符合,同样表明本例患者双侧乳腺癌为同时独立发生,不是从一侧转移到另一侧。
乳腺癌的发生、发展过程中常伴有肿瘤标记物的升高。CEA、CA125是一种广谱肿瘤标记物,在多种肿瘤包括乳腺癌患者的血清中可出现高表达,常用于乳腺癌的筛查[15]。CA153与乳腺癌的发生发展密切相关,常用于乳腺癌的辅助诊断[16]。本例患者血清肿瘤标记物CEA、CA153和CA125的表达量均超出正常医学范围,与付丽敏等[17]报道的CEA、CA153和CA125在乳腺癌组均高于健康组人群的结果相似,对于乳腺癌的临床诊断具有一定的预测价值。
乳腺浸润性微乳头状癌具有高转移性和高侵袭性,由于双侧原发性乳腺癌病例数有限,目前缺乏相应的流行学数据,但随着临床病例的不断积累和报道,对这类罕见病例预后的研究的不断深入,将临床诊断与病理学特点相结合,对患者进行针对性治疗,力求改善患者预后。
