ACOT7在小鼠妊娠早期子宫的表达和调控
2021-09-04刘松婷潘家乐王培轲孔双博王海滨张弘
刘松婷,潘家乐,王培轲,孔双博,王海滨*,张弘
(1苏州大学附属第二医院妇产科,苏州 215000;2厦门大学医学院生殖调控与生殖健康研究福建省高校重点实验室,厦门 361102;3广州医科大学附属第三医院妇产科,广州 510000)
胚胎的成功植入需要囊胚和子宫内膜都处于合适的状态,即囊胚获得植入能力,同时子宫内膜进入接受态[1-3]。母体内分泌的雌、孕激素对这两个过程都起到关键性的调控作用[4,5]。分子生物学和遗传学证据显示卵巢激素与局部产生的信号分子共同作用,将子宫环境从接受前状态转变为接受态,从而适于胚胎植入[1]。然而,调控妊娠早期胚胎-子宫信息交流的分子信号网络的全貌仍需更深入的探究。
ACOT7是脂酰辅酶A硫酯酶(Acyl-coenzyme A thioesterases,ACOTs)家族中研究最广泛的成员[6],该酶定位于细胞质,在脑组织和睾丸中高度表达[7,8],它对中、长链(C8-18)脂酰辅酶A具有较高的水解活性。ACOT7主要参与花生四烯酰辅酶A水解成花生四烯酸(AA)和辅酶A。AA是二十烷类化合物(前列腺素、白三烯和血栓烷类)的前体分子,在细胞信号转导、细胞增殖调控、代谢酶激活等方面发挥重要作用[9,10]。ACOT7最近被证实可以通过调节神经元的脂肪酸代谢,在神经毒性预防中发挥作用;Forwood等人证实ACOT7是炎症性疾病的候选药物靶点,ACOT7过表达可以改变巨噬细胞中前列腺素D2和E2的产生[6]。然而到目前为止,在生殖领域关于ACOT7的相关报道很少,我们在实验室前期的孕激素处理子宫后的转录组测序数据中发现,孕激素处理后ACOT7有较高的表达量,因此挑选其为研究对象,观察其在围植入期子宫中的表达模式。
本研究旨在探讨ACOT7在小鼠早期妊娠子宫中的表达和调节,通过构建不同的动物模型,利用QRT-PCR、原位杂交和免疫荧光技术检测ACOT7在小鼠早期妊娠的表达模式,并探究子宫中ACOT7基因的表达是否受雌激素(E2)和孕激素(P4)的调节,为进一步开展其在小鼠胚胎植入中的功能研究提供依据。
材料与方法
1 实验动物
所用CD1雌性小鼠(6~8周龄)均为清洁级,购于北京维通利华,饲养及实验操作过程严格遵循厦门大学实验动物管理条例。采用恒定适宜的温度和光照(12h光照,12h黑暗)条件饲养。
2 真孕鼠和假孕鼠的早期妊娠模型
通过将成年CD1雌鼠与成年正常或结扎输精管的CD1雄鼠合笼,获得所需真孕或假孕的CD1小鼠(见栓日视为妊娠第1d)。分别于每天早上10:00取妊娠小鼠子宫。妊娠第1d到第4d通过在显微镜下见到输卵管或子宫中冲出的胚胎确认真孕,第5d和第6d可通过静脉注射0.1%芝加哥蓝标记出植入位点。
3 激素调节模型
性成熟雌性CD1小鼠手术摘除双侧卵巢,休息2周,分别给予雌、孕激素刺激,分为以下4组:对照组、雌激素处理组、孕激素处理组和雌激素+孕激素处理组。①对照组:芝麻油;②雌激素处理组: 注射1μg/ml E20.1ml;③孕激素处理组:注射10mg/ml P40.1ml;④雌激素+孕激素处理组:注射1μg/ml E2和 10mg/ml P4各0.1ml。每组3只小鼠,颈背部皮下注射6h和24h后取小鼠子宫,所用激素均用芝麻油作为溶剂。
4 延迟植入模型
妊娠第4d早上08:00 ~ 09:00摘除小鼠双侧卵巢,第5d到第7d连续给予P4刺激(颈背部皮下注射,2mg/只)。第7d通过注射E2(颈背部皮下注射,25ng/只)使经P4维持的延迟植入重新启动植入过程。分别在E2刺激12h、24h后取材。所用激素均用芝麻油作为溶剂。
5 原位杂交
利用 NCBI 网站的 primer-blast 功能设计识别ACOT7全部剪接体的特异性引物,由擎科生物公司合成,用妊娠第4d小鼠子宫cDNA作为 PCR 扩增模板(引物序列见表1)。DIG-RNA 探针的标记使用 Promega 公司体外转录体系,反转后的探针加入1μl 0.5mol/L EDTA终止RNA聚合酶活性,NH4OAc(10 mol/L)4μl,无水乙醇50μl,-80℃静置1h,4℃ 12,000r/min 离心15min,弃上清,干燥后用20μl DEPC H2O重悬,分装,-80℃冻存。
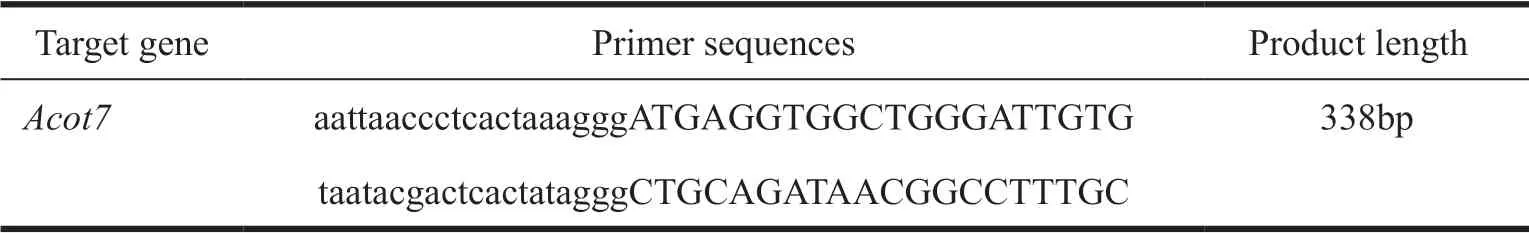
表1 原位杂交探针引物序列Tab. 1 Sequences of in situ hybridization probes
地高辛标记原位杂交实验简述如下,小鼠子宫冰冻切片(10μm)用PBS配置的4%多聚甲醛(Sigma-Aldrich)固定,乙酰化处理后在含有探针的50%甲酰胺缓冲液中55℃杂交过夜。杂交后切片用RNase(20μg/ml, Takara)37℃孵育20min,封闭后用碱性磷酸酶(AP)标记的anti-DIG抗体4℃孵育过夜。使用左旋咪唑减少内源碱性磷酸酶活性的影响。配置显色液NBT/BCIP(Promega, Madison,USA)进行显色,适时终止后用核固红对细胞核进行复染。
6 实时定量RT-PCR
Trizol 法提取小鼠全子宫总RNA,按照 TRIzol试剂盒(Invitrogen)说明书进行。取1μg的RNA作为模板用转录试剂盒(Takara)反转成cDNA。qRTPCR使用SYBR Premix试剂盒(Takara)体系进行。Gapdh作为内参基因;引物序列见表2。
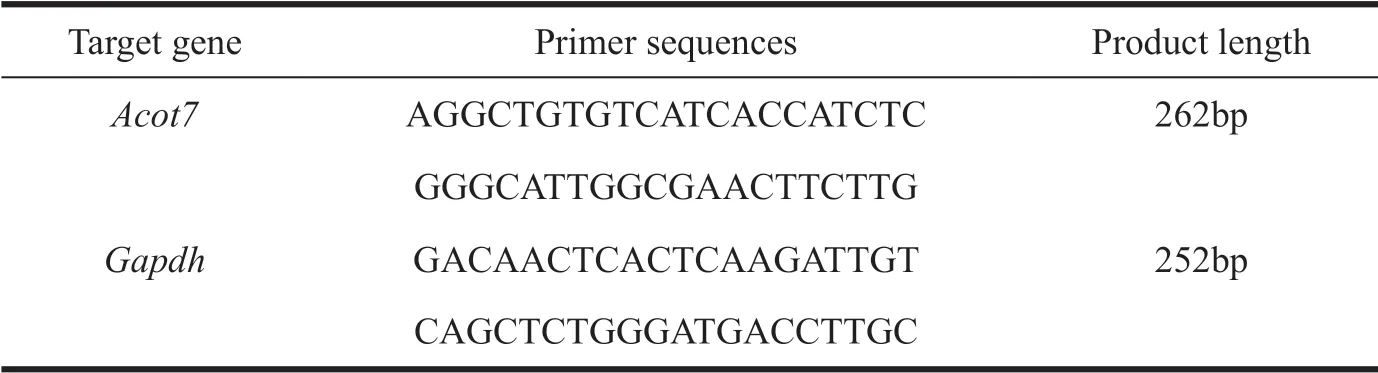
表2 实时定量PCR引物Tab. 2 Sequences for Real-time PCR primers
7 免疫荧光染色
组织块在4% PFA中固定过夜,梯度酒精脱水及二甲苯透明后浸蜡包埋。石蜡切片厚5 μm,脱蜡复水后用10 mM 柠檬酸钠进行高压修复,PBS浸洗3×5 min,5% BSA/PBS 室温封闭1h,与封闭液稀释的 ACOT7抗体(1:400;货号39350-2,Signalway)4℃孵育过夜,PBS 浸洗3×5 min,Cy3标记的山羊抗兔IgG H&L 二抗孵育1h,PBS 浸洗3×5min,DAPI孵育30min,激光扫描共聚焦显微镜(LEICA)观察。
8 统计学分析
实验模型中每组随机选取3只小鼠进行qRTPCR,每个基因做3次重复实验,每次实验做两个复孔。利用 SPSS 18.0 统计软件对各实验数据进行统计分析,检验方差齐性后运用两独立样本t检验进行组间比较,以P<0.05 为有统计学意义。
结 果
1 ACOT7在小鼠早期妊娠子宫中的表达定位
为了探究ACOT7是否在妊娠早期的子宫中有表达,我们首先建立了真、假孕小鼠模型,选取妊娠第1到6d观察ACOT7在小鼠子宫的表达定位情况。原位杂交检测显示,ACOT7在妊娠第1~2d的腔上皮和腺上皮中有微弱表达,在第3~4d子宫腔上皮和腺上皮中高表达,而在第5~6天的腔上皮和腺上皮中又仅有微弱表达,真孕和假孕模型中表达模式无明显差异(图1A、B)。qRT-PCR分析显示,ACOT7的mRNA 表达量在真孕第3~4d和假孕第3~4d的小鼠子宫中明显高于其余时间点,表达水平动态变化趋势与原位杂交检测结果一致(图1C、D)。
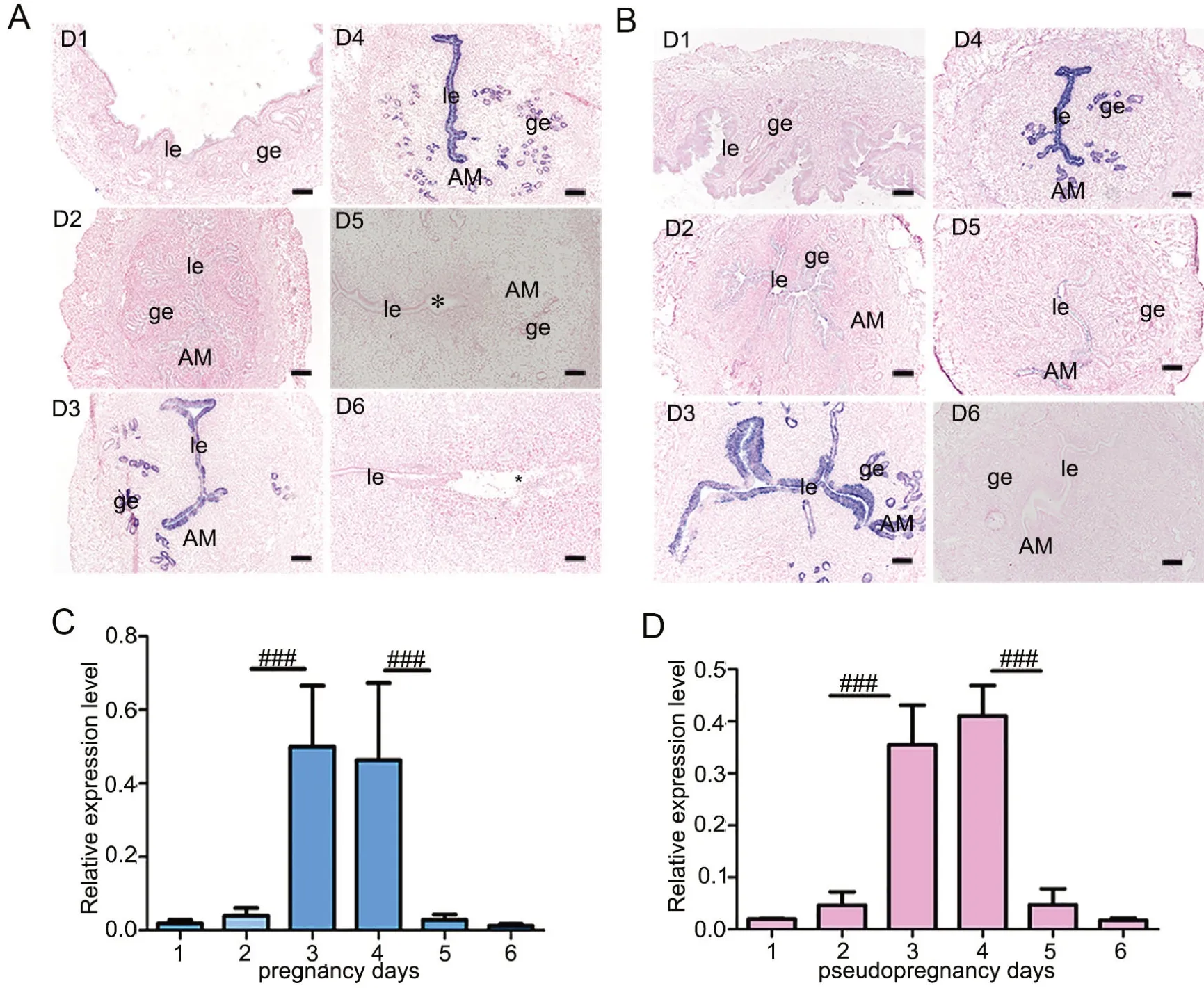
图1 围植入期真假孕子宫中 ACOT7 mRNA表达。A和B,真孕(A)和假孕(B)第1~6d小鼠子宫内ACOT7 mRNA表达的原位杂交检测;D1—D6,早孕或假孕第1~6d;le,腔上皮;ge,腺上皮;AM,系膜对侧;*,囊胚;比例尺,100μm。C和D,真孕(C)和假孕(D)小鼠子宫内ACOT7 mRNA表达的qRT-PCR检测;###P<0.001Fig. 1 Expression of ACOT7 mRNA in the uteri of pregnancy and pseudopregnancy mice during peri-implantation period. A and B, in situ hybridization detection of ACOT7 mRNA expression in the uteri of the mice on days 1 to 6 of the pregnancy (A) or pseudopregnancy (B); D1 to D6, day 1 to day 6 of pregnancy or pseudopregnancy; le, luminal epithelium; ge, gland epithelium; AM, antimesometrium; *, embryo; scale bar, 100μm. C and D, qRT-PCR detection of ACOT7 mRNA expression in the uteri of the pregnancy (C) and pseudopregnancy (D); ###P<0.001
进一步采用免疫荧光染色检测ACOT7的定位显示,ACOT7在真、假孕小鼠子宫第1~4d的表达模式与原位杂交显示的 mRNA 的表达模式基本一致,并且显示在第3~4d子宫腔上皮和腺上皮高表达;然而,ACOT7蛋白在真、假孕小鼠子宫第5~6d的腔上皮和腺上皮中仍高表达(图2)。由此表明,ACOT7在早期妊娠小鼠子宫中呈时空特异性动态表达。
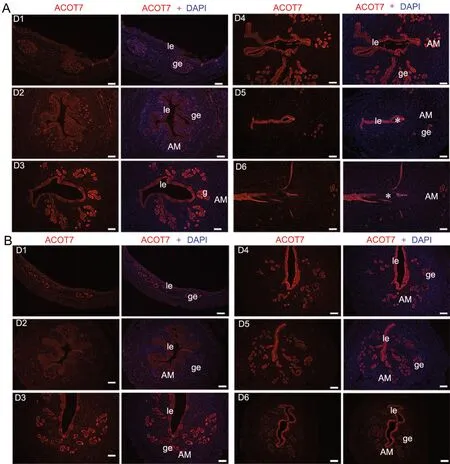
图2 围植入期真假孕子宫中 ACOT7表达的免疫荧光检测。A,妊娠第1~6d小鼠子宫;B,假孕第1~6d小鼠子宫达; le:腔上皮;ge:腺上皮,AM:系膜对侧,*,囊胚;比例尺,100μmFig. 2 Immunofluorescence examination of ACOT7 in the uteri of pregnancy and pseudopregnancy mice during peri-implantation period. A, the uteri of mice on the day 1 to 6 of pregnancy; B, the uteri of mice on the day 1 to 6 of pseudopregnancy; le, luminal epithelium; ge, gland epithelium; AM,antimesometrium; *, embryo; scale bar, 100μm
2 类固醇激素对ACOT7表达的调节
由于类固醇激素E2和P4在子宫接受态的调节中起关键作用,结合ACOT7在子宫中的动态表达模式,我们推测P4和E2可能参与调节子宫中ACOT7的表达。因此,我们构建了卵巢摘除后的雌、孕激素处理的动物模型,检测了E2和P4处理对卵巢摘除后小鼠子宫内ACOT7 mRNA和蛋白表达的影响。原位杂交检测显示,P4注射6h后,子宫的腔上皮和腺上皮中ACOT7 mRNA的表达上调,并持续至24h仍然有较高表达;而注射E2后,无论6h还是24h,均未ACOT7 mRNA的表达都未检测出明显变化(图3A)。qRT-PCR检测显示,E2单独刺激并不能诱导ACOT7转录水平的变化,而单独给予 P4后,在6h和24h均可见 ACOT7 mRNA表达量升高,E2和 P4同时作用6h和24h时ACOT7 mRNA表达量与P4单独作用无明显差异(图3B)。
免疫荧光结果显示,ACOT7蛋白在激素处理的小鼠子宫中的表达模式与原位杂交结果一致。与对照组相比,ACOT7蛋白水平在E2处理6 h和24 h后表达差异不显著;而P4处理6 h和24 h后,腔上皮和腺上皮细胞中ACOT7蛋白的表达显著升高;E2+P4同时刺激与P4单独作用ACOT7在蛋白水平未见明显差异(图3C)。
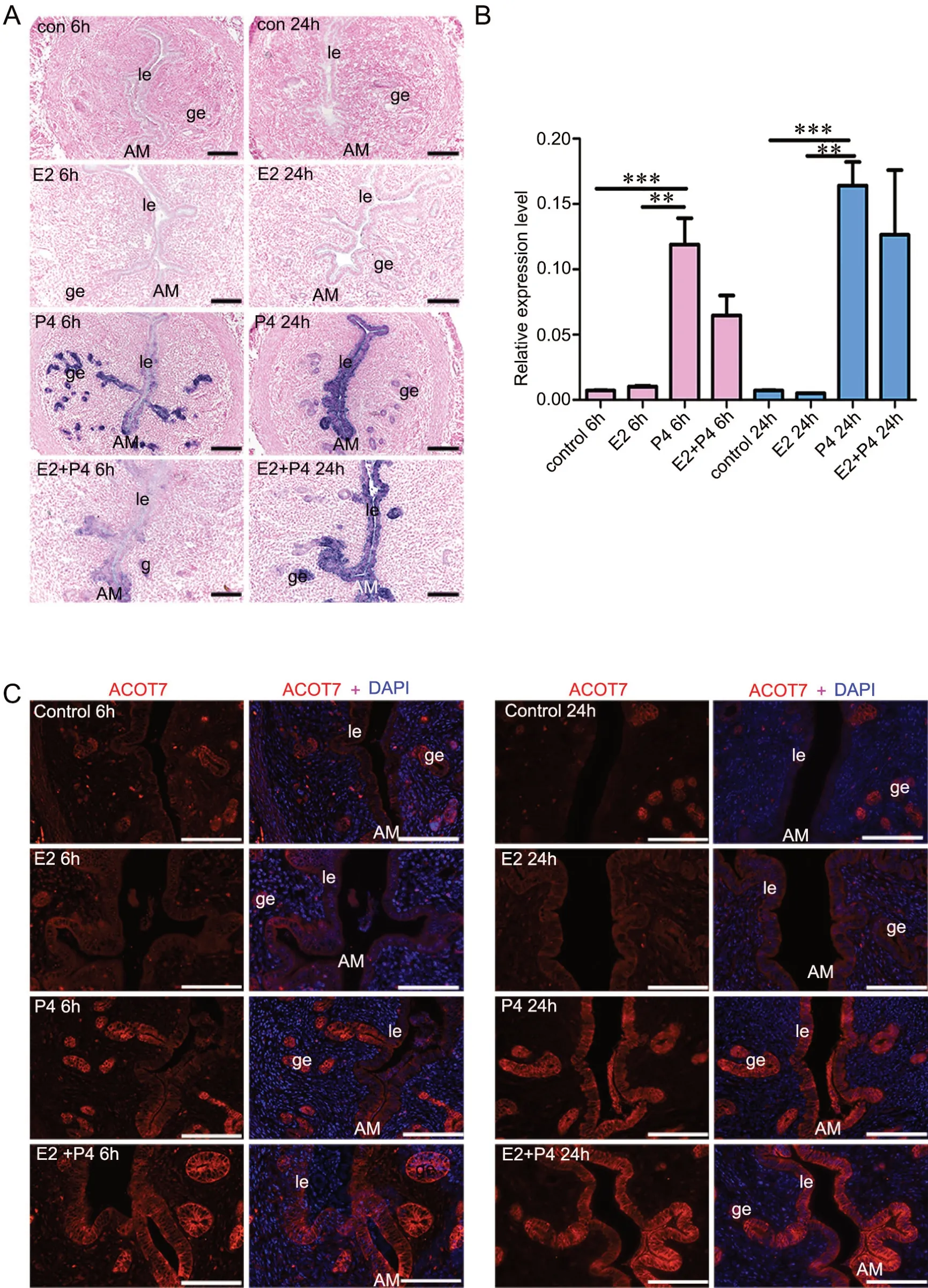
图3 雌激素和孕激素对子宫ACOT7表达调控作用检测。 A,E2 和 P4对卵巢摘除后小鼠子宫内ACOT7表达影响的原位杂交检测;B,E2 和P4对卵巢摘除后小鼠子宫内ACOT7表达影响的qRT-PCR检测(**P<0.01,***P<0.001);C,E2 和 P4对卵巢摘除后小鼠子宫内ACOT7表达影响的免疫荧光检测; le,腔上皮;ge,腺上皮;AM,系膜对侧;比例尺,100 μmFig. 3 The effect of estrogen and progesterone on the expression of ACOT7 in the uteri. A, in situ hybridization detection of the effect of estrogen and progesterone on the expression of ACOT7 in the uteri of ovariectomized mice; B, qRT-PCR detection of the effect of estrogen and progesterone on the expression of ACOT7 in the uteri of ovariectomized mice (**P<0.01,***P<0.001); C, immunofluorescence examination of the effect of estrogen and progesterone on the expression of ACOT7 in the uteri of ovariectomized mice; le, luminal epithelium; ge, gland epithelium, AM, antimesometrium.;scale bar, 100μm
3 ACOT7在小鼠延迟着床与激活模型中的表达
为了进一步明确ACOT7与胚胎粘附过程的关联,我们利用延迟植入小鼠模型,检测了延迟着床与激活时ACOT7在子宫中的表达情况。免疫荧光检测表明,ACOT7在延迟着床子宫中主要表达于腔上皮和腺上皮细胞中;雌激素激活胚胎植入后,ACOT7同样表达在腔上皮和腺上皮细胞中,两组信号表达没有明显差异(图4)。
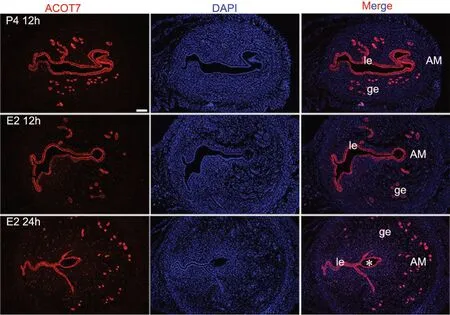
图4 ACOT7 在延迟植入模型中表达的免疫荧光检测。Le,腔上皮;ge,腺上皮;AM,系膜对侧;*,囊胚;比例尺,100μmFig. 4 Immunofluorescence examination of ACOT7 expression in the uteri of the delayed implantation mouse model. le, luminal epithelium; ge, gland epithelium; *, embryo; scale bar, 100μm
讨 论
胚胎植入是整个妊娠过程中关键环节之一,处于接受态的子宫和有植入能力的囊胚是植入的必要前提。子宫接受态的建立是在卵巢雌孕激素及其核受体ER和PR的主导下,通过下游的转录因子、生长因子等共同作用,引导子宫细胞进行有序的增殖与分化,获得对胚胎植入有容受能力的过程[11-13]。在妊娠小鼠中,第1~4d是胚胎植入前期,在此期间自第3d起,孕激素水平逐渐升高,在第4d伴随一个植入前雌激素的小高峰协同诱导子宫接受态的建立,第4.5d胚胎植入发生[14,15]。本研究发现,在真、假孕第1~4d小鼠子宫中ACOT7的 mRNA和蛋白表达模式一致,相较于第1~2d的低表达,第3~4d均在子宫上皮细胞明显升高,这一表达模式提示ACOT7可能参与了早期妊娠小鼠子宫接受态的建立。
本研究发现,ACOT7在妊娠第1~4d的表达模式与mRNA结果吻合,而第5~6d腔腺上皮中表达的mRNA 较低,但其蛋白表达依然维持高水平的胞质信号,推测可能由于ACOT7稳定半衰期较长;ACOT7 在早期妊娠阶段维持子宫腔腺上皮高表达的表达模式,提示其可能在小鼠早期妊娠中起一定调控作用。
既往报道表明,ACOT7主要参与花生四烯酰辅酶A水解成花生四烯酸(AA)和辅酶A,AA是二十烷类化合物(前列腺素、白三烯和血栓烷类)的前体分子,在细胞信号转导、细胞增殖调控、代谢酶激活等方面发挥重要作用[9,10]。前列腺素(PGs)是花生四烯酸的衍生物,在胚胎植入过程中起着不可或缺的作用;在胚胎植入过程中,胚泡粘附及侵入位点处出现的子宫内膜血管通透性增加是该过程的一个典型标志,涉及各种前列腺素的参与,而PGs的合成和作用紊乱将导致植入失败[3]。胞浆型磷脂酶A2(cPLA2α)是生成前列腺素前体的重要酶,缺乏该酶的小鼠(cPla2α-/-)生殖能力明显下降,进一步证明了前列腺素在植入中的作用[16]。因此我们推测,ACOT7作为提供前列腺素合成底物的分子,可能参与早期妊娠过程中前列腺素的动态调节。
雌激素和孕激素对于成功的胚胎植入不可或缺[17]。在类固醇激素的协调作用下,整个子宫内膜进行周期性动态重塑[18]。在小鼠中,由于排卵前卵巢雌激素峰的作用,在妊娠第1d和第2d子宫上皮细胞处于增殖状态;随着第3d孕激素水平逐渐增加,上皮停止增殖开始分化[19]。伴随着妊娠第4d植入前雌激素峰的出现,胚胎在第4.5d植入。本实验通过切除小鼠卵巢,去除内源性类固醇激素的分泌,再经过皮下注射雌激素或孕激素,研究雌激素和孕激素对小鼠子宫中ACOT7表达的调节。结果发现,卵巢切除小鼠在注射雌激素后ACOT7的表达和对照组无明显差异;而注射孕激素后,ACOT7 mRNA和蛋白水平在腔上皮和腺上皮中的表达均明显上调,由此可见ACOT7在小鼠子宫腔上皮和腺上皮中的表达主要受孕激素的调节。
综上所述,在早期妊娠的小鼠子宫组织中,ACOT7的表达呈动态变化,且在子宫腔上皮和腺上皮中的表达受到孕激素的调控。深入研究ACOT7在早期妊娠子宫中的表达和调节,将有助于我们理解胚胎植入的分子机制,为不孕不育等相关疾病的治疗提供理论依据。
