实时荧光聚合酶链反应在检测冷冻禽、畜肉类中沙门菌中的应用
2021-09-03乔玉林
乔玉林
(正阳县疾病预防控制中心 检验科,河南 驻马店 463600)
沙门菌属于革兰阴性无芽孢杆菌,目前国际上已检测出2 500 多种血清型,且几乎所有类型沙门菌均可对食物造成污染[1]。沙门菌为人畜共患的一种肠道致病菌,可造成伤寒、副伤寒及胃肠炎,对患者身体健康造成影响。随着国民对冷冻禽、畜肉的日常需求量增加,如何在较短时间内快速、准确检测出沙门菌成为研究热点。传统的沙门菌检测方法多是通过表型特征检查及免疫学检测,但检测周期较长,且敏感性较低,易延误产品储存时间,增加成本[2]。近年来,实时荧光聚合酶链反应检测技术(RT-PCR)在食品检测中的应用价值得到广泛关注。相较于常规检测方式,其具有简单、快速、特异性及敏感性较高、重复性强等优势,在大面积检查中发挥了重要作用[3]。基于此,本研究于2017年1月至2019年12月对正阳县107 家冷库选取的270 份冷冻禽、畜肉类进行分析研究,以期明确RT-PCR 检测技术的应用价值。
1 资料与方法
1.1 研究对象及仪器、试剂
选取2017年1月至2019年12月冷冻禽、畜肉类270 份。仪器主要包括全自动微生物鉴定和药敏分析仪、全自动核酸提取仪、实时荧光PCR 仪;试剂主要包括沙门菌PCR 检测试剂盒、宁波天润沙门菌分型鉴定血清、北京陆桥公司生化试剂、选择性分离培养基、前增培养液。所有试剂均有国家批准文号且都在有效期内。
1.2 方法
取25 g 冷冻禽、畜肉类样品,加入沙门菌的选择性增菌液,使用拍打式无菌均质器上连续均质拍打2 min,作为组织匀浆。增菌培养采用《食品安全国家标准 食品微生物学检验 沙门氏菌检验》(GB 4789.4—2016)(以下简称《标准》)。依据《标准》实施细菌培养,采取全自动核酸提取工作站磁珠法提取核酸,裂解细胞后,从细胞中游离出的核酸分子被特异的吸附至磁性颗粒表明,蛋白质留于溶液内,待反应一定时间后,利用磁场作用分离液体和磁性颗粒,回收颗粒,即获取磁珠-DNA混合物,随后采取脱洗液对其实施脱洗处理,获取纯净DNA;采取PCR 检测试剂盒实施荧光聚合酶链式反应(PCR),开展沙门菌特异性及敏感性试验,此过程用时仅4 h。(3)针对PCR 检查结果呈阳性的样品增菌液划线接种至琼脂(DHL)及木糖赖氨酸脱氧胆酸盐(XLD)琼脂平板实施培养,观察结果。挑选无色半透明产H2S菌株及不产H2S 的可疑菌落,放于营养琼脂平板上,于37℃环境下扩大培养24 h,随后采取全自动微生物鉴定及药敏分析仪(VITEK-32)实施生化鉴定,各项操作均需严格按照说明书完成,所有获取的数据录入计算机实施分析及判读、记录,最后生成报告此过程用时至少需要72 h。
血清学分型鉴别。O 型抗原准备: 于干燥环境下,将菌株接种在较高琼脂量的营养琼脂板上(2.5%~3.0%),37℃环境下扩大培养24 h。O 型抗原的鉴定:采用多价O 血清做玻片凝集试验,以生理盐水作为对照,生理盐水自凝者为粗糙形菌株,不进行分型。多价O 血清凝集者依次进行单因子血清凝集实验。H 型抗原准备:于湿润环境下,将菌株点种在较低琼脂量的半固体琼脂板(0.6%~0.65%)中央或2~3 点,37℃环境下扩大培养24 h。半固体琼脂板配方组成包括1 000 mL 胰胨大豆肉汤、0.3 g 去氧胆酸盐、6.0~6.5 g琼脂,经高压蒸气(100℃,PH 7.4)灭菌20 min。H 型抗原鉴定:采用多价H 血清检验,发生凝集后逐次依据单因子血清实施血清学检验,以确定抗原定第1 相或第2 相,单相抗原不必做位相变异检查,对于双相抗原需进一步进行位相变异检查,可通过已知相的H 抗原诱导相抗血清进行接种培养,37℃环境下扩大培养24 h 后,挑选鞭毛动力较强的菌苔检查。并按照《标准》的规定进行检验,以检验结果作为对照组。
以RT-PCR、《标准》、菌群培养多种方法检查结果为金标准,任一阳性即为阳性。
1.3 观察指标
(1)统计分析《标准》及RT-PCR 检测阳性率、敏感度、特异度。(2)统计分析270 份冷冻禽、畜肉类沙门菌RT-PCR 鉴定结果及血清分型鉴定结果。
1.4 统计学方法
通过SPSS 22.0 对数据进行分析,计数资料n(%)表示,χ2检验,P<0.05 表示差异有统计学意义。
2 结果
2.1 诊断价值
冷冻禽、畜肉类270 份以RT-PCR、《标准》、菌群培养多种方法检查结果为金标准,任一阳性即为阳性。共检测出33 份样品呈阳性,237 份呈阴性。RT-PCR 对冷冻禽、畜肉类中沙门菌检测阳性率11.85%(32/270)高于《标准》6.67%(18/270),差异有统计学意义(χ2=4.320,P=0.038)。RT-PCR 检测敏感度高于《标准》(P<0.05),RT-PCR 检测特异度与《标准》比较,差异无统计学意义(P>0.05)。见表1。
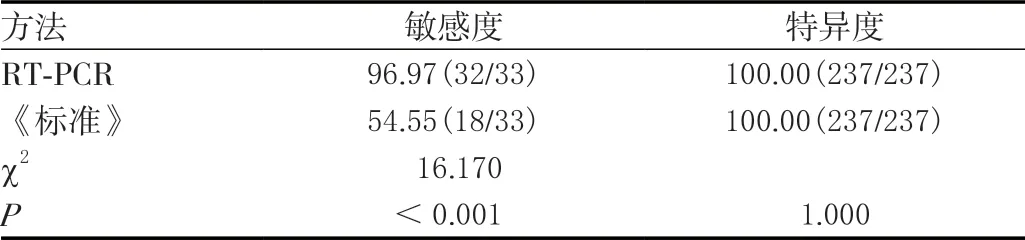
表1 诊断价值
2.2 RT-PCR 鉴定结果及血清分型鉴定结果分析
对所检出沙门菌实施血清分型鉴定后得知,肯塔基血清型、海德堡血清型、鼠伤寒血清型、肠炎血清型占比最高,分别为21.875%(7/32)、18.750%(6/32)、15.625%(4/32)、12.500%(4/32)。见表2。

表2 冷冻禽、畜肉类沙门菌血清分型鉴定结果分析(N=32)
3 讨论
近年来,随着经济发展水平迅猛提升,国民对禽畜肉类需求量持续增加,我国各个海关进口冷冻禽、畜肉类增多,对多批次巨量冷冻禽、畜肉类的检验工作增加了难度。同时,若冷冻禽、畜肉类检测周期过长,可能会对对外贸易各个环节造成极大影响,并阻碍冷库正常储存周转运作,增加冷库储存周转压力[4]。因此,急需寻找一种准确度高、敏感性及特异性高、操作简单的检验方式。
研究指出[5],沙门菌具备菌型多样、分布广泛及检验程序复杂等诸多特性,而传统检验沙门菌的过程则包括前增菌与后增菌、分离培养、生化鉴定和分型等多个过程,耗时通常可达4~10 d,逐渐难以满足实际需求。本研究采用RT-PCR 相较于常规检测方式具有显著优势,主要表现在:(1)操作简单,且可靠、迅速。RTPCR 法测定沙门菌无需菌体富集培养,仅需提取全基因组DNA,并和其他反应物质予以混合,并把混合后反应液上机实施检测,能快速获取初步检测分析报告结果,而传统常用的常规国际检测方法包括增菌、分离培养基血清分型、生化鉴定等多个步骤,繁琐复杂[6];(2)检测结果可靠、直观。荧光定量PCR 仪自带软件,可直观查看有无扩增和扩增特异性,且能依据所建立标准曲线,对沙门菌DNA 含量予以自动计算(软件还能对检测结果进行自动保存),虽部分实验室采取重组后质粒作标准,但沙门菌重组质粒标准品的准备较费时、复杂,经直接获取的基因组DNA 特异性扩张产物作标准曲线,也可获取较满意的结果;(3)重复性强、特异性高、识别能力好,当前临床用于检测沙门菌的基因主要包括fimY基因、invA 基因、hns 基因、hilA 基因、hut 基因,其中invA 基因编码蛋白广泛存在于沙门菌表面,为侵袭肠黏膜细胞所必需物质,故invA 基因为PCR 测定沙门菌的重要靶基因,通过针对沙门菌invA 基因设定的引物实施扩增,具有较高特异性[7];(4)检出率高,常规检测措施在沙门菌中极易造成漏诊,而RT-PCR 法检出率高,且若扩增条件一致,其能同时检测出多种菌株。因此,RT-PCR 为冷冻禽、畜肉类中沙门菌等致病微生物的检测提供了快速、准确度较高的可能性,在公共卫生突发事件的防控中发挥关键作用[8]。同时,本研究结果也显示,RT-PCR 法对冷冻禽、畜肉类中沙门菌检测阳性率可达11.85%,显著高于《标准》的6.67%,且敏感度高于《标准》,并能明确其具体血清分型,证实RT-PCR 可用于冷冻禽、畜肉类沙门菌检测。
综上所述,RT-PCR 法在冷冻禽、畜肉类中沙门菌快速检测中具有较高应用价值,可准确检测出沙门菌,并明确其具体分型,避免了传统检测中检测时间长、操作繁琐等不足。
