抗杀螟硫磷生物素化纳米抗体的制备及其在免疫检测方法中的应用
2021-09-02王宇张译丰沈玉栋陈子键刘佳蔡伟谊曾羲徐振林
王宇,张译丰,沈玉栋,陈子键,刘佳,蔡伟谊,曾羲,徐振林
(1.广东省食品质量安全重点实验室,华南农业大学食品学院,广东广州 510640)(2.广州市食品检验所,广东广州 511400)
杀螟硫磷是一种中等毒性的有机磷杀虫剂,适用于多种作物的虫害防治。杀螟硫磷会抑制乙酰胆碱酯酶活性,使得神经递质乙酰胆碱无法正常分解,从而阻断正常的神经传递引起中毒反应[1,2]。不合理施用有机磷农药会导致人体中毒,还会污染水体和土壤,对其他动物也会产生一定的毒害作用[3,4]。目前我国对食品中杀螟硫磷最大残留限量(MRL)规定与一些发达国家地区仍有较大差距。以蔬菜水果类为例,我国对果蔬中杀螟硫磷的MRL规定均为0.5 mg/kg(除结球甘蓝为0.2 mg/kg外);日本对不同果蔬中的杀螟硫磷MRL从0.01~10 mg/kg不等,对于未制定MRL的品种则采用0.01 mg/kg的统一标准;而欧盟对果蔬中的杀螟硫磷MRL规定则均为严格的0.01或0.02 mg/kg。虽然在一些果蔬中检出杀螟硫磷的报导中未发现超标情况[5,6],但是与国际上一些更为严格的食品标准相比仍然容易出现超标现象[7]。因此开发高灵敏度的杀螟硫磷检测方法对于我国进出口贸易以及相关食品标准的完善有重要意义。
目前检测杀螟硫磷的方法有仪器分析法[8]、表面增强拉曼光谱技术[9,10]、电化学检测法[11,12]、荧光检测法[13]、免疫分析法等。其中免疫分析法是仪器分析分析方法的重要补充,具有灵敏度高、特异性强、检测时间短、易操作等优点,更适用于样品的大批量快速筛查[14,15]。目前已报道的杀螟硫磷免疫分析方法大多数是基于多克隆抗体或单克隆抗体[16-18],其制备的周期较长,筛选过程也相对繁琐,成本较高[19]。制备基因工程抗体只需一次成功的动物免疫即可利用微生物对抗体基因进行高通量的筛选和大规模的表达,其制备的时间及成本都将大大降低[20]。Luo等通过核糖体展示技术得到亲和力在109~1010L/mol之间的三株抗杀螟硫磷的单链抗体(scFv),并应用到大米、黄瓜样品的检测中[21]。
骆驼科动物或鲨鱼科动物体内含有天然缺失轻链的重链抗体亚型,通过基因工程手段制备的可变区重链抗体(VHH)即为纳米抗体(Nbs)[22,23]。与传统抗体衍生而来的基因工程抗体如 scFv和抗原结合片段(Fab)相比,Nbs由于无需重链和轻链的配对而更加容易可溶性表达且不易丢失活性[24,25]。本研究在实验室前期制备杀螟硫磷半抗原及人工抗原的基础上[26],用免疫后的羊驼淋巴细胞构建了抗杀螟硫磷纳米抗体基因文库。采用噬菌体展示技术淘筛得到特异性识别杀螟硫磷的纳米抗体,并通过生物素化后建立了基于生物素-链霉亲和素系统间接竞争酶联免疫分析方法,用于对杀螟硫磷的快速灵敏检测。
1 材料与方法
1.1 实验材料
杀螟硫磷免疫原和检测抗原由本实验室前期工作制备;pINQ载体和携带生物素连接酶基因(BirA)的 PCY216载体,由乌拉圭共和国大学 González-Sapienza Gualberto教授馈赠;PCR引物,广州睿博生物科技股份有限公司合成;杀螟硫磷标准品,坛墨质检科技股有限公司;淋巴胞分离液、生物素及辣根过氧化酶(HRP)标记链霉亲和素(SA-HRP),北京索莱宝科技有限公司;总RNA提取试剂盒,广州捷倍斯生物科技有限公司;DNA回收试剂盒及质粒小提试剂盒,天根生化科技(北京)有限公司;反转录试剂盒以及T4 DNA连接酶,赛默飞世尔科技(中国)有限公司;SfiI限制性核酸内切酶及M13KO7辅助噬菌体,NEB(北京)有限公司;rabbit-antiVHH-HRP(HRP标记的抗驼科动物VHH兔多抗),Genscript公司;牛血清白蛋白(BSA),美国Sigma公司;1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)、N-羟基琥珀酰亚胺(NHS),上海源叶生物科技有限公司。
1.2 主要仪器设备
蛋白纯化仪(AKTATM Pure),美国GE公司;自动洗板机(DEM-3型),北京拓普分析仪器有限责任公司;PCR扩增仪(DNA Engine),美国BIORAD公司;凝胶成像系统(GDS7500型),美国BIORAD公司;电转仪(Gene Pulser Xcell),美国BIORAD公司;生化培养箱(LRH-150A),广东省医疗器械厂;酶标仪(Multiskan MK3),美国Thermo公司;超微量分光光度计(Nanodrop 2000C),美国Thermo公司。
1.3 试验方法
1.3.1 动物免疫
选用约3岁的健康雄性羊驼,在其颈背部皮下注射免疫。首次免疫用1 mg免疫原与弗氏完全佐剂混合注射;后续每两周一次加强免疫,使用0.5 mg免疫原与弗氏非完全佐剂混合注射,一共进行四次免疫。每次加强免疫一周后采集1 mL羊驼血清采用间接酶联酶联免疫分析(ic-ELISA)检测血清免疫应答情况。
1.3.2 硫磷纳米抗体基因文库制备
采集第三、四次免疫一周后的羊驼外周血,用商业试剂盒分离淋巴细胞、提取总RNA、合成cDNA。以cDNA为模板,用引物CALL001(GTCCTGGCTG CTCTTCTACAAGG)和CALL002(GGTACGTGCTG TTGAACTGTTCC)进行第一次PCR扩增羊驼免疫球蛋白G(IgGs)基因,切胶回收750 bp条带作为第二次 PCR模板,用引物 F-SfiI(CATGCCATGACTGT GGCCCAGGCGGCCCAGKTGCAGCTCGTGGAGT C)和R1-Sfi(ICATGCCATGACTCGCGGCCGGCCTG GCC ATGGGGGTCTTCGCTGTGGTGCG)扩增IgG2-VHH基因,用引物F-SfiI和R2-SfiI (CATGCCATGA CTCGCGGCCGGCCTGGCCG TCTTGTGGTTTTGGT GTCTTGGG)扩增 IgG3-VHH基因。用限制性核酸内切酶SfiI酶切pComb3Xss噬菌粒载体和VHH基因,T4连接酶连接VHH基因和pComb3X载体片段,将酶连产物电击转化至E.coliTG1得到纳米抗体基因文库,经辅助噬菌体M13KO7救援后得到噬菌体展示文库,用于纳米抗体文库阳性克隆淘筛。
1.3.3 杀螟硫磷纳米抗体淘筛
杀螟硫磷纳米抗体基因文库采取“同时竞争”策略[27]进行四轮淘筛。杀螟硫磷抗原用碳酸缓冲液稀释(1000、500、250、125 ng/mL),在酶标板中(每孔0.1 mL)4 ℃包被过夜。用磷酸盐缓冲液(PBS)洗去游离抗原,用3% BSA-PBS封闭1 h。噬菌体展示库中添加 1% BSA(W/V),转移到固定化抗原的微孔中(每孔0.1 mL),37 ℃孵育1 h,用PBS-0.05%吐温20(PBST)洗去游离的噬菌体。每孔加入0.1 mL甘氨酸-盐酸(0.1 mol/L,pH 2.2),37 ℃孵育10 min后,收集洗脱液到离心管中,加入1 mol/L Tris溶液中和,添加杀螟硫磷标准溶液至目标浓度(500、100、20、4 ng/mL)后重新分配到新的微孔中(每孔0.1 mL)竞争反应 1 h,收集微孔中液体即为输出噬菌体(output)。用一半的 output噬菌体侵染E.coliTG1扩增噬菌体用于下一轮淘筛;另外一半output噬菌体取10 μL侵染E.coliTG1并涂布氨苄西林平板测滴度,剩余噬菌体保存在-20 ℃。从第三、四轮的output滴度平板中挑取单菌落用异丙基-β-d-硫代半乳糖苷(IPTG)诱导表达,通过 ic-ELISA检测菌液上清。选取药物空白吸光值(OD450nm)大于0.5,且杀螟硫磷抑制率(100 ng/mL)超过 50%的候选克隆进行基因测序。
1.3.4 杀螟硫磷纳米抗体的制备及定向生物素化
从E.coliTG1中提取pComb3X-sm6表达载体作为模板,以F-SfiI和R1-SfiI为引物PCR扩增sm6-SfiI基因。扩增得到的sm6-SfiI基因和pINQ载体分别用SfiI限制性核酸内切酶进行酶切,T4连接酶进行连接,得到pINQ-sm6表达载体。将pComb3X-sm6表达载体转化到E.coliBL21内,在氨苄西林培养基(LB-Amp)中培养至对数期,加入IPTG(1 mmol/L)诱导表达过夜;将pINQ-sm6表达载体转化到含有携带BirA基因的PCY216载体的E.coliBL21内,在含有卡那霉素、氯霉素、阿拉伯糖和生物素的LB培养基中培养至对数期,加入IPTG(3 μmol/L)诱导表达过夜[27]。诱导表达后离心收集细胞,用PBS分散细胞后用高压破碎仪破碎细胞。由 pComb3X表达的 Nbsm6可直接用Ni-NTA纯化;由pINQ表达的抗体37 ℃震荡2 h进行生物素化后,用 Ni-NTA纯化生物素化纳米抗体(Nbsm6-bt)。
1.3.5 纳米抗体生物素化前后 ic-ELISA灵敏度比较
将纯化得到的杀螟硫磷纳米抗体及生物素化纳米抗体用于ELISA方法建立,具体步骤如下:将杀螟硫磷检测抗原用碳酸缓冲液稀释后加入酶标板中(100 μL每孔),4 ℃孵育过夜,用PBST洗板后用蛋白封闭液封闭。将杀螟硫磷纳米抗体和生物素化纳米抗体用PBS稀释至工作浓度,并将50 μL抗体工作溶液与50 μL不同浓度杀螟硫磷标准溶液在微孔中混合(n=3),室温孵育30 min,然后洗板5次。用PBST稀释rabbit-antiVHH-HRP二抗以及SA-HRP,分别加入孵育杀螟硫磷纳米抗体及生物素化纳米抗体的微孔中(100 μL每孔),37 ℃孵育30 min,洗板5次。加入四甲基联苯胺(TMB)显色液,37 ℃孵育10 min,加入10%硫酸(V/V)终止反应,用酶标仪测450 nm吸光值(OD450nm)。抗原抗体最佳工作浓度通过棋盘滴定法测定,在优化的抗原、抗体浓度下比较两种抗体ELISA的IC50。
1.3.6 方法特异性
采用 ic-ELISA分别绘制杀螟硫磷结构类似物的标准曲线(甲基对硫磷,对硫磷,毒死蜱,喹硫磷,甲基嘧啶磷,马拉硫磷,2-硝基甲苯,3-甲基-4-硝基苯酚),得到每种结构类似物 IC50值,通过式(1)计算各结构类似物与抗杀螟硫磷纳米抗体的交叉反应率,以评价其特异性。

1.3.7 实际样品检测
样品前处理方法参考GB 23200.113-2018进行:白菜、生菜去除根部,橘子去柄后,分别打成匀浆,准确称取10 g样品于50 mL离心管,加入10 mL乙腈、4 g硫酸镁、1 g氯化钠、1 g柠檬酸钠、0.5 g柠檬酸氢二钠以及1颗陶瓷均质子,震荡1 min后4200 r/min离心5 min。吸取6 mL上清液到15 mL塑料离心管中,加入885 mg硫酸镁、150 mg乙二胺-N-丙基硅烷化硅胶(PSA)及15~45 mg石墨化炭黑(GCB),涡旋混匀1 min,4200 r/min离心5 min。净化后的样品用PBS稀释后直接用于ic-ELISA检测。
1.3.8 数据处理
免疫进程中羊驼血清抑制率通过式(2)计算。杀螟硫磷抑制曲线通过origin软件拟合:以药物浓度的对数值为横坐标,对应的值(B)与药物空白吸光值(B0)的比值(B/B0)为纵坐标绘制散点图,通过Logistics函数拟合抑制曲线。

2 结果与分析
2.1 羊驼免疫及纳米抗体基因文库构建
如图1所示,杀螟硫磷半抗原结构由实验室前期工作合成[26],其结构如(a,左)所示。半抗原与EDC、NHS在N,N-二甲基甲酰胺(DMF)中形成活泼酯(a,右),将活化后的半抗原与乳铁蛋白(LF)在碳酸缓冲液(CB)体系中偶联,合成免疫原(b)用于羊驼免疫。羊驼免疫的进程中,随着免疫次数的增加,血清效价的抑制率逐渐提高,第三、四次免疫效果基本稳定,血清在1:8000倍稀释,100 ng/mL杀螟硫磷下抑制率在 83%左右(c)。因此选择第三第四次免疫的羊驼外周血进行淋巴细胞分离和基因文库构建。用pComb3X-VHH表达载体分多次电击转化合计0.5 mL的E.coliTG1,通过平板计数算得基因文库的库容量为107cfu数量级;随机挑选48个克隆测序,未发现重复序列,说明所得纳米抗体基因文库的多样性良好。经辅助噬菌体救援后,所得噬菌体文库滴度为 1012pfu/mL。
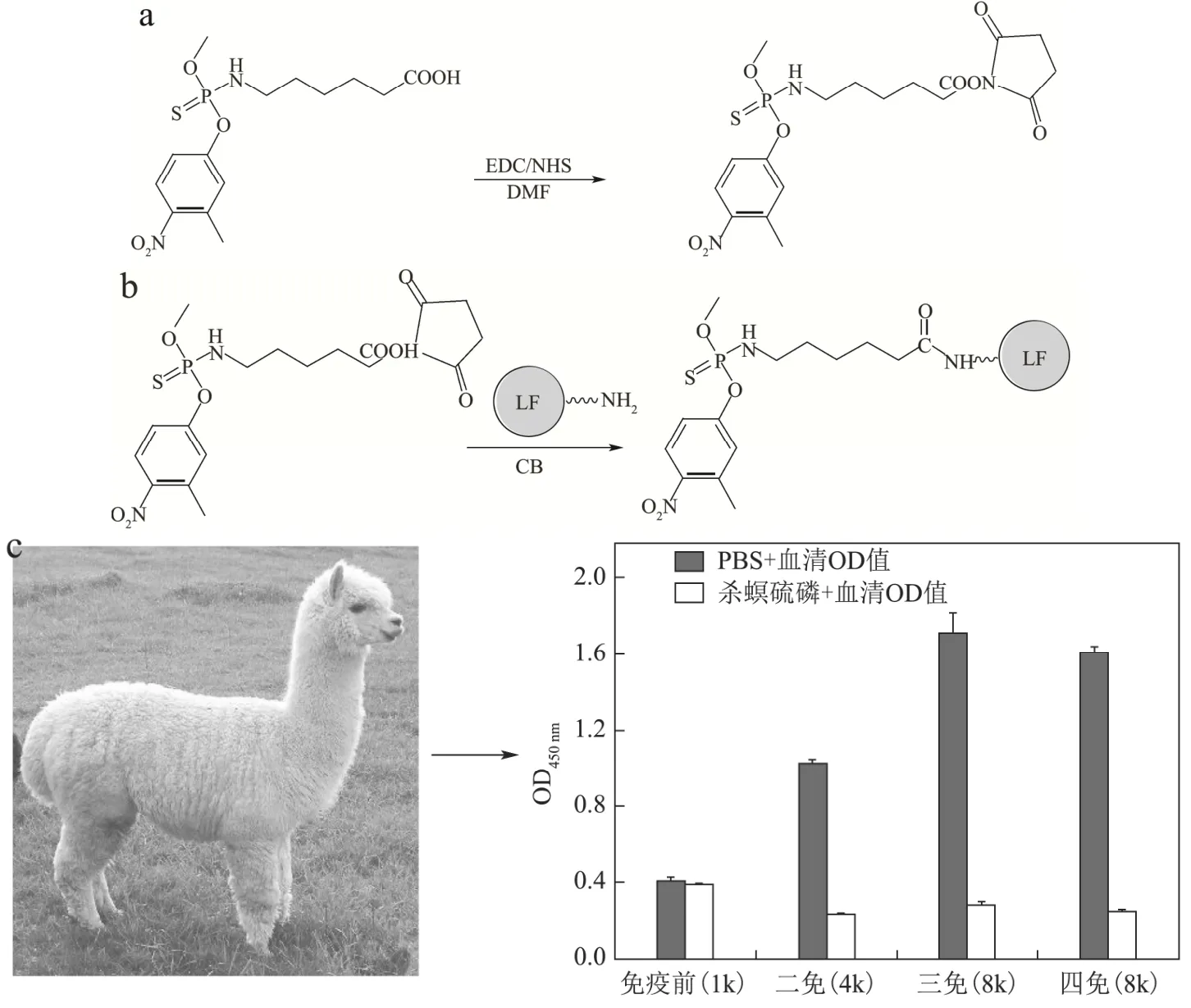
图1 人工抗原制备及羊驼免疫进程中血清效价和抑制率变化Fig.1 Preparation of artificial antigen and changes of serum titer and inhibition rate during immunization in alpaca
2.2 杀螟硫磷纳米抗体的淘选
采用固相吸附法对噬菌体文库进行4轮淘选。淘选原理为:噬菌体展示库中具有抗原结合活性的克隆先与固定化抗原充分结合,然后洗涤微孔弃去非特异性的克隆或结合力较弱的克隆;用酸性洗脱液使阳性克隆脱离固定化的抗原并及时中和洗脱液酸洗,以免噬菌体因衣壳蛋白过度变性而丧失侵染能力;然后往中和的洗脱液中添加杀螟硫磷,再重新投入固定化抗原微孔中,使游离的杀螟硫磷和固定化抗原同时竞争抗体结合位点,抑制率较低的克隆倾向于与固定化抗原结合,抑制率较高的克隆则主要在液相[27]。
每次投入的噬菌体滴度均为1012pfu/mL,第一、二轮淘筛得到的output噬菌体滴度为105pfu/mL,第三、四轮淘筛得到的噬菌体滴度为106pfu/mL,说明噬菌体文库在第三、四轮发生了富集。通过ic-ELISA检测96个随机克隆表达的蛋白活性,结果有40个克隆符合1.33所述候选克隆条件。经过基因测序40个阳性克隆可划分为9种不同的纳米抗体序列,分别编号为 Nbsm1~Nbsm9,将 9种阳性克隆转化至E.coliBL21(DE3)中表达纳米抗体,用ic-ELISA绘制标准曲线,Nbsm6的IC50值最小(图2),用于后续杀螟硫磷分析方法研究。
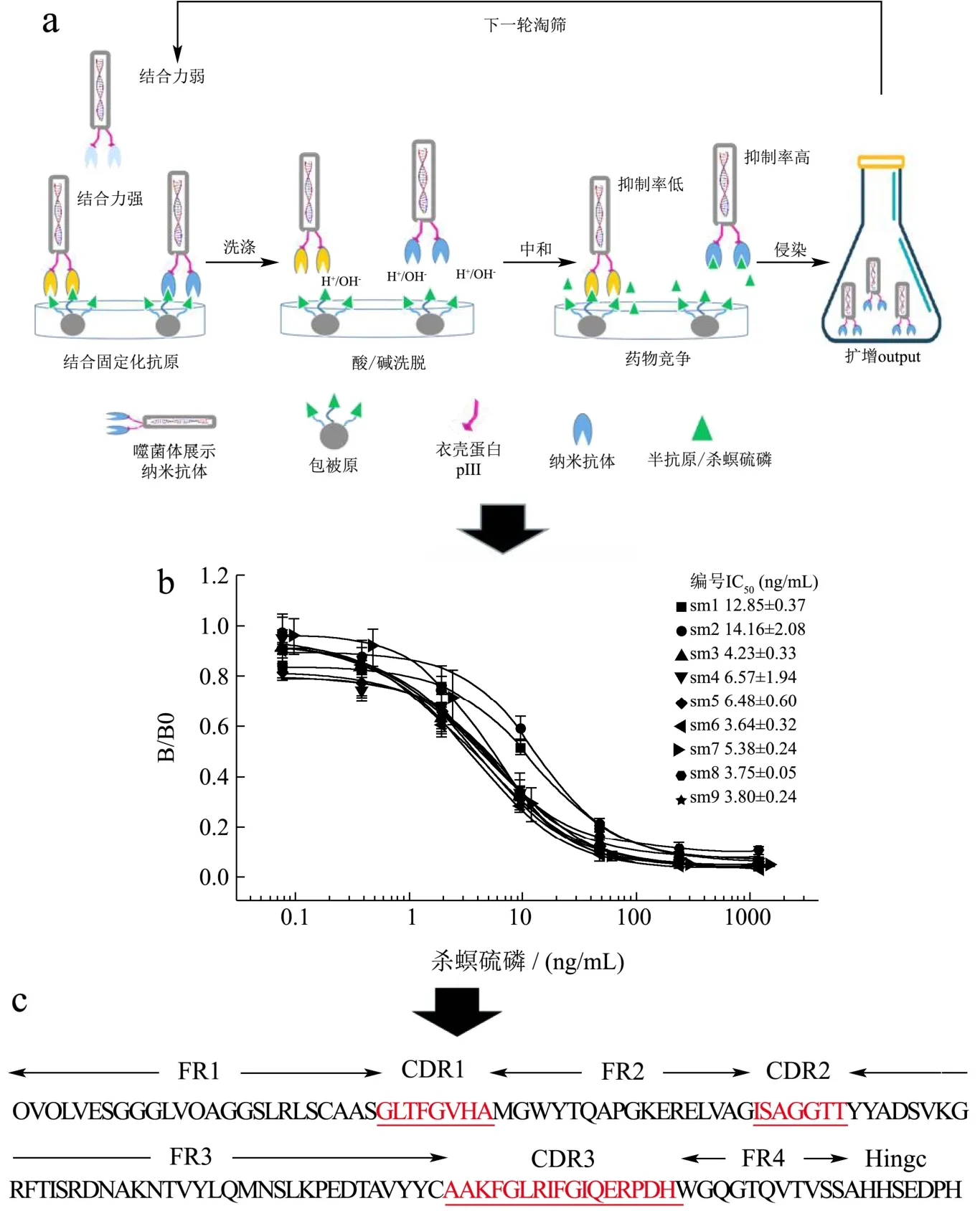
图2 (a)纳米抗体淘筛原理;(b)淘筛所得纳米抗体灵敏度对比;(c)Nbsm6氨基酸序列(VHH部分)Fig.2 (a)Principle of Nbs panning; (b) Comparison of sensitivity of obtained Nbs; (c) Amino acid sequence of Nbsm6 (VHH fragment)
2.3 定向生物素化纳米抗体制备及 ic-ELISA优化及灵敏度对比
生物素-亲和素系统是免疫分析法常用的信号放大技术。生物素与链霉亲和素之间的特异性结合亲和力可达到1015L/mol[28],远高于酶标二抗与抗体的亲和力,利用SA-HRP代替酶标二抗可以提高抗体效价、从而提高灵敏度。制备生物素化抗体的一般是通过NHS活化的生物素与抗体偶联,这种化学偶联方式具有一定的随机性,批次差异较大,如果生物素化位点在抗原抗体结合区还可能会导致抗体的活性下降[29,30]。因此本研究利用pINQ载体在Nb中引入一种由15个氨基酸残基组成的Avi短肽标签。在生物素连接酶的催化下,Avi标签的赖氨酸残基能够与生物素连接酶催化的生物素化反应条件温和、专一性高,且可以自主设计生物素化位点,能尽量降低对抗体天然构像产生的影响[31]。
两种载体表达的纳米抗体经SDS-PAGE验证(图3),Nbsm6分子量大小为18.6 ku,Nbsm6-bt分子量大小为19.5 ku。两种纳米抗体分子量的差异主要是由于两种载体的融合标签片段不同。由于纳米抗体表达后被转运到细胞周质,而生物素连接酶在细胞质中表达,因此需要将细胞破碎,使纳米抗体与生物素连接酶接触,才能保证生物素化顺利完成。
通过棋盘滴定法优化Nbsm6和Nbsm6-bt的抗原抗体工作浓度。经过优化,两种抗体均在500 ng/mL抗原浓度下半抑制浓度(IC50)值最小,其中 Nbsm6的工作浓度为 50 ng/mL,Nbsm6-bt工作浓度为 25 ng/mL,利用定点生物素化纳米抗体与链霉亲和素-HRP的信号放大策略后,在相同的抗原浓度条件下Nb工作浓度降低一倍。在优化后的抗原抗体工作浓度下建立两种抗体的标准曲线(图3),其中Nbsm6的IC50为4.0 ng/mL,与此前的表征结果基本吻合,在误差范围内,检出限(IC10)为0.8 ng/mL,线性范围为1.5~10.9 ng/mL;Nbsm6-bt的IC50为2.1 ng/mL,检出限为0.3 ng/mL线性范围为0.6~6.9 ng/mL,运用信号放大策略的ELISA方法灵敏度约提升为原来的2倍。
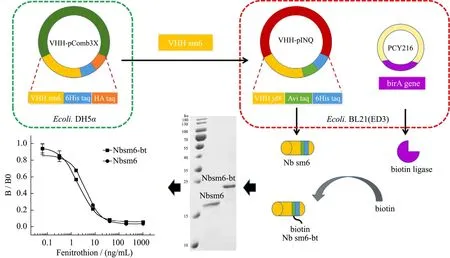
图3 定向生物素化杀螟硫磷纳米抗体制备及表征Fig.3 Preparation and characterization of oriented biotinylation anti-fenitrothion Nbs
本研究建立的基于定向生物素化纳米抗体的ELISA方法与已有报导的基于单克隆抗体或多克隆的抗体ELISA方法相比具有更高的灵敏度[18,32,33],与已报导的杀螟硫磷scFv灵敏度接近[21]。
2.4 方法特异性
用ic-ELISA鉴定Nbsm6-bt对几种结构类似物的IC50值,并计算与杀螟硫磷的交叉反应率。如表1所示,可能由于杀螟硫磷与甲基对硫磷架构极其相似,只有苯环上一个甲基的差别,因此甲基对硫磷有较高的交叉反应率,为 19.7%;对硫磷的交叉反应率为2.0%,其余结构类似物几乎没有交叉反应。已有报导的杀螟硫磷单克隆抗体多为广谱抗体,且检测杀螟硫磷灵敏度较低[17,18,34]。基于本研究制备的杀螟硫磷纳米抗体所建立的免疫分析方法在特异性检测杀螟硫磷方面更具有优势。
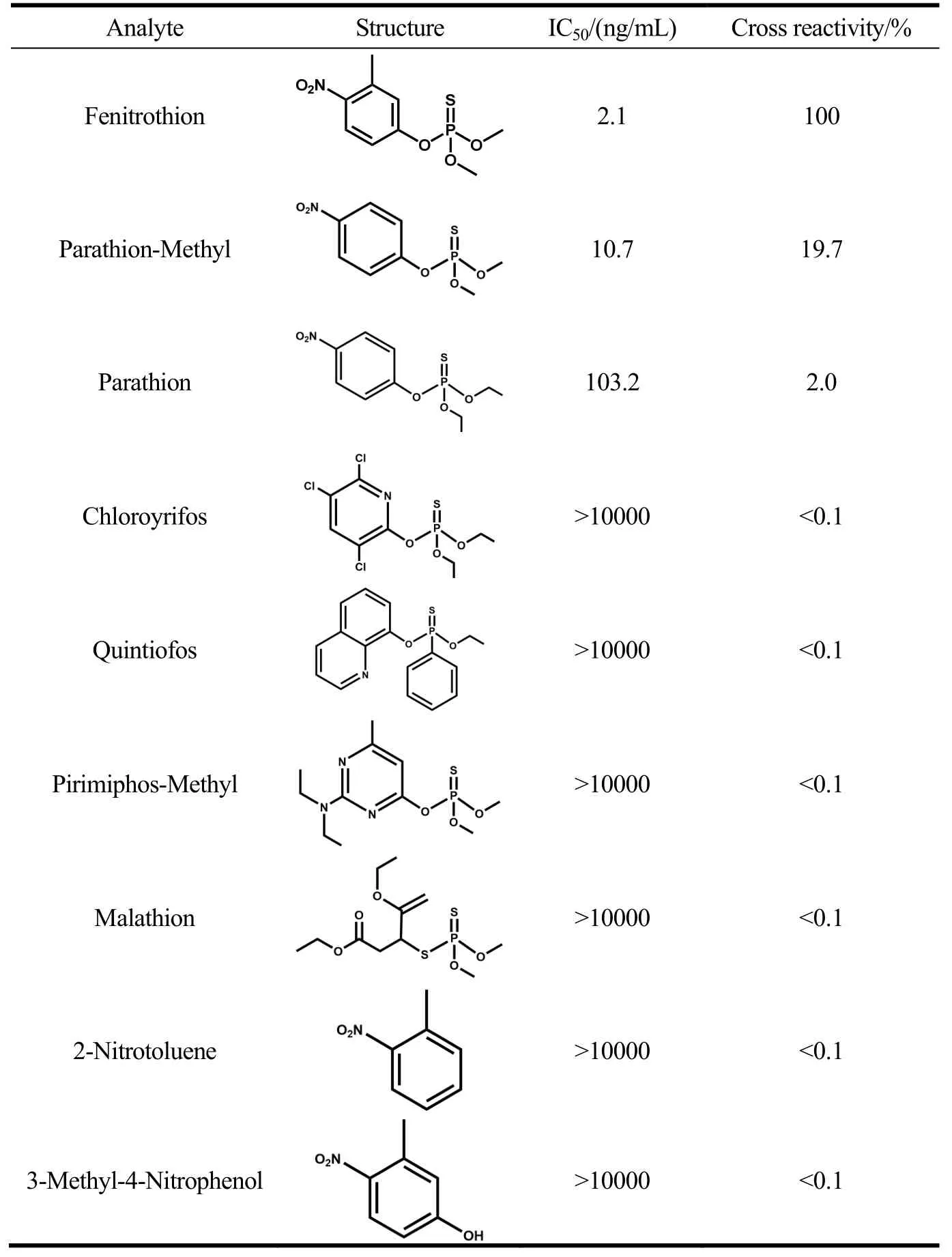
表1 icELISA检测杀螟硫磷结构类似物交叉反应Table 1 Cross reaction of analogue of fenitrothion detection using icELISA
2.5 样品添加回收
大白菜、生菜、橘子样品提取液经过QuEChERS净化后,为了简化前处理步骤、缩短检测时间,不经过氮吹复溶,直接用PBS稀释后进行ELISA检测。经稀释倍数优化发现,三种蔬菜水果样品提取液稀释20倍后标准曲线(◆)与PBS标曲(■)基本重合,而稀释2、5、10倍后的样品稀释液标曲与PBS标曲重合度差,会影响样品中杀螟硫磷定量效果,因此确定20倍稀释为消除基质效应的最小稀释倍数。检测线性范围为12~138 μg/kg,既可通过增大样品稀释倍数来满足国家标准GB 2763-2019中规定的500 μg/kg最大限量标准的检测,也能满足部分国家地区更严格的标准限量检测要求。
在样品中添加低中高三个水平的杀螟硫磷标准药物,采用上述的前处理方法处理样品,ic-ELISA检测样品中的杀螟硫磷,结果如表2所示,三种果蔬样品的回收率在88.9%~117.4%之间,变异系数(CV)值在6.2%~16.3%之间,说明方法准确性较高,误差在可接受范围。

表2 几种蔬菜水果样品添加回收实验Table 2 Additive recovery experiment of vegetable and fruit samples
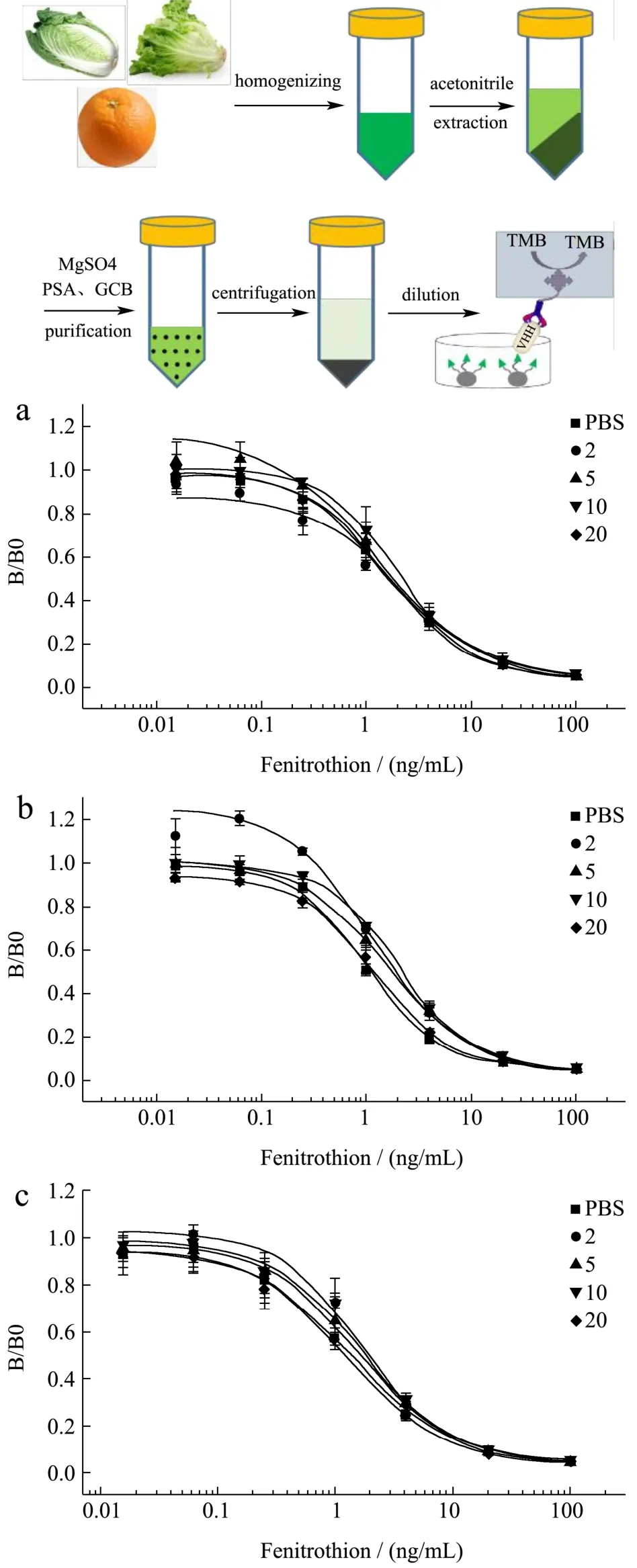
图4 基质效应的消除Fig.4 Elimination of matrix effect
3 结论
本研究报道了一种抗杀螟硫磷生物素化纳米抗体的制备方法及其在免疫分析方法的应用。相对于传统单克隆或多克隆抗体,纳米抗体在稳定性及批量制备等方面具有较好的优势。通过定向生物素化,可以避免化学方法生物素化带来的批间差异大、性能不均一等问题,解决后续应用存在方法稳定性较差等问题。基于生物素化纳米抗体建立的杀螟硫磷间接竞争ELISA方法,灵敏度高,因此样品前处理可以采用简单的稀释法来消除干扰,免去复杂的样品净化过程。综上所述,本文建立的及与生物素化纳米抗体的杀螟硫磷免疫分析方法具有灵敏度高、可靠性好、操作简便等特点,可作为食品中杀螟硫磷残留快速筛查的工具。
