隐球菌性脑膜炎感染后炎症反应综合征1例
2021-09-02符青青杨建花曾国勇
符青青 杨建花 曾国勇
隐球菌性脑膜炎是一种严重的中枢神经系统真菌感染性疾病,常见于合并获得性免疫缺陷综合征等免疫功能缺陷疾病患者。近年来,关于免疫功能正常个体患隐球菌性脑膜炎的报道逐渐增多,这类患者治疗过程中出现的感染后炎症反应综合征(cryptococcal-postinfectious inflammatory response syndrome,c-PIIRS)导致临床症状恶化,使得临床治疗更复杂、预后更差。现报告1例c-PIIRS的诊治和疾病演变过程,以期提高对c-PIIRS的认识,为隐球菌性脑膜炎患者临床管理提供帮助。
1 临床资料
1.1 发病情况患者,男,47岁,因“头痛、恶心呕吐 10 d”于2019年5月29日收入我院。患者10 d前无明显诱因出现头痛,以持续性前额部胀痛为主,头痛逐渐加重伴恶心呕吐,无发热,无肢体乏力、麻木,无意识障碍、大小便失禁等。既往史、家族史无特殊。
1.2 体格检查体温 37.0℃,脉搏 64次/min,呼吸 20次/min,血压 126 mmHg/86 mmHg,内科系统(-)。神经系统:神志清楚,言语清晰,高级皮层功能正常。颅神经(-)。四肢肌力、肌张力正常,深、浅感觉对称,共济运动检查协调,颈抵抗,颏胸距 4 横指,Kernig’s征阳性,双侧 Babinski’s征阴性。
1.3 辅助检查2019年5月29日血常规白细胞 9.61×109/L;C反应蛋白0.5 mg/L;腰穿脑脊液压力>400 mmH2O,糖0.09 mmol/L,蛋白定量 109.5 mg/dL,白细胞计数 24×106/L,脑脊液墨汁染色阳性,胶体金免疫层析法阳性。颅脑 MR提示脑实质未见异常,脑膜增厚强化(图2A、H)。胸部CT未见异常,血T-spot、结核抗体检测阴性。乙肝炎表面抗原、梅毒螺旋体抗体、HIV抗体均阴性。
1.4 诊断、治疗及随访根据患者临床症状、体征考虑颅内感染。结合脑脊液压力、蛋白、白细胞数明显升高,脑脊液葡萄糖明显降低,脑脊液墨汁染色、胶体金免疫层析法阳性,颅脑MR增强提示脑膜强化,胸部CT等检查排除结核杆菌感染,诊断为隐球菌性脑膜炎。2019年5月30日开始给予两性霉素B(小剂量递增至每天0.7 mg/kg)联合氟胞嘧啶(每天100 mg/kg,分4次口服)抗隐球菌治疗,每日腰穿释放脑脊液(20~30 mL)缓解颅内高压。患者头痛逐渐缓解,脑脊液指标改善(压力、白细胞数逐渐下降,葡萄糖逐渐上升,蛋白无明显变化)(图 1),脑脊液墨汁染色、脑脊液培养均阴性。但治疗第55天,患者开始出现低热(最高体温37.8℃),给予布洛芬对症处理,随后逐渐出现左侧肢体乏力(肌力4级)。第62天复查颅脑MR提示双侧额顶颞叶脑实质水肿,脑膜明显增厚强化(图2B、I),脑脊液指标开始恶化(压力、蛋白、白细胞数上升,葡萄糖下降)(图1),考虑为c-PIIRS,给予地塞米松10 mg静脉滴注,患者体温、左侧肢体肌力恢复正常,脑脊液指标再次改善(图1),第80天复查颅脑MR提示脑水肿范围缩小(图 2C),继续使用地塞米松治疗,第99天开始患者脑脊液墨汁染色多次呈阳性,遂停用地塞米松,加用伏立康唑抗隐球菌治疗,第115天复查脑脊液指标轻度恶化、颅脑MR提示部分病灶扩大(图 2D),加用泼尼松(10 mg)口服,患者症状逐渐改善,于第120天出院,继续口服氟康唑(400 mg/d)、氟胞嘧啶(每天 100 mg/kg,分 4次口服)、泼尼松(10 mg)治疗。第161、221、289天复诊查颅脑MR示病灶逐渐缩小至恢复正常(图2E~G),脑脊液指标改善,患者无头痛、发热、肢体乏力等症状,遂停用激素、氟胞嘧啶,继续口服氟康唑(200 mg)抗隐球菌治疗2个月后停药。随访至今患者无复发。
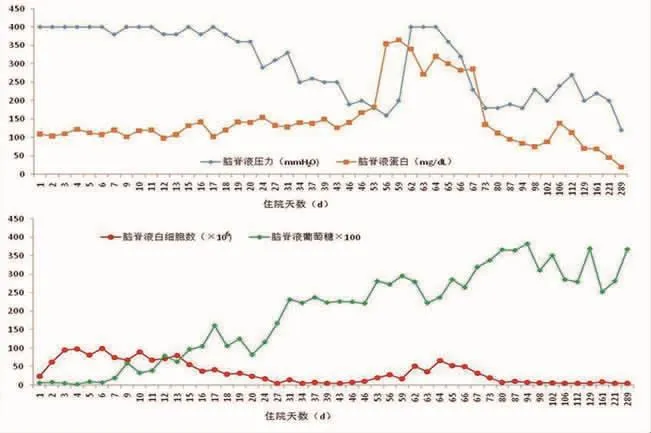
图1 治疗过程中脑脊液指标变化趋势

图2 治疗过程中颅脑MRI演变 A~G为治疗过程中颅脑MRI T2Flair脑实质病变演变过程;H、I为T1增强,提示脑膜强化。
2 讨论
近年来,免疫功能正常个体感染隐球菌性脑膜炎的报告逐渐增多[2]。不同于免疫功能缺陷患者,免疫功能正常个体感染隐球菌性脑膜炎症状更严重,治疗诱导期及治疗总疗程更长,而且死亡率更高,存活患者往往伴有严重神经功能后遗症[1-3]。其中一种解释为,毒力强的菌株才能突破免疫屏障导致免疫功能正常个体感染,因其毒力更强,引起的症状往往更严重,导致更高的致残、致死率[3]。另一种解释认为,症状严重程度与宿主免疫反应相关,约三分之一HIV阳性隐球菌性脑膜炎患者在抗逆转录病毒治疗(antiretroviral therapy,ART)后出现临床症状恶化[4-5],即免疫重建综合征 (immune reconstitution inflammatory syndrome,IRIS)。在免疫功能正常个体感染隐球菌性脑膜炎治疗过程中也观察到类似IRIS现象,被称为感染后炎症反应综合征(c-PIIRS)。
感染后炎症反应综合征是指发病前无免疫功能受损的健康个体感染隐球菌性脑膜炎后,在至少经过1个月的基于两性霉素B抗真菌治疗后,尽管脑脊液培养阴性,但由于增强的免疫反应导致临床症状恶化的临床综合征,常表现为低热、颅内压增高以及脑实质水肿等[6]。本例患者发病前无HIV、器官移植等免疫功能受损病史,治疗过程中对抗真菌治疗有效,经抗真菌治疗后脑脊液各项指标逐渐改善,但在55 d时出现低热,随后出现偏侧乏力,颅脑MR提示影像学恶化,同期脑脊液指标恶化,但脑脊液培养阴性,符合c-PIIRS诊断。
c-PIIRS的病理机制被认为是具有真菌清除作用的CD4+T淋巴细胞激活后引发免疫反应导致症状恶化,这一现象称为矛盾性免疫反应。研究显示,完整的隐球菌株受到免疫抑制性荚膜多糖的免疫识别保护,抗真菌治疗后隐球菌裂解释放隐球菌特异性抗原,进一步导致鞘内隐球菌抗原特异性CD4+T淋巴细胞激活[7]。研究显示CD4+T细胞激活明显晚于隐球菌负荷达高峰期,而是在抗真菌治疗真菌负荷下降后开始激活[8]。隐球菌抗原特异性CD4+T细胞激活后分泌INF-γ,具有抵御真菌感染作用,但同期脑脊液中发现神经丝轻链(神经损伤标志物)水平升高,加用INF-γ辅助治疗可导致临床症状恶化,提示CD4+T细胞激活可导致神经损伤进而引起临床症状恶化[9]。CD4+T细胞激活后,真菌负荷明显下降,然而死亡率明显增加,耗竭CD4+T细胞治疗影响了真菌清除却同时阻止了症状进展及死亡增加[8]。
由此可见CD4+T细胞激活在c-PIIRS中起关键作用。研究显示糖皮质激素通过糖皮质激素反应元件直接影响炎症介质的转录,增加抗炎介质转录,从而降低T细胞存活,进一步产生抗炎作用[10]。基于这一理论,当隐球菌性脑膜炎患者发生c-PIIRS时,使用糖皮质激素可以降低CD4+T细胞存活,从而产生抗炎作用逆转临床症状恶化,同时也可影响真菌清除。已有研究报告了激素治疗c-PIIRS的有效性[9,11-12]。然而,关于激素的使用时机、剂量及疗程、停药时机尚不统一。是否像结核性脑膜炎一样常规使用激素治疗尚不明确,但已有研究提示长期使用激素治疗可导致隐球菌性脑膜炎感染[13]。病例报告显示,泼尼松、地塞米松治疗c-PIIRS均获得了良好效果,治疗后1、2个月内逐渐减量并未出现病情复发,然而,一例患者症状改善后直接停用激素,导致了症状复发及后续更长时间的激素维持治疗[9,11-12]。本例患者使用地塞米松10 mg静脉滴注,临床症状明显缓解,但影响了真菌清除,出现脑脊液墨汁染色复阳。立即停用激素治疗后脑脊液指标及影像学再次恶化,加用小剂量泼尼松口服,患者症状改善,至脑脊液、影像学正常时停用激素,获得了较好临床疗效且未观察到疾病复发。因此,作者认为,诊断免疫功能正常的隐球菌性脑膜炎患者应密切监测病情,一旦发生c-PIIRS应立即启动激素治疗,激素治疗应逐渐减量而不能直接停用,临床症状缓解可作为激素减量依据,脑脊液及影像学恢复正常可作为激素停用指征。当然,激素在c-PIIRS的使用需要更多研究结果支持。
隐球菌是致死性脑膜炎的重要原因,免疫功能正常的隐球菌性脑膜炎患者抗真菌治疗后出现c-PIIRS导致疾病恶化,死亡率增加。激素在c-PIIRS治疗中已经显示临床疗效,但仍存在一定问题。首先,何时使用激素,是否常规使用激素尚不明确;其次,激素使用剂量、疗程,减量及停药指征不明确。所以,对激素治疗c-PIIRS的深入研究,必将有助于隐球菌性脑膜炎管理方案制定。
