氧化应激调控在CHO 细胞培养中的应用
2021-09-02孔倩倩陈飞白晓雨张娟
孔倩倩,陈飞,白晓雨,张娟*
(1.中国药科大学 生命科学与技术学院,江苏南京 211100;2.上海药明生物技术有限公司 细胞培养工艺开发部,上海 200131)
近年来,随着单克隆抗体(Monoclonal Antibody,mAb)市场规模的扩大,以全人源化抗体为主导,双特异性抗体(Bispecific antibody,BsAb)、抗体偶联药物(Antibody-Drug Conjugate,ADC)等改良型抗体先后问世,可有效治疗多种疾病[1]。哺乳动物细胞表达系统是生物制药的首选生产平台,能够提供特定的翻译后修饰,其表达产物在分子结构、理化性质和生物学功能方面最接近天然的高等生物蛋白质分子。由于具有可在无血清培养基中悬浮培养、被动物病毒污染风险低、较少分泌内源性蛋白且易于基因改造的特点,中国仓鼠卵巢(Chinese Hamster Ovary,CHO)细胞已作为治疗性蛋白生产的主要宿主细胞[2]。
正常细胞状态下,胞内代谢产生的活性氧(Reactive Oxygen Species,ROS)可 被 谷 胱 甘 肽(Glutathione,GSH)等抗氧化防御系统中和,维持氧化还原稳态。在CHO 细胞生产外源蛋白的过程中,高水平表达往往加剧培养过程中的氧化压力,不适当的培养条件和工艺控制条件则会进一步引起胞内ROS 和抗氧化系统失衡,从而导致氧化应激。氧化损伤严重时可导致凋亡、线粒体功能紊乱和内质网应激,影响细胞正常生理活动[3]。
因此,缓解细胞培养时出现的氧化应激,在改善生长代谢以及提高抗体产量方面具有重要意义。目前,基因工程、抗氧化型添加剂和培养过程控制是应用较为广泛的氧化应激调节手段,可有效减少ROS的产生或增强CHO 细胞抗氧化能力以维持氧化还原平衡。
1 哺乳动物细胞培养与氧化应激
1.1 活性氧及其来源

活性氧(ROS)是含氧且具有高度化学活性的几种分子的总称,主要包括超氧阴离子(O2-·)、羟自由基(OH·)等自由基分子,以及过氧化氢(H2O2)、单线态氧(1O2)等非自由基分子。ROS 作为信号分子,介导胞内许多生理过程[4]。在培养过程中,培养基中的物质还可以与O2、光照或其他成分相互作用而产生ROS[8]。例如核黄素对光敏感,光照下可产生大量ROS,培养基中存在色氨酸、酪氨酸、叶酸、吡哆醇时,还可以进一步促进核黄素产生ROS[9]。叶酸在光照和O2存在时降解,也可生成ROS[10]。且商业培养基中通常缺乏抗氧化剂,添加抗坏血酸、儿茶素等抗氧化剂时,也需考虑它们的稳定性,以及是否可与其他成分反应生成ROS[11-12]。
1.2 细胞内的抗氧化防御
细胞内的抗氧化防御系统包括酶类和非酶类抗氧化剂,可通过直接清除ROS、抑制ROS 产生或上调抗氧化能力等方式维持ROS 稳态。
酶类抗氧化剂又可分为一级和二级[13]。一级抗氧化酶可催化ROS 转化为更稳定的分子。例如,超氧化物歧化酶(SOD)通过还原催化O2-·歧化为H2O2,降低ROS 毒性;过氧化氢酶(CAT)可高效催化H2O2转变为H2O 和O2;谷胱甘肽过氧化物酶(GPX)利用GSH 作为还原剂,清除H2O2,还可催化脂质过氧化物转化为相应的醇[14]。二级抗氧化酶可与其他内源性抗氧化剂协同作用,间接中和ROS。例如,谷胱甘肽还原酶(GR)利用NADPH 作为还原剂,催化氧化型谷胱甘肽(GSSG)再生成GSH,维持胞内GSH 水平;葡萄糖-6-磷酸脱氢酶(G6PD)参与磷酸戊糖途径时,再生NADPH[13]。
上述大分子抗氧化酶是胞内ROS 清除的主要途径,同时也有小分子抗氧化剂,直接清除或作为酶系统的辅助因子参与维持氧化还原平衡。细胞内的非酶类抗氧化剂可根据溶解性分为两类:一类为水溶性,如GSH、抗坏血酸、半胱氨酸及金属结合蛋白等;另一类为脂溶性,如α-生育酚、辅酶Q 等[15]。他们与抗氧化酶共同作用,与细胞内的ROS 抗衡。
1.3 氧化应激的影响
细胞内ROS 生成增加或抗氧化能力降低,使平衡出现紊乱时,将引起氧化应激、氧化还原信号和控制中断和/或分子损伤。细胞培养时,培养基成分和高糖高氧环境可提高ROS 水平,培养体系恶化、内外源抗氧化剂耗竭也可降低细胞抗氧化防御能力[16]。
当氧化应激发生时,胞内抗氧化防御系统首先增强,通过清除ROS 拮抗氧化系统;但当氧化压力超出拮抗能力时,将引起DNA、蛋白质和脂质的氧化损伤,甚至细胞出现损伤。胞内过多ROS 会导致DNA碱基修饰或缺失、链断裂、双链畸变等形式的DNA 损伤,而后引发DNA修复、细胞周期延迟甚至细胞凋亡。其中,线粒体DNA 极易受到氧化损伤,且呼吸链产生的ROS 导致的线粒体DNA 损伤能反过来使呼吸链功能失效,进一步促进ROS 产生。ROS 可氧化修饰蛋白质中的半胱氨酸、色氨酸、酪氨酸等,介导肽裂解,引起蛋白质与脂质过氧化物反应形成交联,使其正常功能受损,或出现没有功能的堆积,进而导致细胞损伤。ROS 还可攻击生物膜中的不饱和脂肪酸,促使其氧化或过氧化,生成脂质过氧化物,使生物膜的流动性降低,最终改变膜通透性、膜受体、膜蛋白酶和离子通道活性,影响众多生物学功能[4]。
ROS 导致的氧化应激是造成细胞凋亡的重要环节,可通过内质网应激(ERS)反应途径、丝裂原活化蛋白激酶(MAPK)通路、核因子(NF-kB)通路、Caspase 和Bcl-2 家族等机制使细胞凋亡。在培养过程中,上述生物大分子氧化损伤严重时,将导致线粒体功能紊乱和代谢效率降低,且影响蛋白质稳态和结构修饰,对细胞生长代谢和蛋白产量质量不利。
2 基因工程
运用基因编辑和基因干扰等技术,减少产生ROS的代谢活动或增强细胞抗氧化防御能力,理论上可以缓解培养过程中出现的氧化应激。但通过调控相关基因减少ROS 生成,可能影响细胞代谢产能、蛋白质折叠等基本生理过程,不利于实际生产。因此,通常运用基因工程提高细胞抗氧化能力。
最初,研究者在CHO 细胞中表达hMn-SOD[17]和hGR[18],明显提高了细胞对氧化损伤的抵抗能力。有研究在CHO 细胞中过表达牛磺酸转运蛋白(Taurine Transporter,TAUT),发现GSH 的前体谷氨酰胺消耗增加,认为TAUT 提高了胞内GSH 水平而缓解了氧化损伤及凋亡,有效延长培养时间并使单抗产量提高近50%[19]。通过代谢组学[20]和蛋白质组学[21]分析发现,高产CHO 细胞表现出更高的GSH含量。在此基础上,研究者建立稳定表达谷氨酸半胱氨酸连接酶(Glutamate Cysteine Ligase,Gcl)两种亚基的CHO 细胞系以增加GSH 合成,发现过表达其修饰亚基Gclm 可提高70%单抗产量,而过表达其催化亚基Gclc 虽产生更多GSH,但未提高单抗产量[22]。还有研究者采用蛋氨酸磺基肟(Methionine Sulfoximine,MSX)和丁硫氨酸-亚砜胺(L-Buthionine Sulfoximine,BSO)抑制GS-CHOKISV 细胞系的Gcl活性,单抗产量反而提高1 倍,可能由于GSH 耗竭促进了其从头合成途径,阻止细胞分裂并伴随着PDI/ERO1 维持在活跃的氧化态而促进蛋白合成[23]。最新研究发现,在CHO-DG44 细胞系中采用BSO 抑制Gcl 活性,使GSH 显著耗竭时,63 种蛋白质表达水平发生变化以适应氧化应激,细胞生长和生产下降[24]。尽管关于调控CHO 细胞GSH 合成途径的研究存在不一致的结果,但该方向依然为CHO 细胞改造提供了可行思路。
此外,一些转录因子、抗凋亡蛋白或miRNA 的研究也取得了成果。已知激活转录因子4(Activating Transcription Factor 4,ATF4)在调节氧化应激和内质网应激中发挥关键作用,在CHO 细胞中过表达ATF4 使抗体产量增加到2.4 倍[25]。将人葡萄糖调节蛋白78(GRP78)在CHO 细胞中过表达,在氧化应激和血清剥夺条件下,提高了活率和抗体产量[26]。使用miRNA 海绵耗竭miR-23,使CHO 细胞线粒体活性升高,抗氧化蛋白中TXNRD1 和PRDX6表达量升高,氧化防御能力增强,最终酶产量平均提高3 倍[27]。
上述通过改造与氧化应激相关的酶、转录因子或蛋白表达的研究,在减少细胞凋亡和提高抗体产量方面已有所突破。值得注意的是,抗氧化与调控凋亡和蛋白生产的关系十分复杂,也可能在不同选择系统的CHO 细胞中表现不同。并且这些改造大部分处于研究阶段,暂未运用于大规模生产,其工业化应用可行性仍需进一步评估。
3 抗氧化型添加剂
在培养过程中,环境恶化导致胞内抗氧化系统无法与大量产生的ROS 抗衡时,添加一些外源性抗氧化剂可清除ROS 或稳定培养基成分,有助于缓解氧化应激,改善细胞生长及生产。抗氧化剂可分为硫醇化合物、维生素、微量元素及螯合剂和多元酚类,它们在CHO 细胞培养中的作用见表1。
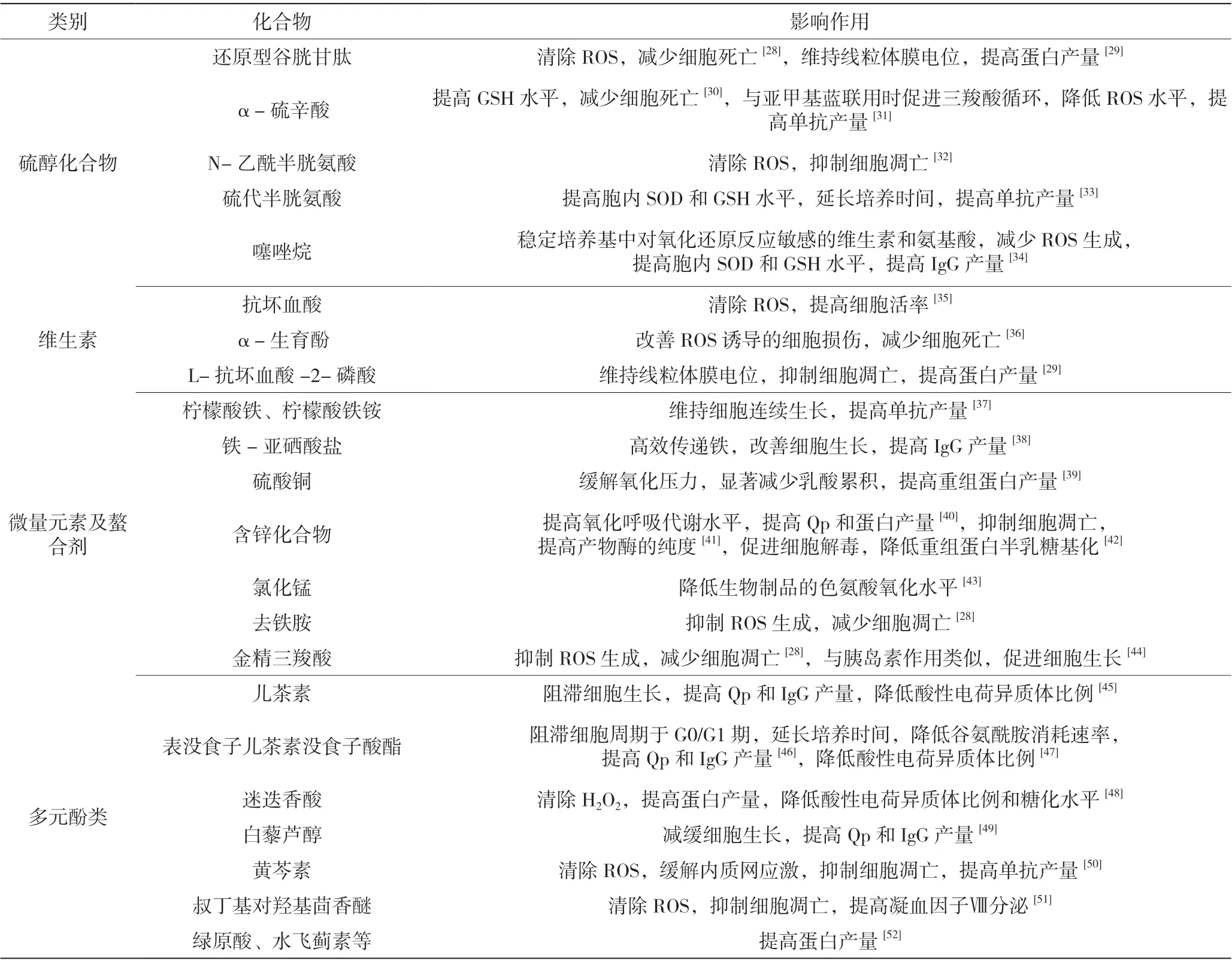
表1 CHO 细胞培养时添加的抗氧化剂及其作用
添加时需考虑抗氧化剂自身稳定性、是否可与培养基中成分反应生成ROS 以及培养基中成分配比,避免抗氧化剂浓度过高时转变为促氧化作用。
4 培养过程控制
除了运用基因工程和添加抗氧化剂外,培养时合理控制温度、pH、溶解氧含量(dissolved oxygen,DO)、二氧化碳分压(pCO2)、搅拌速率以及补料流加速率等工艺参数,使细胞维持良好氧化还原状态,也是改善生产的关键方面。
动物细胞开放培养通常在5% CO2环境中,氧压力高达150 mmHg,高O2水平会增加ROS 产生[16]。而实际大规模生产时,DO 值通常控制在20%~80%,一般不会出现高氧诱导ROS 大量生成,但随着细胞生长代谢,O2含量将大幅波动,且培养体积越大,培养基表面和下层细胞间的氧浓度梯度会越严重,甚至出现局部缺氧的状况[53]。研究发现,CHO 细胞在高氧压力下具有更高的GSH 水平,而氧压力过高时GSH 不足以抵抗氧化应激,细胞生长将受到抑制,且从缺氧到复氧状态,细胞对O2的敏感性增加[54],升高的O2水平又可引起细胞再氧化产生ROS[55]。此外,有研究发现,DO 值在20%~75%时,CHO 细胞生长状态相似,但胞内氧化还原和单抗产量差异显著;随着溶解的O2增加,胞内H2O2增加,而还原酶活性相似,胞内抗氧化机制难以控制氧化应激[56]。因此,考虑到氧含量对胞内氧化还原平衡的潜在干扰,需严格控制通气量和搅拌转速,维持培养体系O2均匀,并尽量降低剪切力造成的细胞损伤[2]。
葡萄糖是培养基中最主要的能源物质,浓度高时诱导胞内ROS 大量生成和细胞凋亡[57]。CHO 细胞培养时,应合理选择培养基和补料策略,严格控制体系中葡萄糖浓度,避免浓度过高引起乳酸累积或浓度过低影响正常代谢和蛋白糖基化。
研究显示,不同培养模式间也存在氧化压力的差别,灌流培养与补料分批培养相比,CHO 细胞在生长稳定期由重金属离子和线粒体产生的H2O2减少,GSH/GSSG 比例提高,维持了良好的氧化还原环境而有效减轻二硫键错配,最终表现为更高的活率和产量,以及更低的双抗聚集体[58]。
上述关于O2、葡萄糖浓度和培养模式的研究,再次强调了细胞培养过程中维持氧化还原稳态的重要性。
5 展望
目前,随着高细胞密度和高产量的CHO 细胞培养工艺发展,高水平代谢活动和副产物累积引起的氧化压力增加及其导致的氧化应激不容忽视。由于ROS 具有高反应性、动态性、空间分布复杂的特点,且胞内同时存在多种抗氧化物,不同部位的氧化还原能力与耐受能力也不同,在培养过程的动态环境变化下,难以精确监测ROS 水平。基因工程在提高细胞抗氧化防御能力、抗凋亡、调节代谢、提高蛋白表达和改善糖基化方面已有众多研究,但研究成果尚未得到全面的工业化应用。添加抗氧化剂可调控氧化还原内环境,但额外添加不一定有利,实际应用时需考虑细胞状态和培养基成分,以及这些试剂对培养基贮存、蛋白纯化分析、残留量检测等方面的影响。培养过程控制,尤其是保持合适O2水平,则在放大生产时充满技术挑战。
