岩藻多糖原料药多糖含量测定方法的研究
2021-09-02张海毅丛大鹏李广生都红芳
张海毅,丛大鹏,李广生,都红芳
(1.威海职业学院 康养学院,山东威海 264200;2.威海人生药业有限公司,山东威海 264200)
岩藻多糖又名岩藻聚糖硫酸酯,是一种具有多种生理功效的海藻活性物质。岩藻多糖在很多海藻中都能获得,且含量高、易提取、药理作用比较多,因此,有望被开发成为21 世纪的新药原料[1]。以泡叶藻为原料,经粉碎、提取、分离、浓缩、除杂和喷雾干燥等主要加工工艺,制得高纯度的岩藻多糖原料药(Active Pharmaceutical Ingredient,API),而多糖的含量测定是多糖类药物质量控制中考察产品内在质量的项目,也是考察药品稳定性的依据[2]。
测定多糖含量的方法主要有蒽酮-硫酸法[3-4]、苯酚-硫酸法[5-8]、Dische 比色法[9-10]、次甲基蓝比色法[11-12]和色谱法[13-16]等。其中,色谱法样品前处理工序比较繁琐,对仪器设备要求高,难以实现推广;比色法简单易行,成本低,在多糖含量测定中得到广泛应用[17]。中国药典规定海藻中多糖的含量测定采用蒽酮-硫酸法[18],而水产行业标准规定岩藻多糖的含量测定采用苯酚-硫酸法[19],目前尚缺乏标准的岩藻多糖原料药多糖含量的检测方法。预实验尝试采用蒽酮-硫酸法和苯酚-硫酸法对岩藻多糖原料药多糖含量进行检测,发现蒽酮-硫酸法测定结果远远低于苯酚-硫酸法,不能准确反映原料药的多糖含量。
研究表明苯酚-硫酸法测定多糖含量方法简单、灵敏度高、稳定性较好且不受蛋白质的影响,并且测定结果在60 min 内比较稳定[20-21],在测定多糖含量方面优于蒽酮-硫酸法[6,21-23]。因此,本文采用苯酚-硫酸法,按照《中国药典》相关规定,对岩藻多糖原料药中多糖含量的测定方法进行方法学验证,为岩藻多糖原料药多糖质量标准的建立和新药申报提供实验依据。
1 材料与方法
1.1 试剂及物料
苯酚(C6H5OH)、蒽酮(C14H10O),分析纯,国药集团化学试剂有限公司;硫酸(H2SO4),分析纯,三明市三园化学试剂有限公司;岩藻糖对照品C6H12O5,批号112014-201902,纯度95.9%,中国食品药品检定研究院;岩藻多糖原料药(批次分别为A-20190531-11-1、A-20190531-12-1、A-20200421-14-1),威海人生药业有限公司。
1.2 实验仪器
WH-3 型微型旋涡混合仪,上海沪西分析仪器厂有限公司;DF-101T 型集热式恒温加热磁力搅拌器,上海科升仪器有限公司;TU-1901 型紫外可见分光光度计,北京普析通用仪器有限责任公司;Multiskan FC 酶标仪,赛默飞世尔(上海)仪器有限公司。
1.3 实验方法
1.3.1 50 g/L 苯酚溶液的配制
称取苯酚100 g(精确至0.01 g),加铝片0.10 g和碳酸氢钠0.05 g,常压蒸馏,收集(180±2)℃馏分。称取该馏分5 g(精确至0.01 g),置100 mL 容量瓶中,加蒸馏水稀释至刻度,摇匀,过滤至棕色试剂瓶中,置4 ℃冰箱中贮存[6]。
1.3.2 对照品溶液的配制
称取岩藻糖对照品0.05 g(精确至0.0001 g),加少量水溶解,溶液转移至100 mL 容量瓶中,加水稀释至刻度,摇匀,置4 ℃冰箱中避光贮存。
1.3.3 重现性试验对照品溶液的配制
称取岩藻糖对照品0.02 g(精确至0.0001 g),加少量水溶解,溶液转移至100 mL 容量瓶中,加水稀释至刻度,摇匀,置4 ℃冰箱中避光贮存。
1.3.4 供试品溶液的配制
称取供试品0.01 g(精确至0.0001 g),用水溶解并定容至100 mL 容量瓶中,揺匀。
1.3.5 检测波长的确定
分别精密吸取对照品和A-20190531-11-1 供试品溶液1 mL 置比色管中,加入50 g/L 苯酚溶液1.0 mL,涡旋混匀,然后立即加入浓硫酸5.0 mL(与液面垂直加入,勿接触试管壁,以便反应液充分混合),涡旋混匀,沸水浴20 min,冷却至室温。另取蒸馏水同法操作作为空白对照,用紫外可见分光光度计在400 ~600 nm 范围内扫描获得吸收曲线,获得最大吸收波长。
1.3.6 多糖测定方法学验证
1.3.6.1 线性关系试验
精密吸取对照品溶液适量,加水逐级稀释,配制 成 浓 度 为0 μg/mL、25.0 μg/mL、62.5 μg/mL、125.0 μg/mL、250 μg/mL、375.0 μg/mL 和500.0 μg/mL的岩藻糖标准溶液。取1 mL 置比色管中,照“1.3.5”项下方法,自“加入50 g/L 苯酚溶液1.0 mL”起,同法处理,在最大吸收波长处用酶标仪测定吸光度。以吸光度为纵坐标,以对照品标准溶液质量浓度为横坐标,绘制标准曲线。
1.3.6.2 重复性试验
平行制备6 份A-20190531-11-1 供试品溶液,取1 mL 置比色管中,照“1.3.5”项下方法,自“加入50 g/L 苯酚溶液1.0 mL”起,同法处理,在最大吸收波长处用酶标仪测定吸光度。从标准曲线上读出供试品溶液中相当于岩藻糖的含量。
1.3.6.3 重现性试验
精密吸取重现性试验对照品溶液适量,加水逐级稀释,配制成浓度为0 μg/mL、22.0 μg/mL、65.0 μg/mL、125.0 μg/mL、150.0 μg/mL 和200.0 μg/mL的岩藻糖标准溶液。照“1.3.6.1”项下方法,自“取1 mL 置比色管中”起,同法处理,在最大吸收波长处由两名操作人员在不同实验室,用不同的仪器测定吸光度。以吸光度为纵坐标,以对照品标准溶液质量浓度为横坐标,绘制标准曲线。
平行制备两份A-20190531-11-1 供试品溶液,由两名操作人员在不同实验室,用不同的仪器进行测定,从标准曲线上读出供试品溶液中相当于岩藻糖的含量。
1.3.6.4 准确度试验
称取A-20190531-11-1 供试品0.01 g(精确至0.000 1 g),置100 mL 容量瓶中,制备9 份待用。分别精密吸取对照品溶液10 mL、20 mL、30 mL 置上述容量瓶中,进行低、中、高3 个水平的加标,每个浓度重复3 份,加水溶解并定容,揺匀。取1 mL 置比色管中,照“1.3.5”项下方法,自“加入50 g/L 苯酚溶液1.0 mL”起,同法处理,在最大吸收波长处用酶标仪测定吸光度,从标准曲线上读出供试品溶液中相当于岩藻糖的含量。
1.3.6.5 稳定性试验
平行制备两份A-20190531-11-1 供试品溶液,在室温下放置0 天、1 天、2 天、3 天后测定。取1 mL置比色管中,照“1.3.5”项下方法,自“加入50 g/L 苯酚溶液1.0 mL”起,同法处理,在最大吸收波长处用酶标仪测定吸光度,从标准曲线上读出供试品溶液中相当于岩藻糖的含量。
1.3.7 样品测定
照“1.3.4”项下方法制备供试品溶液,测定3 批岩藻多糖原料药供试品中多糖的含量,每批2个平行。取1 mL 置比色管中,照“1.3.5”项下方法,自“加入50 g/L 苯酚溶液1.0 mL”起,同法处理,在最大吸收波长处用酶标仪测定吸光度,从标准曲线上读出供试品溶液中相当于岩藻糖的含量。
1.4 数据处理
为保证数据的准确性,采用酶标仪进行实验,同一样品重复测量3 次,结果以平均值表示。
2 结果与分析
2.1 检测波长的确定
岩藻糖对照品和A-20190531-11-1 供试品经苯酚-硫酸法显色后,于400 ~600 nm 范围内扫描获得吸收曲线(图1)。结果显示,岩藻糖对照品在λ=478 nm 处有最大吸收(图1(b)),而供试品在λ=480 nm 处有最大吸收(图1(a)),两者最大吸收峰的波长非常接近,符合药典规定试样的最大吸收波长允许误差范围(±2 nm)[24]。考虑到对照品在409 nm 和440 nm 波长也有吸收峰,所以选择测定最大吸收波长为480 nm,其他方法学验证试验均在480 nm 波长处进行测定。

图1 岩藻糖供试品(a)和对照品(b)紫外扫描图谱
2.2 多糖测定方法学验证
2.2.1 线性关系试验
以吸光度A为纵坐标,以对照品标准溶液质量浓度C为横坐标,绘制标准曲线(见图2)。结果表明,岩藻糖含量在0 ~500 μg/mL 浓度范围内与吸光度呈现良好线性关系,线性方程为A=0.002C-0.005 7,相关系数R2=0.999 8。
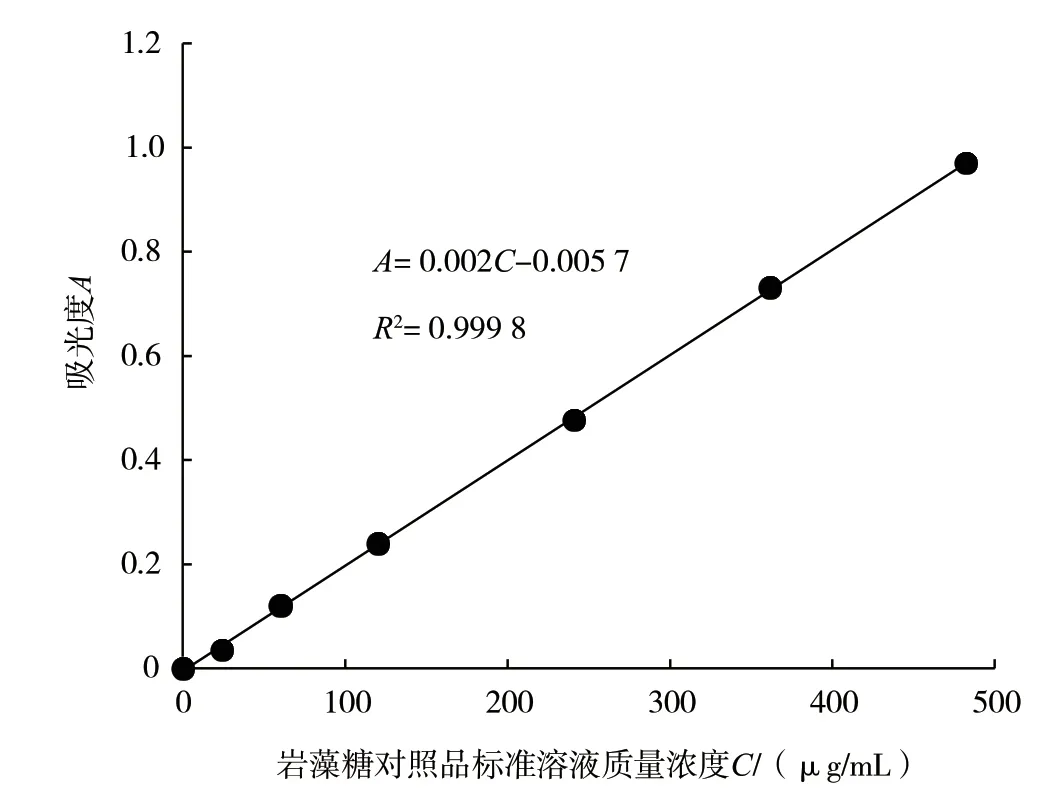
图2 岩藻糖含量与吸光度之间的关系
2.2.2 重复性试验
取A-20190531-11-1 供试品,平行进行6 次测定,计算RSD值,见表1。结果表明,供试品溶液平均多糖含量为87.30%,RSD值小于2.0%,表明该方法重复性良好。
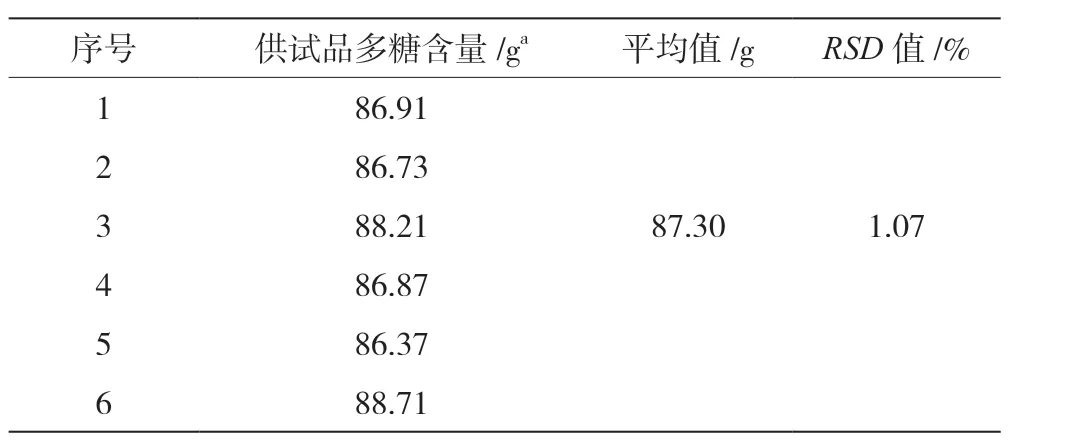
表1 重复性试验结果
2.2.3 重现性试验
取岩藻糖标准溶液和A-20190531-11-1 供试品,由2 名操作人员,在不同的实验室,用不同的仪器进行测定,结果见图3 和表2。
考虑到相同岩藻糖浓度下紫外分光光度计吸光度高于酶标仪吸光度,所以重现性试验标准曲线的绘制过程中,将岩藻糖标准溶液浓度范围缩小为0 ~200 μg/mL。从图3 可以看出,采用2 种操作方式进行试验,岩藻糖含量在0 ~200 μg/ml 浓度范围内均与吸光度呈现良好线性关系,R2≥0.999 8。供试品重现性试验结果表明(见表2),RSD值在4%以内,重现性良好。

表2 重现性试验供试品测定结果
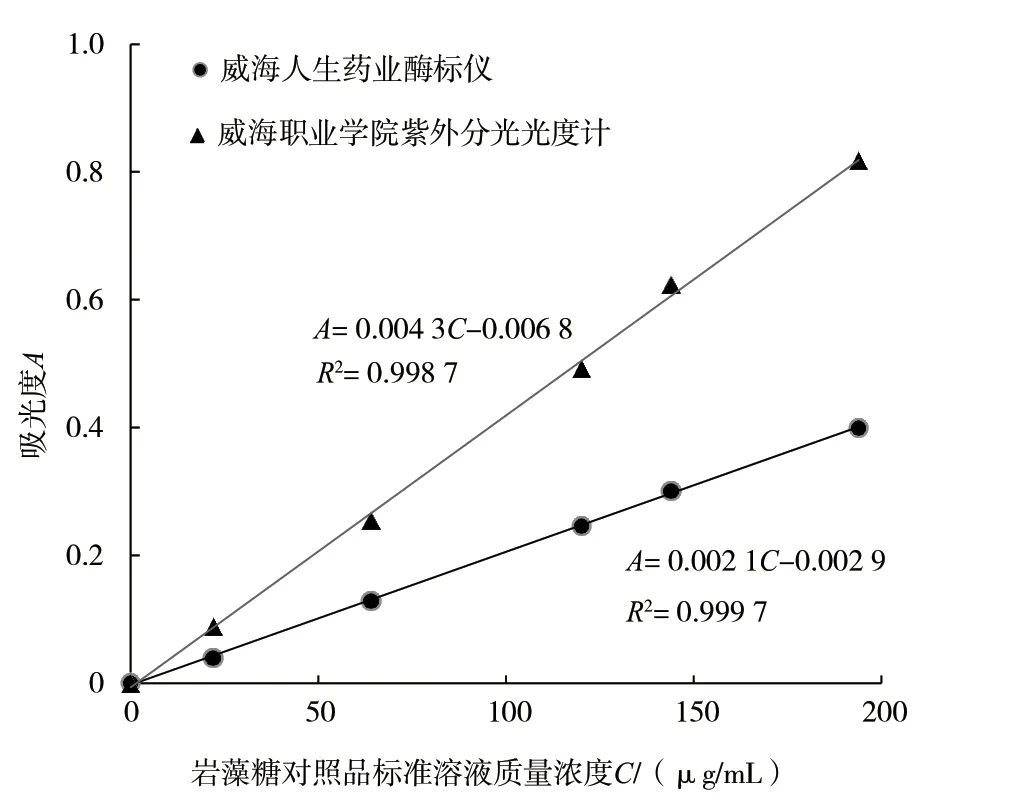
图3 重现性试验标准曲线比较
研究发现,紫外可见分光光度计和酶标仪在可见光区(400 nm 以上)的含量测定结果没有显著差异,在可见光区酶标仪是紫外分光光度计的理想替代工具[25]。由于岩藻多糖原料药供试品批次较多,酶标仪速度快,效率高,大大减少了劳动强度,所以在多糖含量的测定过程中均采用酶标仪进行检测。
2.2.4 准确度试验
准确度系指用所建立方法测定的结果与真实值或参比值接近的程度,一般用回收率表示。准确度试验结果见表3,供试品加样回收率均在95%~102%范围内,平均回收率为98.37%,RSD值小于2%,表明该方法回收率较好,准确度较高。
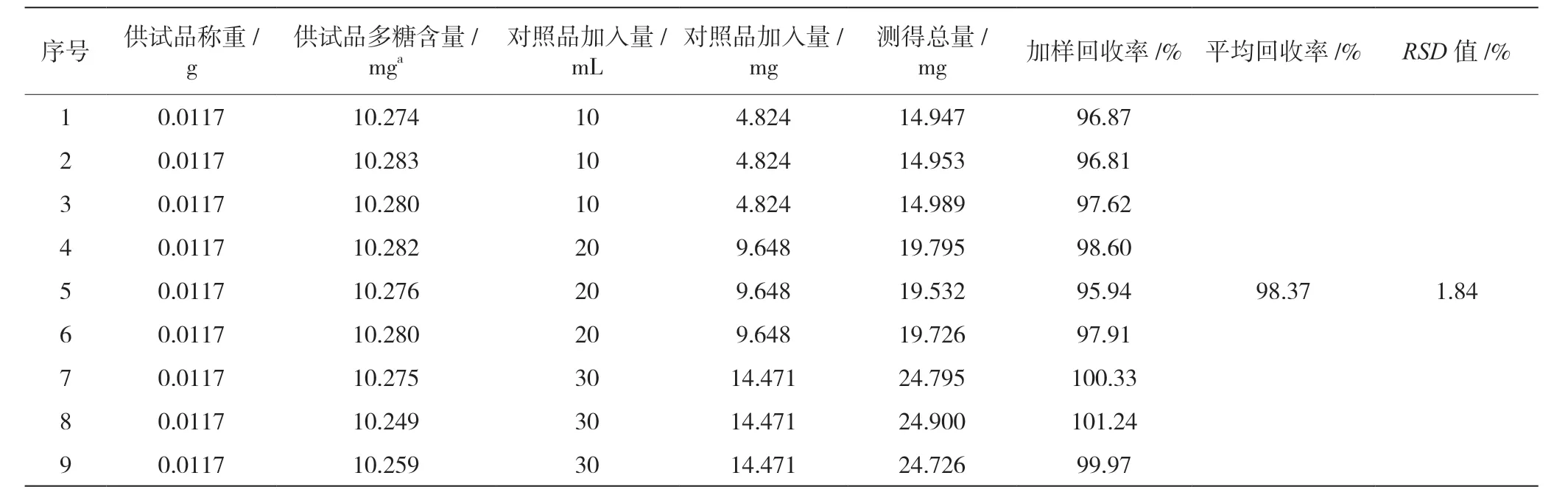
表3 供试品加样回收试验结果
2.2.5 稳定性试验
供试品溶液稳定性结果见表4,RSD值在2.0%以内,表明供试品溶液在室温下72 h 内稳定。
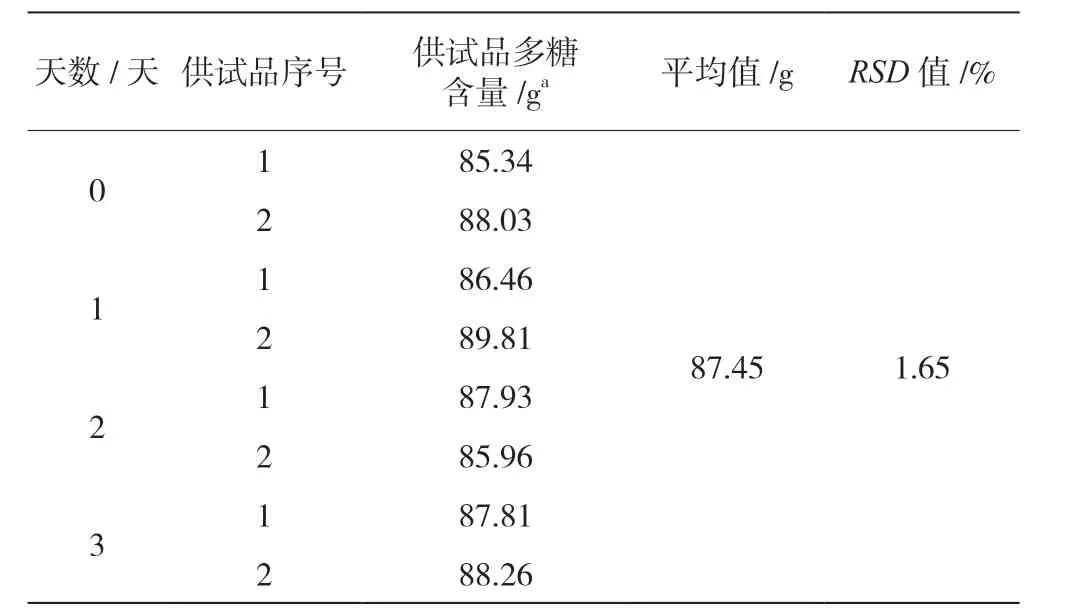
表4 稳定性试验结果
2.3 样品测定
取3 批岩藻多糖原料药供试品进行多糖含量测定,结果见表5。每批供试品测定相对偏差均小于5.0%,样品测定结果稳定。
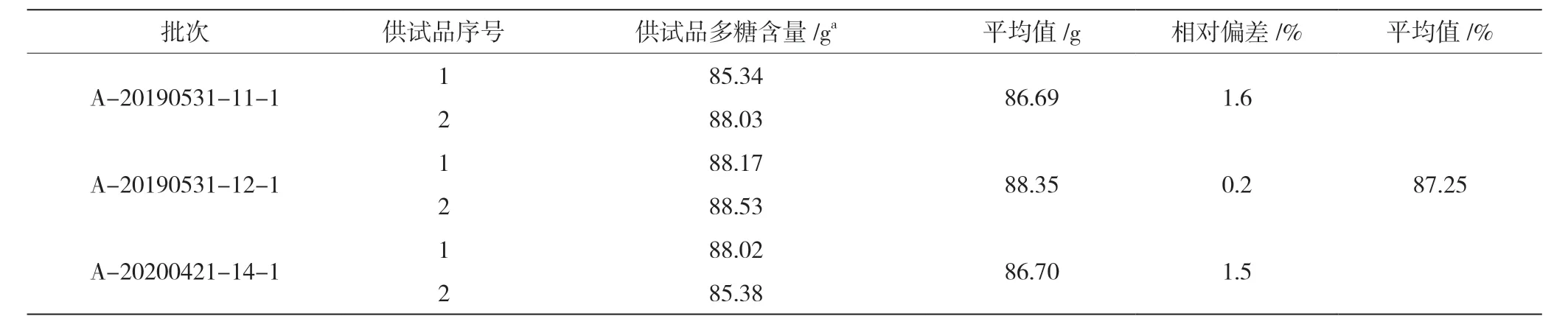
表5 供试品含量测定结果
3 结语
本研究参照《中国药典》(2020 年版)四部9101 分析方法验证指导原则,以岩藻糖为对照品,建立了酶标仪法测定岩藻多糖原料药多糖含量检测方法,并进行方法学验证。方法学验证结果表明,该方法线性关系良好,具有较好的精密度和稳定性,回收率较高,可准确、稳定的应用于岩藻多糖原料药多糖含量的检测,后续研究将对岩藻多糖原料药的单糖组成进行分析,为岩藻多糖原料药的质量控制提供有益的参考依据。
