高分辨率CT鉴别诊断良、恶性实性孤立性肺结节
2021-09-01段艳华宋学林王锡明
孔 芳,段艳华,宋学林,王锡明
(1.山东省泰山疗养院医学影像科,山东 泰安 271099;2.山东第一医科大学附属第一医院影像科,山东 济南 250013;3.山东省聊城市中医院医学影像科,山东 聊城 252003;4.山东第一医科大学附属省立医院医学影像科,山东 济南 250001)
肺癌发病率及死亡率较高[1]。孤立性肺结节(solitary pulmonary nodule, SPN)的CT密度不同,恶性程度亦不同[2]。多种良性病变如肺结核、错构瘤、支气管源性囊肿、肺内淋巴结等和恶性病变如转移瘤、肺癌、肉瘤、淋巴瘤等均可表现为实性SPN[3-4]。目前对于肺结节已有相应指南[5-6],但鉴别良恶性实性SPN仍是工作中的难点。高分辨率CT(high resolution CT, HRCT)可清晰显示SPN的细节特征[7]。本研究观察实性SPN的HRCT表现,评价其对鉴别良、恶性实性SPN的价值。
1 资料与方法
1.1 一般资料 回顾性分析2018年1月—2019年10月235例经胸部HRCT发现实性SPN患者。其中良性54例(良性组),包括2例真菌感染、3例支气管源性囊肿、6例慢性肉芽肿、11例慢性炎性变、4例肉芽肿并坏死(结核)、12例肺纤维组织增生、4例错构瘤、5例肺内淋巴结、1例硬化性肺泡细胞瘤及6例感染性病变;恶性181例(恶性组),包括136例肺腺癌、2例小细胞癌、37例鳞状细胞癌、2例B细胞淋巴瘤、3例类癌、1例肉瘤样癌。纳入标准:①病灶单发且直径≤3 cm;②恶性SPN均经术后病理诊断,良性SPN经术后病理明确诊断或CT随访6个月病灶有明显缩小趋势。排除图像质量差或病灶呈磨玻璃密度结节者。
1.2 仪器与方法 采用Siemens force、Siemens Definition Flash、GE Discovery HD750 CT、GE Lispeed 64排CT、TOSHIBA Aqilion ONE 640层螺旋CT、Philips Ingenuity 64排CT仪,嘱患者仰卧,扫描前行呼吸训练,于其吸气末屏气时扫描,范围自双肺尖至膈顶,管电流130 mAs,管电压100~140 kV,层厚5 mm;扫描结束后以高分辨骨算法及标准算法进行重建,重建层厚1 mm,层间距0.7 mm,并行多平面重组(multiplanar reformation, MPR)、最大密度投影(maximun intensity projection, MIP)及容积再现(volume rendering, VR)重建。
1.3 图像分析 由具有10年工作经验的主治及副主任医师各1名分别阅片,意见不一致时与另1名主任医师讨论决定,观察SPN外部结构、内部特征及与周围组织的关系,包括有无空洞征、远端穿行血管(于病变远端穿出的血管)、分叶征、血管集束征、牵拉性肺气肿征(病变周围存在形态、大小不一的无肺纹理含气区,可呈放射状排列)、空泡征、贴近胸膜(SPN紧贴胸膜但无胸膜牵拉并掩盖局部胸膜改变)、毛刺征、胸膜牵拉征及钙化。
1.4 统计学分析 采用SPSS 22.0统计分析软件。计量资料以±s表示,组间比较采用t检验。计数资料以频数表示,组间比较采用χ2检验。以病理结果为标准,计算差异有统计学意义的HRCT征象鉴别良、恶性SPN的敏感度、特异度、阳性预测值及阴性预测值。以Logistic回归分析观察良、恶性SPN的影响因素。P<0.05为差异有统计学意义。
2 结果
2.1 组间一般资料比较 良性组男24例,女30例,年龄34~75岁,平均(58.2±11.6)岁;结节最大径0.40~2.90 cm,平均(1.67±0.68)cm。恶性组男91例,女90例,年龄31~80岁,平均(60.8±10.3)岁;结节最大径0.70~2.80 cm,平均(1.54±0.62)cm。组间性别(χ2=0.57)、年龄(t=-1.41)及结节最大径(t=-0.97)差异均无统计学意义(P均>0.05)。恶性组结节多位于右肺上叶,良性组结节以左肺下叶多见(P<0.01),见表1。

表1 SPN组间不同位置比较[枚(%)]
2.2 HRCT征象 组间毛刺征、胸膜牵拉征及钙化差异均无统计学意义(P均>0.05),其余征象差异均有统计学意义(P均<0.05),见表2及图1~6。
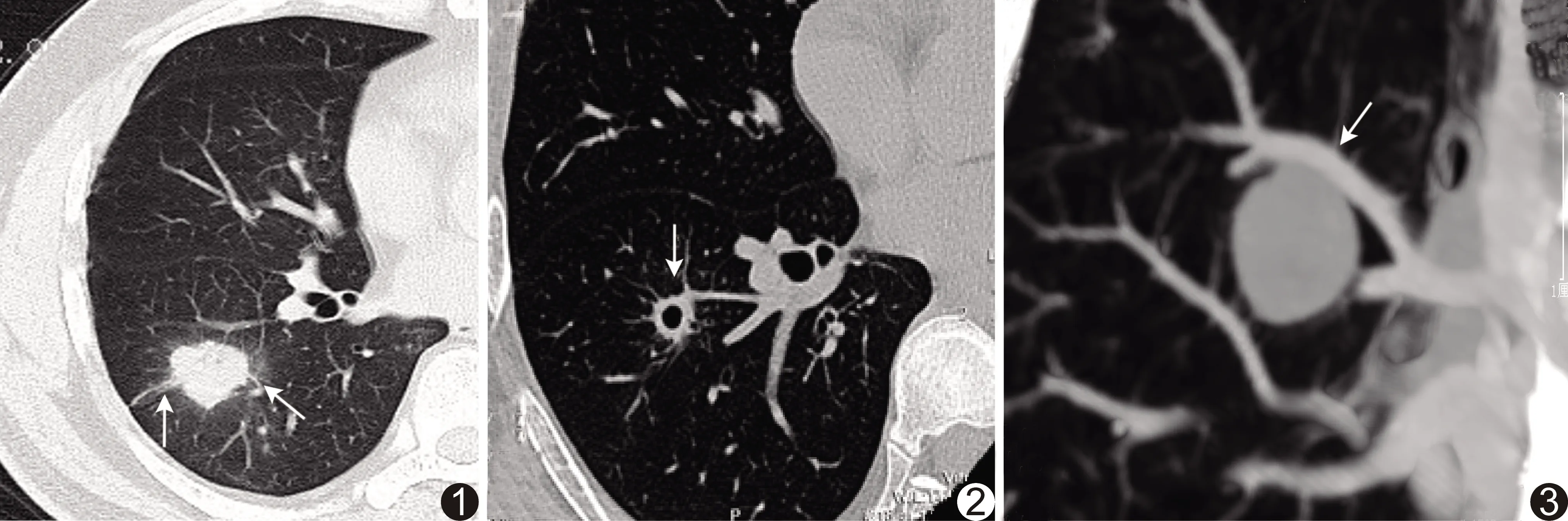
图1 患者男,56岁,右肺慢性炎性肉芽肿 HRCT示右肺下叶实性SPN边缘模糊,有长毛刺(箭),最大径2.60 cm 图2 患者男,44岁,右肺慢性炎性变 HRCT示右肺下叶见空洞性结节(箭),洞壁光整,厚度均匀,最大径1.10 cm 图3 患者男,53岁,右肺硬化性肺细胞瘤 HRCT示右肺上叶实性SPN,无分叶,血管贴近结节边缘(箭),最大径2.70 cm
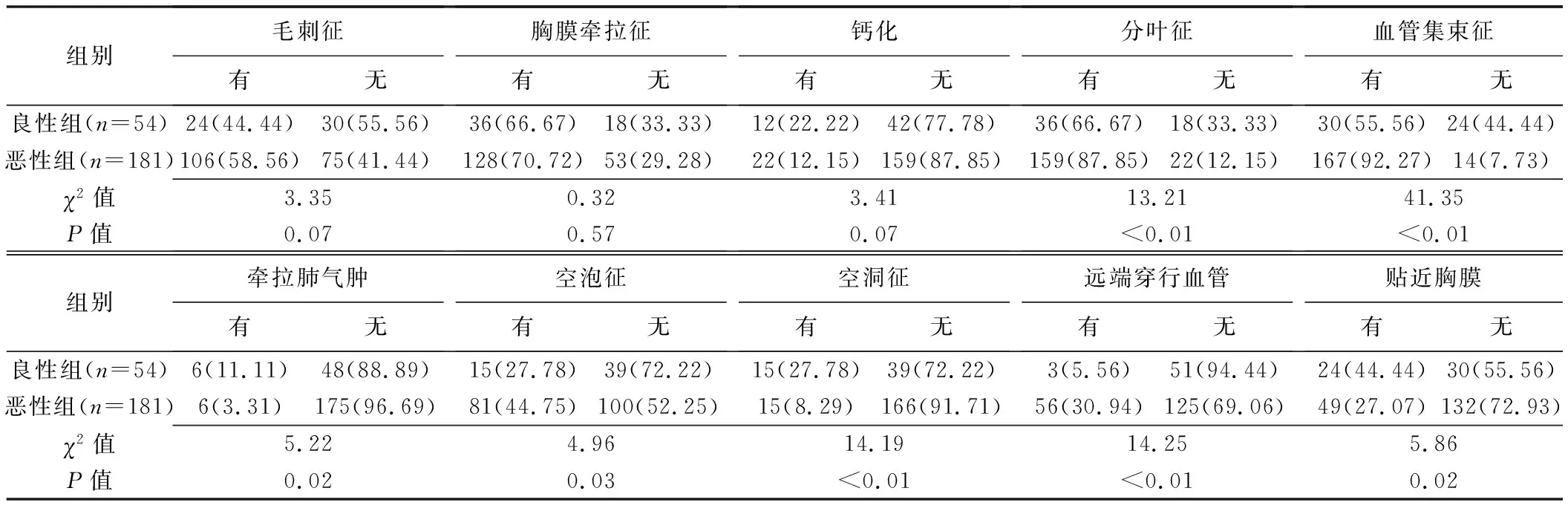
表2 组间HRCT征象比较[枚(%)]
2.3 鉴别效能 HRCT征象中,根据血管集束征鉴别良、恶性SPN的效能最高,敏感度达92.30%,见表3。
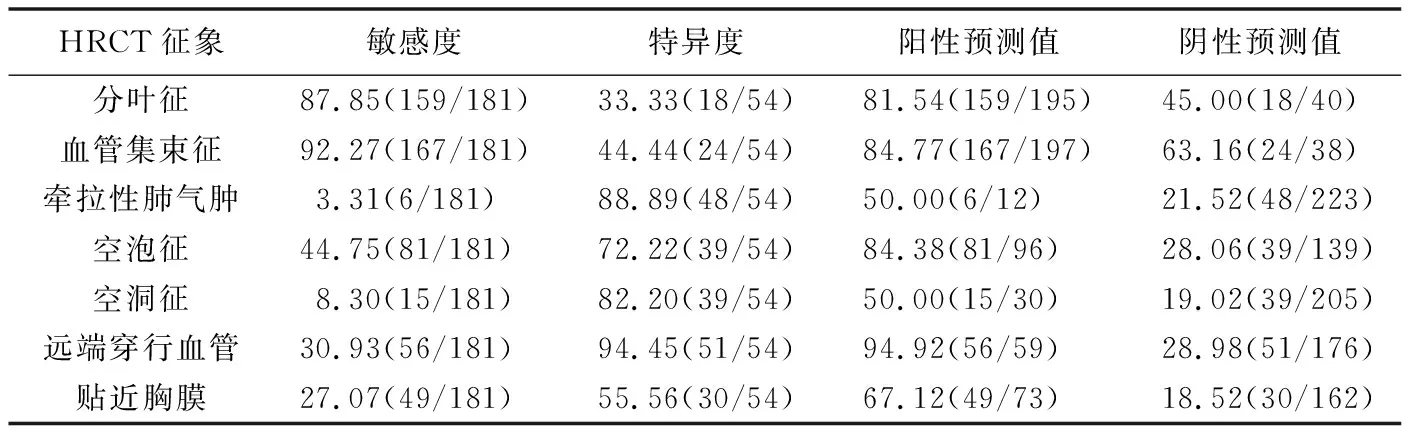
表3 各HRCT征象鉴别SPN良恶性的诊断效能[%(枚)]
2.4 影响因素 将上述HRCT征象纳入Logistic回归分析,结果显示血管集束征是恶性SPN的危险因素,而牵拉性肺气肿为恶性SPN的保护因素(P均<0.05),见表4。

图4 患者男,73岁,左肺高分化鳞状细胞癌 HRCT示左肺下叶SPN(箭),近端见血管,边缘见分叶,最大径1.20 cm 图5 患者女,57岁,右肺腺癌 HRCT示右肺下叶SPN(箭),最大径1.50 cm,近端血管增粗,边缘见短毛刺,其内见空洞,洞壁厚度不均 图6 患者女,63岁,左肺肉瘤样癌 HRCT示左肺上叶实性SPN,近端血管集束,边缘见分叶,远端胸膜牵拉(箭),最大径2.80 cm
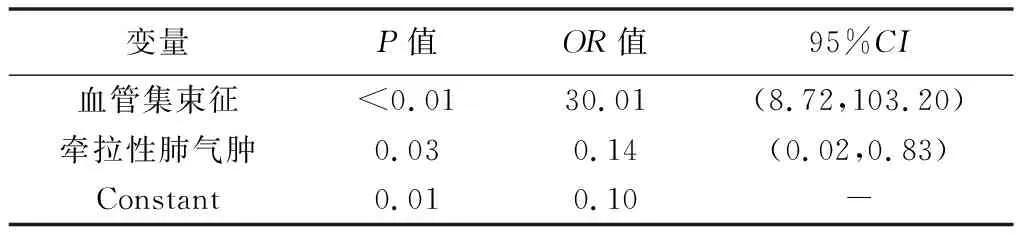
表4 影响良、恶性SPN的HRCT征象的Logistic回归分析结果
3 讨论
肺SPN指肺内无磨玻璃密度成分的密实结节,密度相对均匀,实性成分常掩盖其内的血管、支气管改变[8]。鉴别良、恶性SPN为影像学检查的重点及难点。相比混杂密度结节,实性结节中,良性者更多见[9]。
本组良性SPN多位于左肺下叶,恶性则以双肺上叶,尤其右肺上叶居多。KINSEY等[10]认为位于上叶是结节为恶性的独立危险因素,可能与肺上叶通气和灌注均较下叶为差有关。出现分叶征提示SPN恶性可能性大。本组66.67%良性SPN可见分叶征,分叶较大且分叶的弧度相对浅平;恶性组87.85%可见并以深分叶为主,且血管多位于分叶征的凹陷处。
肿瘤血管生成是肿瘤由惰性向恶性发展的体现,血管增粗则反映肿瘤增殖较快。供血血管及引流静脉均与肿瘤有一定相关性[11]。肿瘤组织生长代谢和需血量均高于正常组织,故其近端血管聚集、扭曲;呈膨胀性生长时,周围肺静脉会被卷入肿瘤内,导致近端血管增粗或出现集束征。本研究恶性组92.27%、良性组 55.56%见血管集束征,且30.94%恶性SPN可见远端穿行血管;而良性结节邻近血管多自然、平滑地绕行于病变边缘。本研究中血管集束征是SPN恶性的危险因素,据此鉴别良、恶性SPN的敏感度达92.30%,与马宁等[12]的结果基本一致。
空泡征有利于判断良、恶性结节,且空泡征多见于肺腺癌[13]。本研究恶性组中44.75%见空泡征,其对良、恶性SPN的阳性预测值为84.38%。空泡征在结构密实的恶性结节中发生率可能有所降低,但SPN可见长期存在且位置无变化的空泡多提示恶性肿瘤可能性大。
本研究良性组出现空洞征的概率大于恶性组。肺鳞癌存在空洞征的比例较高,且多为厚壁空洞,提示预后较差[14];肺腺癌空洞征发生率约3%~10%,多为薄壁空洞。
胸膜牵拉征反映病变与胸膜的关系。恶性肿瘤牵拉胸膜的病理基础是肿瘤破坏肺外周的肺泡间隔和小叶间隔,伴炎性细胞聚集,形成纤维瘢痕及向内收缩力;良性结节牵拉胸膜时不伴肺泡间隔和小叶间隔破坏。胸膜牵拉征在良、恶性肺结节中的发生率分别为20%及75%[15]。本组良、恶性SPN胸膜牵拉征发生率差异无统计学意义,可能与恶性组病变体积较小或肿瘤边界与胸膜距离较远有关。肿瘤体积越大,产生的收缩力越强,胸膜牵拉力越大,反之亦然。本研究良性组含5例肺内淋巴结及12例肺纤维组织增生,肺内淋巴结多位于胸膜下,肺纤维组织增生可能与胸膜下病变远离主支气管、引流不畅导致局部纤维蛋白沉积、机化并粘连有关,使良性组病变多贴近胸膜,组间SPN贴近胸膜征象差异有统计学意义。
牵拉性肺气肿常伴局部支气管扩张。良性肺结节纤维化过程中牵拉气管扩张,使气腔扩大,腔内、外压力共同作用形成牵拉性肺气肿,可见于肺内任何区域。本研究良性组牵拉性肺气肿征出现率高于恶性组,且Logistic回归分析显示SPN伴牵拉性肺气肿提示良性概率增加,该征象相对少见,诊断敏感度较低,但特异度可达88.89%。本研究组间毛刺征差异无统计学意义,可能与未对长短毛刺进行分组有关。
综上,良、恶性SPN的HRCT表现存在差异,对鉴别诊断具有一定价值。本研究的主要不足之处在于组间样本分布不均,可能导致结果存在偏差。
