脱氧雪腐镰刀菌烯醇及其衍生物检测 方法的研究进展
2021-08-31刘慧,吴颖,黄华
刘 慧,吴 颖,黄 华
(1.北京市产品质量监督检验院,北京 101300;2.中国农业大学食品科学与营养工程学院,北京 100083)
真菌毒素是真菌在适宜条件下产生的小分子次级代谢产物,绝大部分具有毒性。目前已知的真菌毒素超过300余种[1],据联合国粮食及农业组织统计,全球每年约有25%~50%的农作物会遭受真菌毒素的污染[2]。近年来, 由于气候变化和现代农业生产方式的改变,赤霉病已成为影响小麦等农作物生产的最为严重的真菌病害之一。研究表明,赤霉病的发生与单端孢霉烯族毒素含量高度相关[3]。该毒素主要由镰刀菌(Fusarium)产生, 基本结构为四环倍半萜,典型特征是C9与C10处具有化学双键,C12与C13处具有环氧化物[4]。根据其化学结构中取代基的不同,可分为A、B、C、D 4 种类型,其中B型单端孢霉烯族毒素是污染最为普遍的一种镰刀菌毒素[5]。
脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)属于B型单端孢霉烯族毒素,其化学名称为3α,7α,15α-三羟基-12,12-环氧单端孢霉-9-烯-8-酮,C8位置上有羰基[6],最早由日本学者Morooka等[7]于20世纪70年代在受镰刀菌感染的小麦等农作物中被发现并鉴定。DON理化性质稳定,在谷物磨粉、食品生产及日常食物烹调加工过程中均难以被破坏,还可在食物链中长期富集,因此DON会对人和动物产生广泛且明显的毒性效应[8]。研究表明,摄食被DON毒素污染的食物或饲料会引起生物体胃肠道和免疫系统功能损伤,诱发内分泌系统和神经系统的病变,对人类和动物健康造成极大的威胁。急性DON中毒症状主要表现为腹部不适,如恶心、呕吐、腹泻等,严重时甚至可能损害造血系统以致死亡;而长期低剂量接触可引起厌食症、生长迟缓、免疫失调、生殖和发育障碍等[9-10]。另外,DON及其衍生物还可以和其他真菌毒素如玉米赤烯酮等产生协同效应,加剧动物肝、肾脏细胞膜损伤和氧化损伤[11]。
DON可通过乙酰化、氧化、脱环氧化或糖基化反应降解成各种衍生物,这些衍生物又称掩蔽型DON,包括3-乙酰基-DON(3-acetyldeoxynivalenol,3-AcDON)、15-乙烯基-DON(15-acetyldeoxynivalenol,15-AcDON)、脱环氧DON(deepoxy-deoxynivalenol,DOM-1)、DON-3-葡萄糖苷(DON-3-glucoside,DON-3-Glc)和DON-3-O-葡萄糖醛酸(DON-3-glucuronide,DON-3-GlcA)等[12-16],其基本信息见图1。有研究表明,DON的各种衍生化产物对禾谷类农作物同样具有极强的污染性,15-AcDON是引起全球赤霉菌病的主要化学型[17]。尽管这些衍生物的毒性比DON本身低[18],但在目前的研究中也已将3-AcDON、15-AcDON、DOM-1和DON-3-Glc等衍生物共同视为DON检测项目中的靶标化合物[19-20]。 因此,寻找快速、灵敏和准确的检测技术以分析食品、饲料、人和动物体中DON及其衍生物的含量,对于暴露风险评估以及人们的饮食健康都具有十分重要的意义。本文综述了DON及其衍生物检测的常见技术,总结和比较了不同方法的原理及优缺点,并介绍了具有良好应用潜力的新兴方法,此外还讨论了与样品制备有关的实验细节,包括目标物的提取和净化,以期为DON及其衍生物检测方法的科学选择提供参考。
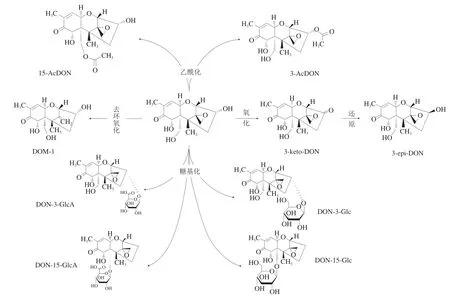
图1 DON及其衍生物的化学结构Fig.1 Chemical structures of DON and its derivatives
1 DON及其衍生物的提取与净化
1.1 提取
DON及其衍生物属极性化合物,通常选用极性溶剂如甲醇、乙醇、乙腈、水或极性溶剂的混合体系进行提取。溶剂体系中各溶剂的比例由DON的理化特性及所选的检测系统决定,DON提取常用的溶剂为乙腈-水的混合体系[17,21-22]。有研究报道,对于谷物样品,含0.1%甲酸-水/乙腈(43∶57,V/V)的萃取体系可以更好地回收DON[23];而对于血浆等样品,以一定比例的甲醇-水作为提取溶剂,回收效果更佳,回收率高达80%[24]。提取溶剂的用量一般按照样品质量的4 倍进行添加。样品加入提取溶剂后要通过机械振荡或漩涡充分混匀;而对于其他生物样品,尤其是尿液,由于样品中的葡萄糖醛酸化程度高,提取液中还需添加β-葡萄糖苷酶,然后再进行混匀。对于提取次数的确定,有研究比较了一次提取和多次提取的回收率,发现二次提取DON的回收率显著高于一次提取[25]。
1.2 净化
经溶剂提取后,DON及其衍生物还需要进一步的净化后再进行定性定量分析,目的是减少杂质对目标物的干扰。传统的液液萃取(liquid-liquid extraction,LLE)技术利用液体混合物中各组分在两相中溶解度的差异实现提取净化。根据相似相溶原理,乙腈/正己烷或甲醇/正己烷体系是常见的DON及其衍生物的萃取溶剂,可去除脂肪和蛋白质等杂质。LLE技术具有操作简单、易于实现等特点,但存在有机溶剂用量大、耗时、非特异性、目标物易流失、不能满足高通量检测需求等问题。随着净化技术的发展,固相萃取(solid-phase extraction,SPE)、多功能柱(multifunctional column,MFC)、免疫亲和柱(immunoaffinity colums,IAC)等被广泛应用于DON等真菌毒素的净化[26]。SPE技术基于液相色谱(liquid chromatography,LC)-固相色谱分离原理,目标物首先被吸附到合适的固体吸附剂上,然后通过淋洗使目标物与干扰组分分离,最后以合适的洗脱剂将目标物从固体吸附剂上解离下来,从而达到净化与富集目标物的目的。SPE技术具有操作简单、有机溶剂用量少、适用于多残留分析等优点,目前用于DON及其衍生物净化的SPE柱主要有硅胶柱、florisil柱、C8或C18反相SPE柱、离子交换柱等[17,27-31]。MFC是一种特殊的SPE柱,它以极性、非极性及离子交换树脂等作为复合吸附填料,基于多重吸附机制,快速且有选择性地吸附样品中的色素、脂类和蛋白质等杂质,而不吸附待测目标物,从而使样品得以净化。研究表明,MFC净化过程操作简单 快速,净化效果较好,尤其适用于谷物中DON及其衍生物的同步分析[32-33]。Berthiller等[34]检测了自然感染和人工接种感染赤霉病小麦中DON及DON-3-Glc的含量,样品提取溶液采用MFC柱净化,定容后再经0.45 μm滤膜过滤,该方法在DON-3-Glc加标0.15~1.20 mg/L时,回收率范围为57.9%~64.1%,平均回收率为(60±8)%。DON及其衍生物采用MFC法净化时,还可选用两种商品化柱,分别是Multisep®和Mycosep®,这两种柱子的净化原理都是基于填料吸附干扰组分而使目标物通过固相柱。IAC技术即利用免疫反应的高度特异性,以抗原或抗体一方作为亲和配基吸附另一方,从而使样品得到净化的分离体系[35]。Kostelanska等[36]采用专效净化DON的IAC柱(DONPREPTM)对啤酒样品进行净化处理,结果显示该IAC柱能够同时分离DON、DON-3-Glc和3-AcDON,且回收率较高。但是,DON及其衍生物的相对分子质量较小,属弱免疫物质,容易出现交叉反应,因此目前可供选择的商品化IAC种类十分有限[21,37],且IAC柱的价格也相对偏高,使其在实际应用中会受到一定的限制。
此外,有研究报道分子印迹聚合物(molecularly imprinted polymers,MIP)和免疫超滤(immune ultrafiltration,IUF)净化技术在DON检测中也显示出巨大的潜力。MIP通过引入目标物模板分子进行聚合,再对模板分子进行洗脱,这样会在聚合物中留下模板分子空穴结构和大小的“印迹”,这种“印迹”结构能够特异性识别目标物及其结构类似物[38]。因此,MIP具有较好的构效预定性和选择性,并且耐高温、酸碱和有机溶剂。与IAC技术相比,MIP方法更便宜、高效。在IUF方法中,超滤膜装置中膜的孔径足够小,可以保留抗体。具体操作过程是萃取混合液通过超滤膜,目标组分即与抗体相结合,然后淋洗去除未被结合的干扰组分,再通过添加有机修饰剂将抗原抗体复合物解离开,最后经离心将目标物质洗脱下来[39]。相较于IAC技术,IUF不需要固体支撑材料,使用起来更方便,同时它的高选择性可与IAC相媲美。
2 DON及其衍生物的检测方法
目前,对DON及其衍生物的检测技术主要包括免疫法、光谱法、色谱法和质谱法等,这些技术又可进一步分为快速检测和确证检测两类。快速检测主要用于现场快速筛查和半定量分析,而确证检测则用于定性定量分析和实验室仲裁检测。两类检测方法互为补充,为防范DON毒素安全风险提供一定技术支撑。
2.1 快速筛查方法
2.1.1 薄层色谱法薄层色谱法(thin layer chromatography,TLC)是较早 应用于真菌毒素检测分析的常规方法之一,主要原理是通过观察毒素在紫外光线照射下产生蓝紫色荧光的强弱和斑点大小来判定毒素的种类和含量[40]。Makun等[41]采用TLC法分离鉴定大米中DON,方法检出限为 100 μg/kg,且分离效果良好。TLC方法简单,但存在试剂用量大、前处理繁琐、重现性差、检出限高等缺点,很难满足现代食品检测高准确度、高灵敏度、高自动化的要求,在DON检测研究中也已很少单独使用TLC方法。但随着科学技术的不断发展,TLC与其他分离技术手段如高效液相色谱(high performance liquid chromatography, HPLC)法的联合使用使得TCL法在DON检测方面仍有一定的应用前景[42]。
2.1.2 免疫分析法
2.1.2.1 酶联免疫吸附测定法
酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)法是目前检测DON等真菌毒素最常用的免疫学分析策略。在实际应用中,根据标本性状和试剂来源以及检测条件,可设计出不同类型的检测方法,主要包括双抗体夹心法、竞争法和间接法。DON等真菌毒素属于小分子物质,一次只能结合一个抗体,故一般采取竞争检测模式。目前有多种专门针对食品及饲料中DON检测的商品化ELISA试剂盒,这些ELISA试剂盒的靶标物质还包括3-AcDON、15-AcDON、脱环氧DON (DOM-1)和DON-3-葡萄糖苷等衍生物[43-44]。韩丽等[45]研制了一种自主组装的间接竞争ELISA试剂盒,用于饲料中DON的检测,该试剂盒对DON的最低检测质量浓度为1.147 ng/mL,检测范围为1.50~130.31 ng/mL,测定结果与HPLC法结果一致。ELISA方法快速、灵敏、方便,在日常检测中被广泛使用,但它存在易发生交叉反应、结果假阳性率高、基质效应严重等缺点,通常需要配合使用其他分析方法以验证结果。
2.1.2.2 时间分辨荧光免疫分析法
时间分辨荧光免疫分析法(time-resolved fluoroimmunoassay,TRFIA)是在荧光免疫分析基础上发展起来的一种非放射性标记免疫分析技术,与传统的荧光素标记不同,它以钐(Sm)、铌(Nd)等三价稀土离子镧系元素为标记物代替荧光物质、化学发光物、酶、同位素,标记抗原、抗体、核酸探针等。这些离子可产生荧光,其荧光不仅强度高,且荧光衰变时间长,通过延长测量时间,待样品中寿命短的自然荧光衰变后再用TRFIA技术检测,可消除自然荧光的干扰。TRFIA技术在食品安全领域的应用研究也已逐渐展开,在DON等真菌毒素等分析中相继建立起来,与传统的ELISA相比,它具有良好的线性范围和较低的基质效应。Zhang Jue等[46]采用TRFIA法测定谷物中的DON,结果表明使用Sm3+标记的抗体比其他荧光染料标记的抗体更稳定,发射光谱更窄,DON的检出限为0.194 μg/kg。TRFIA的荧光信号强、灵敏度高、稳定性好、选择性强,同时它还不具有放射性,安全系数高,是一种很有应用前景的技术。
2.1.2.3 侧向免疫分析法
侧向免疫分析(lateral flow immunoassay,LFI)法是在免疫渗透技术基础上建立的固相标记分析技术,其结合了免疫技术和色谱层析技术的优点。LFI的物化形式是免疫层析试纸条,其核心部分由样品垫、结合垫、反应垫、支撑垫和吸水垫5 个部分组成(图2)。LFI法以条状纤维素膜为固相载体,借助毛细管的吸附作用使样品在层析材料上移动,当流经检测带和控制带时,抗原、抗体和指示探针会发生一系列反应,通过肉眼观察和仪器测定进行定性和定量分析[47]。目前应用于真菌毒素等小分子目标物检测的LFI主要基于竞争免疫反应模式,基本原理是固定化抗原/抗体与待检样品溶液中的目标分析物之间存在竞争关系,共同竞争抗体/抗原与标记物形成的指示探针。样品滴加到样品垫时,样品溶液通过毛细管作用流经层析条带,如果样品中含有目标分析物,则其会与指示探针结合后形成分析物-指示探针复合物,此时检测带上所能捕获的探针量就少,检测带不可见,结果呈阳性;如果样品溶液中不存在目标分析物或其含量低于检测范围,所有的指示探针都会与检测带相结合,而多余的指示探针会继续流过膜与控制带相结合,检测带与控制带均可见,此时的结果呈阴性。Yu Songcheng等[48]通过制备抗体-纳米-Au颗粒及DON-牛血清白蛋白复合物以建立基于竞争免疫原理的LFI法,用于检测谷物中的DON,该方法重复性和稳定性良好,视觉检出限低至10 ng/kg。LFI法具有直观、成本低廉、显色迅速、适用于现场大规模初步筛选等优点,但检测灵敏度较低、结果易误判、难以定量、易受环境影响等缺点一定程度上限制了LFI的推广应用。

图2 侧向层析试纸反应模板[47]Fig.2 Reaction template for lateral flow test strip[47]
2.1.2.4 其他新兴免疫分析法
免疫芯片是基于蛋白质微阵列和免疫反应原理开发的一种特殊蛋白芯片,芯片上的探针点阵通过特异性免疫反应捕获样品中的靶标蛋白,然后用专用激光扫描系统和软件对其进行图像扫描、分析及结果解释。Wang Ying等[49]采用免疫芯片法同时检测了包括DON在内的12 种不同的真菌毒素,其中DON的检出限为15.45 ng/mL。免疫芯片技术具有高通量、自动化、灵敏度高和能够多元分析等 优点,特别适合用于多种DON毒素的同时分析。多重分析(multi-analyte profiling,ΧMAP)是一种基于流式细胞仪、ELISA和微阵列原理开发的一种新型检测技术,具有低敏感性和可重复性等优点。ΧMAP技术将一种用特殊颜色编码的微球悬浮液阵列与专用流式细胞仪结合在一起,实现在一个孔中使用很小的样品量即可完成不同目标物的同时测定。Peters等[50]利用抑制免疫原理,将DON-牛血清白蛋白偶联到羧化顺磁微球上以对DON进行ΧMAP分析,方法的检出限低于500 μg/kg,该结果得到液相色谱-串联质谱(LC-tandem mass spectra,LC-MS/MS) 的验证,同时在测定过程中未观察到交叉反应。平面波导(planar waveguide,PWG)是一种基于间接竞争免疫测定原理的筛选方法,通过光在波导中的传播,测定与生物芯片表面结合的抗原抗体复合物中的标记抗体的荧光。近年来PWG也被用作同时分析多种真菌毒素,如在Tittlemier等[51]的研究中,采用PWG系统检测到的DON检出限约为400 μg/kg。然而,对于DON含量范围在1 250~2 000 μg/kg的小麦样品,该PWG系统检测的结果仅为GC-MS测定值的71%。PWG与其他分析技术相比,灵敏度较低。
2.1.3 生物传感器法
2.1.3.1 表面等离子体共振法
表面等离子体共振(surface plasmon resonance,SPR)是一种光学物理现象,一束P偏振光在一定的角度范围内(入射角大于临界角)入射到棱镜端面,在棱镜与金属膜表面上发生全反射现象,所形成消逝波进入光疏介质中,并引发金属薄膜中的自由电子形成表面等离子体。表面等离子的集体振荡能够产生一种沿着界面传播的横向电磁波,即表面等离子波。当消逝波的波矢量与表面等离子波的波矢量相等时,引起金属膜内自由电子产生共振,即SPR。当发生SPR时,检测到的反射光强会大幅度减弱。此时,光子转移到表面等离子,入射光的大部分能量被表面等离子吸收,使反射光的能量急剧减少,其中反射光完全消失的角就是SPR角。SPR角随着金属薄膜表面折射率的改变而改变,任何附着在金属薄膜表面物质的量、构型发生改变时均可被检测出来[52],其原理图见图3。SPR作为一种敏感的表面分析技术,通常被认为是不使用任何人工标记试剂的生物传感器。SPR生物传感器将探针或配体固定于金属薄膜(传感芯片)表面,含目标分析物的测试样品流经金属薄膜表面,分子间会发生特异性结合反应从而改变膜表面的折射率,并通过放大反射光微小角度的变化响应以得到分析结果[52]。Hossain等[53]基于竞争免疫原理建立了纳米金增强多重成像SPR方法,用于检测小麦中DON,该方法检出限为15 μg/kg。Wei Tao等[54]使用自组装单层膜传感器芯片建立了SPR方法,用于检测小麦和玉米中的 DON,该方法不易发生交叉反应,线性范围良好,特异性较强,最低检出限为3.26 ng/mL。SPR方法快速、灵敏,但测定结果易受温度波动和基质效应的影响,稳定性较差。
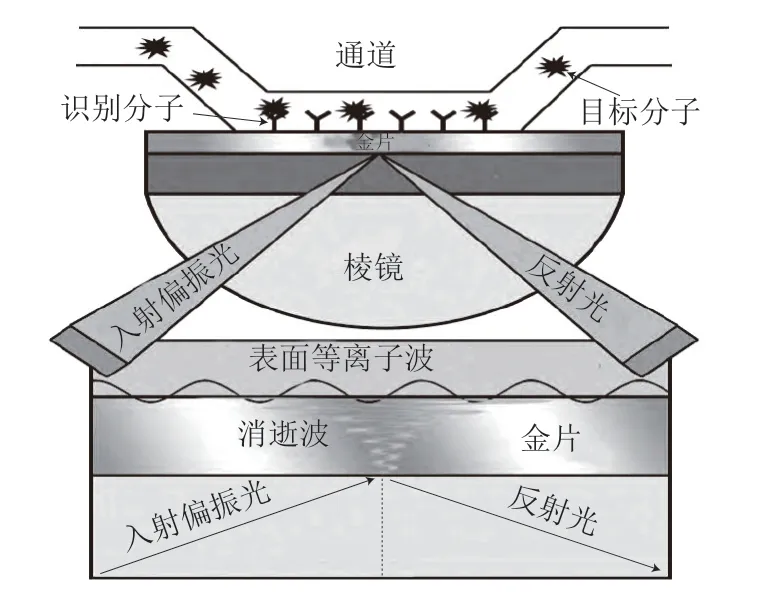
图3 SPR传感器原理图[52]Fig.3 Schematic diagram of surface plasmon resonance sensor[52]
2.1.3.2 生物膜层干涉法
生物膜层干涉法(biolayer interometry,BLI)是基于光干涉原理的非标记技术,具有操作简单、无损检测、样品消耗量少、实时结果输出等优点。与SPR的原理类似,BLI需要将目标分析物结合在生物传感器末端形成一层生物膜,区别在于BLI通过实时监测光的干涉信号变化来实现目标物的相互作用分析或检测[55]。关于小麦粉中DON的BLI分析结果表明,检测过程在7 min即可完成,测定的DON的检出限为100 μg/kg[56]。Maragos等[57]采用抗体-胶体金偶联物建立的BLI方法可将DON的检出限降低至90 μg/kg,测定时间缩短至6 min,结果得到HPLC法的验证。与SPR方法类似,BLI同样存在对温度波动敏感的问题,容易出现假阳性或阴性结果。
2.1.4 光谱分析方法
2.1.4.1 高光谱成像技术
高光谱成像技术(hyperspectral imaging,HSI)是基于非常多窄波段的影像数据技术,具有丰富的吸收谱带,在识别样品外部特征信息的同时,可获得反映样品内部物理结构和化学成分的光谱信息,并将图谱合二为一。HSI最大的特点是能够对几十个乃至几百个窄波段进行连续的光谱覆盖,同时光谱分辨率高、操作方便。典型的HSI系统由硬件和软件组成(图4),硬件主要包括提供照明的光源、检测器(可同时获得光谱和空间信息)、高光谱仪(用于分散反射、透射或散射光的波长,并将信号传送到检测器的感光表面)、物镜(调整光的采集范围)、载物台以及计算机。成像原理为激发光源模块产生线光源,照射到待测样品后产生漫反射光,利用高信噪比的高光谱仪将产生的光转换成光谱,并将其形成图像,由摄像机统一接受并传输到计算机中,获得可以指示食品样品中物理性质和化学成分的高光谱图像。HSI具有非破坏性、操作简便、快速且重复性好等特点,能实现实时在线检测,目前主要应用于农产品内外部品质的检测,近年来也有应用于DON等真菌毒素检测的报道。如Liang Kun等[58]通过可 见-近红外(visible near-infrared,Vis-NIR)和短波近红外(short-wave infrared,SWIR)两个高光谱成像系统分别采集96 个小麦籽粒和小麦粉的图像,经多元散射校正(mutiplicative scatter correction,MSC)和标准正态变量变换(standard normal variate,SNV)两种方法对光谱数据进行预处理后,再分别运用基于支持向量机和稀疏自动编码(sparse auto-encoder,SAE)网络的算法建立模型用于预测样品中DON的含量水平,结果表明,对于小麦籽粒样品,Vis-NIR-MSC-SAE模型预测性能更高;对于小麦粉样品,SWIR-SNV-SAE模型的预测性能更高。
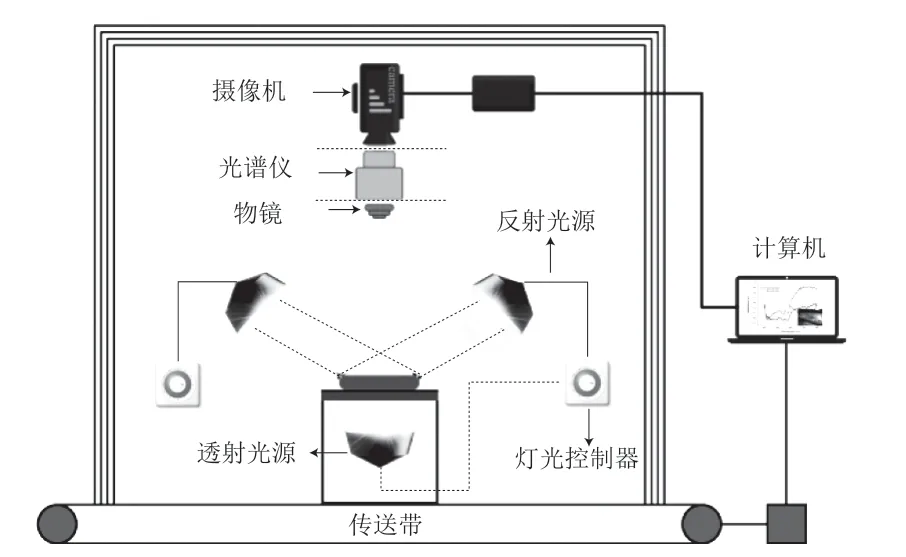
图4 高光谱成像系统的结构[59]Fig.4 Configuration of a hyperspectral imaging[59]
2.1.4.2 表面增强拉曼光谱技术
拉曼光谱是一种能够表征分子振动能级的光谱,其拉曼效应来源于分子振动与转动,能够对物质的组成和结构进行无创分析,具有极高的分子特异性。但是,传统拉曼光谱散射强度较弱,易受荧光干扰,检测灵敏度低,限制了其应用范围。而表面增强拉曼光谱(surfaceenhanced Raman spectroscopy,SERS)是利用光与金、银等纳米结构材料相互作用产生很强的表面等离子基元共振效应,可显著增强吸附在纳米结构表面上分子的拉曼信号,以超灵敏地获取样品自身或拉曼探针分子的指纹图谱。通常情况下,SERS增强因子的平均值约为106,在等离子体间隙和尖锐突起的位置,局域增强因子可高达1014,弥补了传统拉曼光谱检测灵敏度低的不足,是一种极具潜力的快速检测技术,具有无损、快速、高灵敏度和高选择性等优势。目前,SERS技术在其检测中的应用,主要是以抗原-抗体间的免疫反应为基础,因此其基底制备是影响SERS信号增强效果的一个重要因素。基于贵金属银(Ag)、金(Au)的纳米颗粒或纳米阵列是常用的SERS基底,具有高增强、高均一性等优点。Tegegne等[60]制备了涂有聚多巴胺(polydopamine,PDA)的纳米银基底,用于检测饲料中DON含量,研究结果表明具有超薄PDA外壳的Ag NCs@PDA基底通过氢键和π-π堆积相互作用增强了DON的吸收,并提高了基底的稳定性,SERS增强因子可达1.82×107,方法检出限为0.243 pg/L。
2.2 基于色谱或质谱的定性定量分析方法
2.2.1 高效液相色谱法
HPLC法适用于高沸点、不易挥发、受热不稳定易分解、不同极性的有机化合物的分析。鉴于DON分子的理化特性,HPLC法同样适用于谷物、血浆、组织液等样品基质中的DON及其衍生物的检测分析[61-63]。HPLC通常与紫外-可见检测器(ultraviolet-visible detector,UV)、二极管阵列检测器(diode array detector,DAD)、荧光检测器(fluorescence detector,FD)、火焰离子化检测器或电子捕获检测器(electron capture detector,ECD)等相结合,以检测和分析目标物。HPLC-UV法是检测DON等真菌毒素最常用的液相分析方法[64]。Klinglmayr等[65]采用HPLC-UV法在220 nm波长处检测小麦制品和饲料样品中的DON,该方法检出限和定量限分别为200 μg/kg和380 μg/kg。Rahmani等[66]基于空气辅助分散液-液微萃取前处理技术建立了检测大米中DON的HPLC-DAD法,该方法线性范围为50~500 μg/kg,检出限为23.6 μg/kg。Ok等[67]采用IAC对大米及米糠中的DON和雪腐镰刀菌烯醇(nivalenol,NIV)进行净化处理,并利用HPLC-UV法对其含量进行测定,该方法线性关系良好,DON和NIV的定量限均小于11.09 μg/kg。Zhang Yingyue等[68]建立并优化了同时基于DAD和FD检测的multi-IAC-HPLC法,并对全麦粉和精致小麦粉中DON及其衍生物等9 种真菌毒素进行分析测定,该方法的回收率为75.78%~118.24%,检出限和定量限分别为1.5~20 μg/kg和5.0~60 μg/kg。HPLC技术具有灵敏度高、选择性好、重复性可靠、操作自动化、能同时对多种真菌毒素进行定性定量分析等优点,但仪器价格昴贵,待测样品通常需要经净化处理后再进系统分析。
2.2.2 气相色谱或气相色谱-质谱联用法
DON的沸点为543.88 ℃,不易汽化,因此不能直接采用GC或GC-MS法检测,而需要先经过衍生化处理使其沸点降低、热稳定性提高。DON化学结构为四环倍半萜烯,其环有3 个羟基,易形成稳定的氢键,不易挥发,一般选用衍生剂或酰化剂对这3 个羟基进行甲基硅烷化或氟酰化处理。硅烷化试剂包括N,O-双(三甲基硅基)乙酰胺、三甲基氯硅烷、N-三甲基硅咪唑、三甲基 硅基[27,69];酰化试剂包含三氟乙酸酐、五氟丙酸酐、七氟丁基咪唑[70-72]。在利用GC分析DON等毒素含量时,常见的检测器为ECD及质谱检测器。张正炜等[73]建立了一种GC-ECD法,用于分析小麦粉中DON毒素残留,该方法 线性范围为0.01~1.00 mg/L,最低检测剂量为0.01 mg/kg。 王娅琴等[74]建立了SPE-GC-MS检测酱油中DON的分析方法,DON的线性范围为0.025~8.000 μg/mL,检出限和定量限分别为5 ng/mL和16.67 ng/mL。Cunha等[31]采用 GC-MS/13C同位素标记法对人体尿液中的DON、DOM-1、3-AcDON和15-AcDON进行了分析测定,以上目标分析物的检出限分别为0.25、0.50、1.00 ng/mL和0.2 ng/mL。Jeleń等[75]建立了全二维气相色谱飞行时间质谱法对小麦中的DON及其衍生物进行分析,DON和3-AcDON的检出限分别为25 μg/kg和50 μg/kg。GC-MS或GC-MS/MS技术具有分析速度快、灵敏度高等优点,但由于样品需要净化和衍生化的处理,使得该方法操作起来比较复杂。
2.2.3 液相色谱-质谱或液相色谱-串联质谱联用法
LC-MS以LC作为分离系统,质谱为检测系统,样品在检测系统和流动相分离,被离子化后,经检测系统的质量分析器将离子碎片按照质量数分开,最终检测器得到质谱图。LC-MS或LC-MS/MS的灵敏度高、选择性强,分析确证高度可靠,可同时检测样品中的包括DON及其衍生物在内的多种真菌毒素。与GC-MS不同,待测样品用LC-MS分析时不需要衍生化。电喷雾电离(electrospray ionization,ESI)和大气压化学电离均可作为检测DON及其衍生物分析的电离源。大多数关于DON定量分析的LC-MS方法通常选择ESI作为电离源,但其容易受样品基质效应干扰而产生离子抑制或增强现象[31]。基质效应是电离过程中样品基质里其他分子对目标分析物的干扰,它会影响目标分析物的检测灵敏度和定量准确性。利用LC-MS/MS法测定DON毒素时,通过添加内标物质(例如同位素标记的分析物)、使用基质匹配校准曲线、样品净化处理等手段可有效消除或降低基质效应。在确定流动相方面,研究发现DON在甲醇溶液中具有更高的响应值,因此通常选择含5~10 mmol/L乙酸铵的甲醇作为有机相[30,76-77];对于水相,通常使用含有与有机相相同挥发性盐的超纯水。Broekaert等[78]采用LC-MS/MS法检测分析了鸡和猪血浆中DON、DOM-1、3-AcDON及15-AcDON的残留情况,4 种毒素的检出限为0.01~0.70 ng/mL,定量限为0.1~2.0 ng/mL。吴琴燕等[79]建立的超高效液相色谱-串联质谱方法可同时检测麦粒中的DON、3-AcDON、15-AcDON及NIV,4 种毒素检出限为2.06~13.36 μg/L。Zhao Zhiyong等[80]建立 HPLC-MS/MS法测定饲料中DON、NIV、DOM-1、3-AcDON、15-AcDON及镰刀菌烯酮Χ含量,并采用改进的分散SPE法净化样品,以上6 种毒素的定量限范围为5.0~13.6 μg/kg。 Stastny等[81]建立超高效液相色谱质谱联用方法检测分析猪的初乳和血清中DON及DOM-1的残留情况,并采用亲水亲油平衡小柱净化样品,初乳中DON和DOM-1的检出限分别为0.48 μg/L和0.54 μg/L,定量限分别为0.80 μg/L 和0.89 μg/L;血清中DON和DOM-1的检出限分别为0.24 μg/L和0.36 μg/L,定量限分别为0.39 μg/L和0.60 μg/L。 LC-MS法通常要求样品净化后再上样,以避免色谱柱的堵塞,但也有文献报道了无需样品净化的LC-MS/MS法,这在同时检测多种DON毒素时表现出很强的实用性。如Warth等[82]采用HPLC-四极杆/线性离子阱质谱法检测人尿中的DON和DON-3-O-GlcA,并确定DON-3-O-GlcA 的定量限高于30 ng/mL,该方法不需要净化处理。尽管LC-MS仪和LC-MS/MS仪价格昴贵,容易受基质效应的影响,但鉴于其具有出色的灵敏度和良好可重复性,目前已成为检测DON及其衍生物的最佳选择之一。
3 结 语
DON及其衍生物的危害性和广泛分布的特点会对人类健康、食品安全和国际贸易产生严重的影响。因此,在加强监管的前提下,开发针对DON及其衍生物的定性定量分析方法显得至关重要。本文综述了当前应用于DON及其衍生物检测的主要分析技术,并对其优缺点进行了分析,所提供的信息有助于研究人员在实际应用中根据分析目的、样品性质及环境条件选择适宜的方法。此外,随着学科的交叉融合和各种检测手段的发展以及检测要求的不断提高,DON及其衍生物的检测技术发展趋势应具有如下特点:1)快速检测技术依然是现场实地监控DON及其衍生物的有效技术手段。基于免疫分析法的快速检测技术离不开高灵敏、高特异性的抗体,因此通过研发更高水平的特异性抗体能显著提高免疫分析法的检测速度并扩大其应用范围;而针对其他快速检测技术存在的成本较高、便携性较差、无法精确定量等问题,也需要对其方法进行积极改进,开发各种新型的、适合现场筛查的便携式小型设备,以期满足DON毒素的快速检测需求。2)从检测某种DON毒素向同时检测多种DON毒素发展。随着对DON衍生物研究的深入,人们发现样品基质中DON衍生物往往与原型同时存在,有些甚至比原型毒素的毒性作用更大,如何方便、快速、准确、高通量地检测出该多种毒素的种类及含量依旧是当下和未来的研究重点。3)开发精准高效的DON及其衍生物的实时在线监测技术。光谱检测技术是基于DON及其衍生物污染样品的光谱特征,对样品中DON毒素进行准确定量,实现样品的实时无损在线监测,是DON毒素检测技术的发展趋势。
