米糠粕不溶性膳食纤维理化性质及对高脂 大鼠肠道菌群的影响
2021-08-31范誉川刘素诗赵洁羽
刘 倩,范誉川,刘素诗,赵洁羽,魏 涛,*
(1.北京联合大学生物化学工程学院,北京 100023;2.北京联合大学 生物活性物质与功能食品北京市重点实验室,北京 100191)
现代饮食习惯通常会造成脂肪和糖的过量摄入,从而引起肥胖、高脂血症等疾病。高脂血症除造成血浆中胆固醇和(或)甘油三酯水平升高外,通常还会使肠道菌群发生显著改变[1-3]。膳食纤维是指天然存在于水果、蔬菜、谷类等食品中的一类不能被人体消化道酶解吸收的营养物质,在控制体质量、缓解高脂血症、预防结肠癌和心脑血管疾病等方面具有重要应用[4-6]。美国饮食协会建议每天膳食纤维摄入量女性约为25 g,男性约为38 g[7];Reynolds等建议人们应将膳食纤维的摄入量增加到每天至少25~29 g,并认为更多的摄入量可能会带来额外的益生作用[8]。而目前全球大多数人每日膳食纤维摄入量不足20 g,2016年中国医药生物技术协会膳食纤维分会发布的《中国居民膳食纤维摄入白皮书》显示,中国居民膳食纤维摄入普遍不足,每日人均膳食纤维(不可溶)摄入量仅为11 g;因此开发膳食纤维产品、提高我国居民膳食纤维摄入水平具有重要意义。米糠和米糠粕是稻米及其相关产品加工过程中的副产物,我国是水稻种植大国,2019年全国稻谷产量为20 961万 t,按出糠率12%计算,则可产出约2 515万 t米糠。米糠原材料分布广、产量大、膳食纤维含量丰富,可作为膳食纤维的良好来源。
根据水溶性的不同,膳食纤维可分为可溶性膳食纤维和不溶性膳食纤维,不溶性膳食纤维主要包括纤维素、半纤维素和木质素等,通常认为不溶性膳食纤维可通过增加粪便体积、刺激肠道蠕动、增加排便量等方式发挥生理活性[9-10]。近年来的一些研究结果表明,不溶性膳食纤维还可被肠道微生物发酵利用,Sun Shanshan等发现不溶性的茯苓多糖能够使小鼠肠道中产丁酸菌Lachnospiracea和Clostridium丰度增加,提高肠道中丁酸盐水平和黏膜完整性,激活肠道过氧化物酶体增殖物激活受体γ通路[11];Yang Lina等通过体外发酵分析发现大豆壳不溶性膳食纤维能够增加双歧杆菌和乳杆菌丰度[12];Wu Weijie等发现箭竹不溶性膳食纤维能够提高双歧杆菌丰度,并使总短链脂肪酸的含量增加0.71 倍[13]。不溶性膳食纤维摄入可影响肠道菌群的组成和代谢,通过更加复杂的方式发挥调节作用,而目前关于米糠粕不溶性膳食纤维(rice bran insoluble dietary fibers,RBIDF)对肠道菌群的影响缺乏相关研究。
本实验以米糠粕为原料,通过多种酶结合处理的方式制备RBIDF,对其表面结构、常规成分和理化性质进行研究,此外建立高脂大鼠模型,分析RBIDF干预对高脂大鼠肠道菌群的影响,以期为RBIDF的开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
米糠粕 郑州四维粮油工程技术有限公司;α-淀粉酶(40 000 U/g)、α-1,4-葡萄糖苷酶(100 000 U/g)、木瓜蛋白酶(100 000 U/g)和纤维素酶(50 000 U/g) 北京索莱宝科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、胆固醇 生工生物工程上海股份有限公司;Gene JETTMGel Extraction Kit试剂盒 美国Thermo Scientific公司;甘油三酯、总胆固醇测定试剂盒 南京建成生物工程研究所。
1.2 仪器与设备
SU-8010扫描电子显微镜、L-8800氨基酸分析仪 日本 日立公司;SER148脂肪萃取仪 意大利VELP公司;DR-200BS酶标分析仪 无锡华卫德朗仪器有限公司。
1.3 方法
1.3.1 RBIDF的制备
取一定量米糠粕,按料液比1∶20加水搅拦混匀,添加1%(以米糠粕质量计,下同)的淀粉酶和0.4%的糖化酶,混匀并于60 ℃下酶解2 h,后置于沸水浴中灭酶10 min,冷却至室温后,加1%的木瓜蛋白酶酶解2 h,再置于沸水浴中灭酶10 min,冷却至室温后加入1%的纤维素酶于60 ℃下酶解1 h,后置于沸水浴中灭酶10 min,离心去掉上清液,沉淀用蒸馏水和体积分数95%乙醇溶液各洗涤1 次,随后在60 ℃下干燥,粉碎后过60 目标准筛备用。
1.3.2 RBIDF表面结构观察
将样品干燥至恒质量,取样品若干,置于粘有铜片的观察台上,样品粘台后喷金,通过扫描电子显微镜于10 kV下观察表面超微结构。
1.3.3 RBIDF常规成分和理化性质分析
水分质量分数参照GB 5009.3—2016《食品安全国家标准 食品中水分的测定》中直接干燥法测定;脂肪质量分数参照GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》中索氏抽提法测定;蛋白质量分数参照 GB/T 31578—2015《粮油检验 粮食及制品中粗蛋白测定 杜马斯燃烧法》测定;灰分质量分数参照GB 5009.4—2016 《食品安全国家标准 食品中灰分的测定》测定;不溶性膳食纤维质量分数参照GB 5009.88—2014《食品安全国家标准 食品中膳食纤维的测定》中酶重量法测定;氨基酸含量参照GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》测定。碳水化合物质量分数参照GB 28050—2011《预包装食品营养标签通则》测定,按照公式(1)计算。

持水力采用Sangnark等的方法[14],将3 g样品和100 mL去离子水放入烧杯中混匀,静置2 h后离心去上清液,称量样品的湿质量。持水力按公式(2)计算。

持油力参照Sangnark等的方法[14],取3 g样品置于离心管中,加入24 g食用花生油,37 ℃静置1 h,离心去掉上层油,再用吸油纸吸干游离花生油,称量剩余样品的质量。持油力按公式(3)计算。

1.3.4 RBIDF吸附能力测定
分析RBIDF对葡萄糖和胆固醇的吸附能力。吸附量以每克样品吸收的底物质量表示,单位mg/g。吸附率按式(4)计算。

葡萄糖吸附能力测定:称取1 g样品与100 mL的葡萄糖溶液(0.1、0.2、0.3 mg/mL)混匀,置于37 ℃、180 r/min 摇床中分别吸附0.5、1、2、4 h,分别离心取上清液,采用3,5-二硝基水杨酸法测上清液中葡萄糖的质量。
胆固醇吸附能力测定:在pH 2.0和pH 7.0的条件下将1 g样品与50 mL的胆固醇溶液(40 mg/mL)混匀,于37 ℃、180 r/min下分别吸附0.5、1、1.5、2、3 h,离心取上清液,采用Liu Chun等的方法测上清液中胆固醇的质量[15]。
1.3.5 RBIDF体外抗氧化能力测定
参考Sarfaraz等的方法[16],将0.3 g的RBIDF样品与10 mL、体积分数50%丙酮溶液混匀后在室温下振荡16 h,随后10 000 r/min离心10 min,取上清液测其体外抗氧化能力。DPPH自由基和羟自由基清除能力测定参照Liu Qian等的方法[17]进行,配制相应质量浓度(1.875~60 mg/mL)的VC溶液作为阳性对照。
1.3.6 动物实验
选择体质量在140~160 g的成年雄性SD大鼠,适应性饲养7 d后,饲喂高脂饲料4 周建立高脂血症模型,采用试剂盒检测大鼠血清甘油三酯和总胆固醇水平,然后依据甘油三酯水平随机分为2 组,即高脂模型组(MC组)和RBIDF干预组(RBIDF组),MC组喂养高脂饲料(饲料配方如表1所示),RBIDF组除喂养高脂饲料外每日按3.5 g/kgmb灌胃RBIDF,每组6 只大鼠。灌胃干预4 周,另设正常对照组(NC组)喂养基础饲料。灌胃结束后麻醉处死解剖,迅速收集大鼠盲肠内容物至无菌离心管中,-80 ℃冰箱中保存备用。
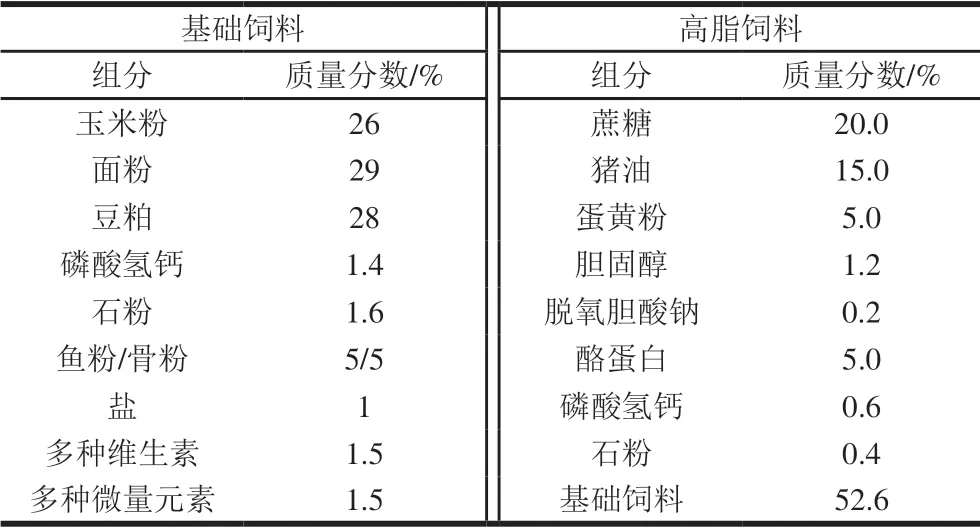
表1 动物饲料配方Table 1 Nutrient composition of experimental diets
1.3.7 肠道菌群分析
采用十六烷基三甲基溴化铵(hexadecyltrimethylammonium bromide,CTAB)法从大鼠盲肠内容物中提取细菌DNA,对16S rDNA的V3~V4可变区进行扩增,使用的通用引物为F431(5′-CCTACGGGRSGCAGCAG-3′)和R806(5′-GGACTACVVGGGTATCTAATC-3′)。利用Gene JETTMGel Extraction Kit试剂盒对产物进行回收,构建文库,利用Ion S5TMΧL平台进行高通量测序。测序和分析方法参考文献[18]。
1.4 数据统计与分析
实验结果以平均值±标准差表示,采用SPSS 19软件对实验结果进行统计分析,组间差异用单因素方差分析法分析,以P<0.05表示差异显著。
2 结果与分析
2.1 RBIDF表面结构观察结果
利用扫描电子显微镜对米糠粕和RBIDF的表面形貌进行观察,如图1A所示,米糠粕的表面结构较为光滑紧密,没有空隙和孔洞,附着有大量的球状颗粒,应为表面包裹的淀粉和蛋白质。而经过淀粉酶、糖化酶、蛋白酶和纤维素酶处理后,淀粉和蛋白质发生水解,获得的RBIDF表面几乎不具有球状淀粉颗粒,呈不规则鳞片式的层状疏松结构,并有明显的裂缝及孔洞(图1B),说明RBIDF与米糠粕相比比表面积有所增大,利于提高其吸附性能。

图1 米糠粕(A)和RBIDF(B)的扫描电子显微镜图Fig.1 Scanning electron microscopic images of defatted rice bran (A) and RBIDF (B)
2.2 RBIDF常规成分和理化性质分析结果
对米糠粕和RBIDF的灰分、蛋白质、脂肪、不溶性膳食纤维和氨基酸组成等指标进行分析。由表2、3可知,RBIDF中蛋白质、脂肪质量分数和各氨基酸含量(除甲硫氨酸)与米糠粕相比显著下降,而不溶性膳食纤维质量分数显著提高(P<0.05),达到64.26%,这可能是RBIDF制备过程中淀粉酶、糖化酶和木瓜蛋白酶的处理可以使米糠粕中的可溶性淀粉和蛋白质发生水解,煮沸处理可提取出米糠粕中残余的部分脂肪所致。此外,持水力和持油力分析结果表明,RBIDF的持水力和持油力与米糠粕相比显著提高,分别可达5.86 g/g和2.86 g/g,这可能是由于处理后RBIDF的表面结构与米糠粕相比更为疏松多孔,比表面积增大。
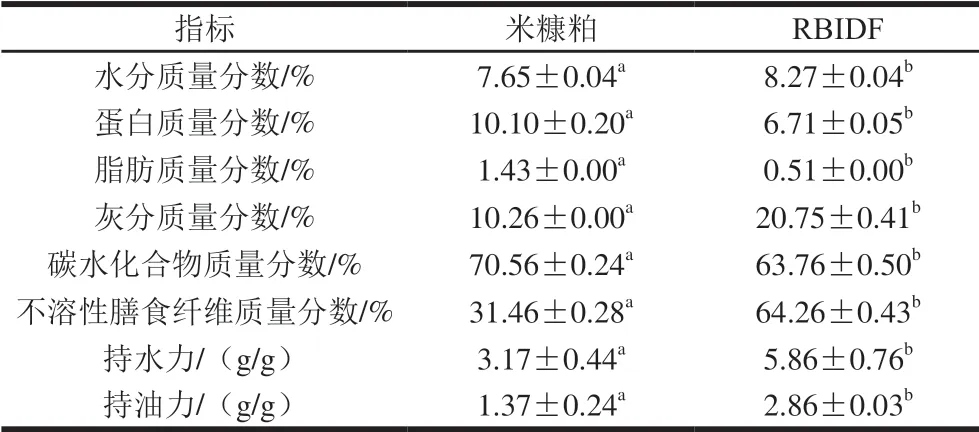
表2 米糠粕和RBIDF常规成分和理化性质Table 2 Chemical compositions and physicochemical properties of defatted rice bran and RBIDF

表3 米糠粕和RBIDF氨基酸组成Table 3 Amino acid compositions of defatted rice bran and RBIDF
2.3 RBIDF吸附能力分析结果
如图2A所示,在相同葡萄糖质量浓度下,随着吸附时间延长,RBIDF的吸附率变化较小并逐渐趋于稳定,说明RBIDF对葡萄糖的吸附较为迅速,吸附量最高为6.4 mg/g,稳定后总体在4.0 mg/g以上,良好的葡萄糖吸附能力说明RBIDF在减少葡萄糖吸收、调节血糖水平方面具有一定的应用潜力。许多疾病与体内胆固醇的含量直接相关,人体中的胆固醇主要来源于外源性摄入和内源性合成,因此,防止过量摄入以及保持正常的胆固醇水平有利于人体健康。如图2B所示,对RBIDF的胆固醇吸附能力进行分析,设置反应pH值分别为2.0和7.0来模拟胃肠道 消化环境,结果表明,在较短的吸附时间内,pH 7.0条件下RBIDF的胆固醇吸附能力要优于pH 2.0,吸附1 h时胆固醇吸附量最高,为12.8 mg/g,而随着吸附时间的继续延长(1~3 h),中性条件下的吸附量有所下降,而酸性条件下吸附量有所提高,吸附2 h时两种条件下胆固醇吸附量都达到9.0 mg/g左右,综上,RBIDF在中性和酸性条件下都表现出一定的胆固醇吸附能力。
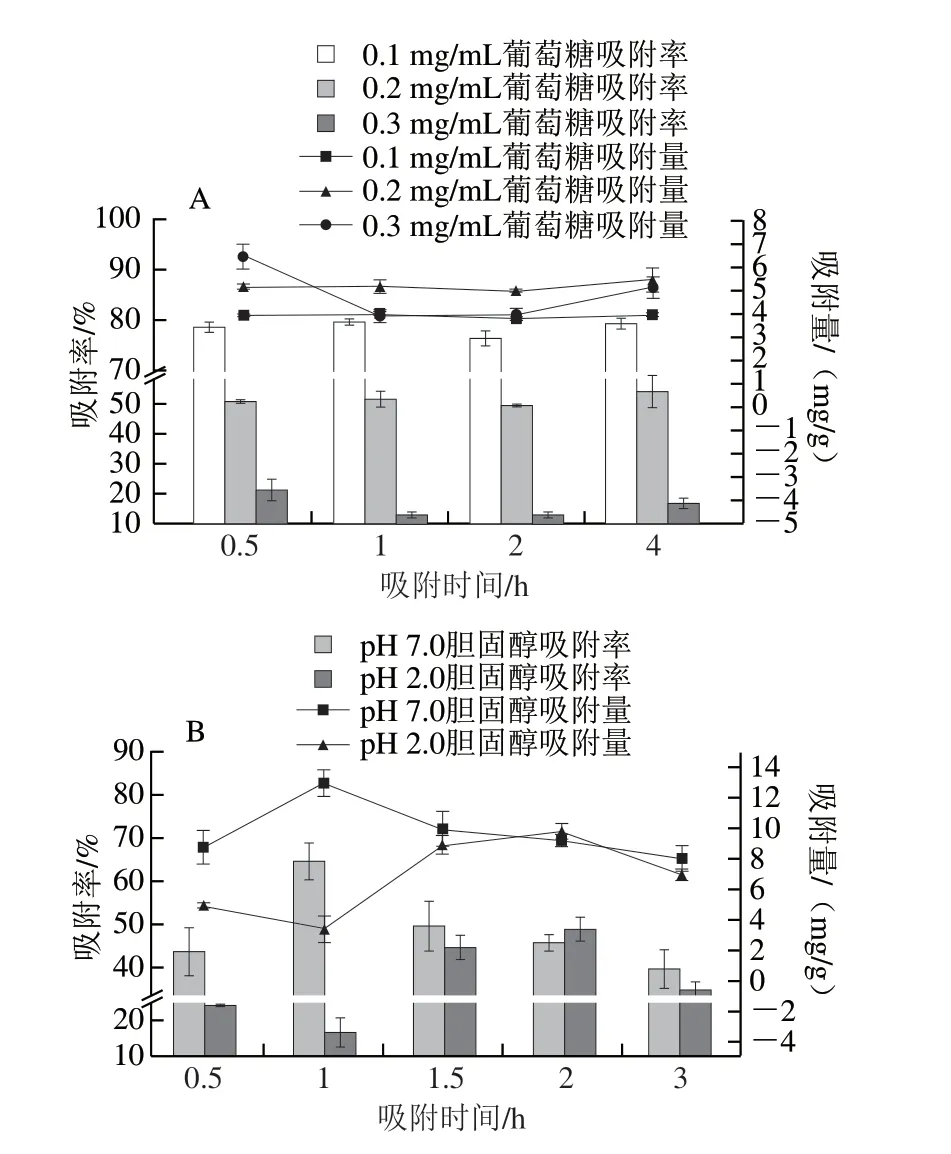
图2 RBIDF对葡萄糖(A)和胆固醇(B)的吸附能力Fig.2 Glucose (A) and cholesterol (B) adsorption capacity of RBIDF
2.4 RBIDF抗氧化能力分析结果
研究表明米糠中含有丰富的酚类化合物,具有抗氧化、抗炎等多种生物活性,其中以共价键结合在纤维素分子上的不溶性酚类化合物是其主要的存在形式[19-20]。如图3所示,RBIDF对羟自由基的清除率最高可达70.1%,对DPPH自由基的清除率随着检测质量浓度增大而升高,60 mg/mL时 约为72.1%。RBIDF表现出良好的抗氧化性,摄入RBIDF对于维持肠道正常氧化还原状态具有一定的有益效果。
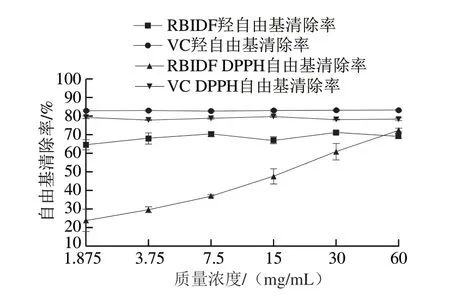
图3 RBIDF对羟自由基和DPPH自由基的清除率Fig.3 Hydroxyl and DPPH free radical scavenging capacity of RBIDF
2.5 RBIDF对高脂大鼠肠道菌群的影响
以往的许多研究已经表明,不溶性膳食纤维在控制高脂大鼠体质量、缓解高脂血症方面具有一定的作用,近年来发现不溶性膳食对于肠道菌群也会产生一定的影响[11-12,21-22],因此对RBIDF灌胃前后高脂大鼠肠道菌群变化进行了分析。首先建立大鼠高脂模型,如表4所示,喂养高脂饲料4 周后,MC组与NC组相比,血清甘油三酯和总胆固醇浓度显著提高(P<0.05),说明大鼠高脂模型造模成功。灌胃RBIDF后提取大鼠盲肠内容物细菌DNA,利用IonS5TMΧL测序平台进行测序,以97%的一致性将序列聚类成为操作分类单元(operational taxonomic units,OTUs),共得到872 个OTUs,然后根据Silva132数据库对OTUs进行物种注释。如图4A所示,对OTUs结果进行Venn图分析,NC组具有687 个OTUs,而高脂模型MC组有581 个OTUs,与NC组相比有所减少,说明高脂饮食在一定程度上降低了动物肠道菌群多样性;RBIDF组含有604 个OTUs,与MC组相比OTUs数量有所恢复。在组成上,与MC组相比,RBIDF组产生162 个特有OTUs,与NC组相比只产生了93 个特有OTUs,说明在菌群组成上RBIDF组与NC组更为接近。

表4 高脂饲料对大鼠血脂水平的影响Table 4 Effect of high-fat diet on serum lipid levels in rats
根据物种注释结果,选取每组在门水平上最大丰度排名前10的物种,生成物种相对丰度柱形累加图,如图4B所示。NC组中厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)为主要物种,厚壁菌门和拟杆菌门是肠道菌群中的两个主要群落,可影响代谢平衡,两者含量和比例可作为判断潜在肥胖可能性的依据,许多研究表明,缺乏膳食纤维、高脂高糖的饮食会引起肠道中厚壁菌门丰度升高,拟杆菌门丰度降低[23-24]。因此,MC组拟杆菌门丰度与NC组相比都有所下降,而RBIDF组与MC组相比拟杆菌门丰度有所恢复,说明在门水平上RBIDF能在一定程度上改善菌群紊乱。如图4C所示,在属水平上,与NC组相比,MC组Blautia相对丰度提高,Lactobacillus、Romboutsia、unidentified_Lachnospiraceae、unidentified_Ruminococcaceae和Roseburia相对丰度有所下降,上述几种微生物与人体健康有重要的关系,有研究发现,非酒精性脂肪肝患者肠道中Blautia丰度与正常人相比有所提高[25], 而Lactobacillus、Roseburia和Ruminococcaceae等微生物的丰度与短链脂肪酸的产生或者防止心脑血管病变等成正相关[26-29]。而RBIDF干预后,与MC组相比,RBIDF组Romboutsia和unidentified_Lachnospiraceae相对丰度下降,Lactobacillus和Roseburia相对丰度无明显变化,而与短链脂肪酸产生相关的Butyricicoccus、Marvinbryantia和unidentified_Ruminococcaceae的相对丰度有所上升(图4C)。根据所有样本的物种注释结果和OTUs的丰度信息,基于Unweighted Unifrac距离进行主坐标分析(principal co-ordinates analysis,PCoA),并选取贡献率最大的主坐标组合进行作图分析,样品距离越接近,表示物种组成结构越相似。如图4D所示,NC组与MC组各样本距离较远,而RBIDF组处于两组之间的位置,表明其与NC组的物种组成结构相似度与MC组相比有所提高,说明RBIDF对高脂膳食造成的肠道微生物群落组成变化具有一定的恢复作用。
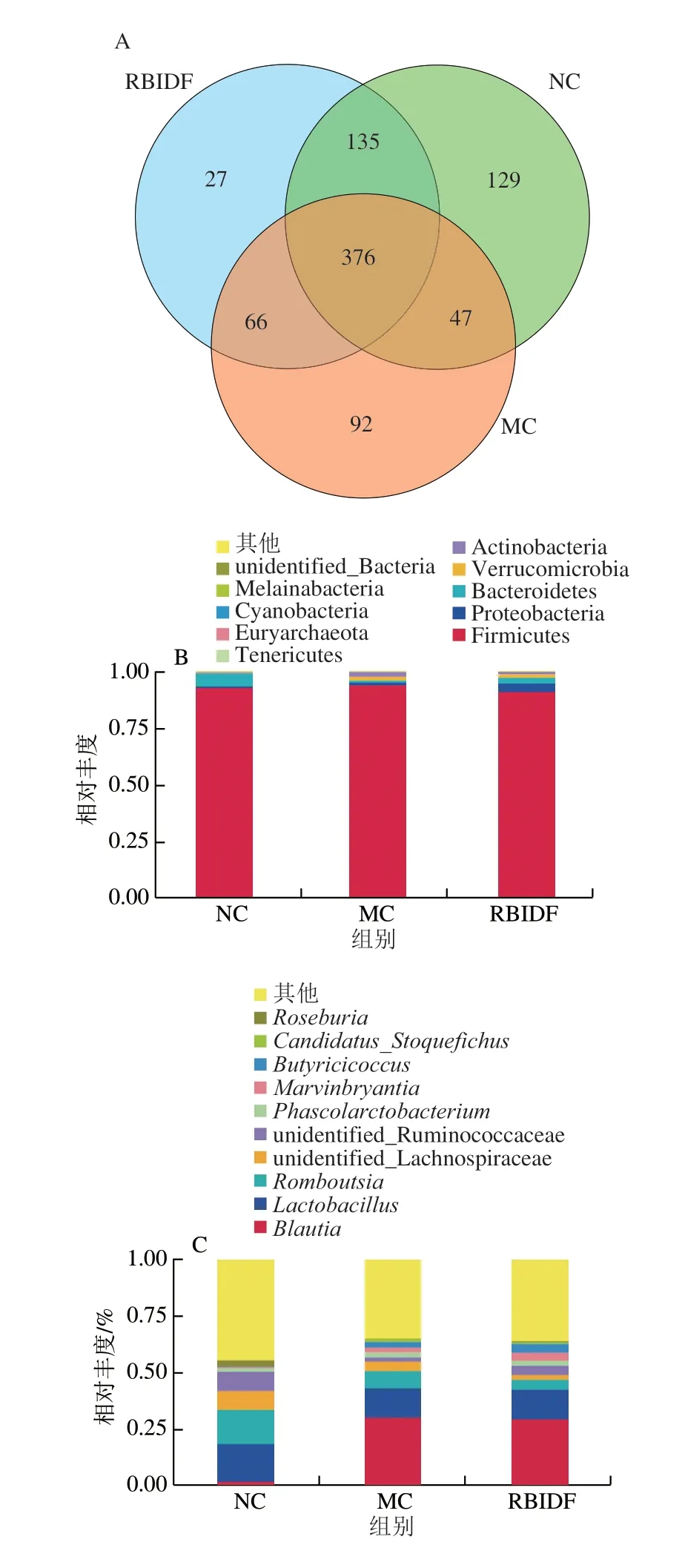
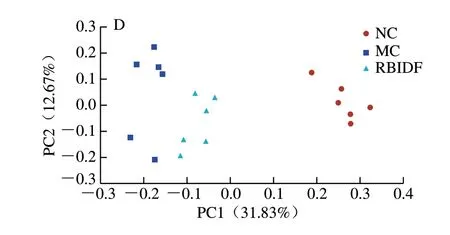
图4 各实验组大鼠肠道菌群组成Fig.4 Gut microbiota composition in different groups of rats
3 结 论
米糠及米糠粕中不溶性膳食纤维含量丰富,本实验利用酶处理等方式制备RBIDF,对其理化性质及对高脂大鼠肠道菌群的影响进行了分析。结果表明,RBIDF不溶性膳食纤维与米糠粕相比结构更为疏松多孔,比表面积增大,具有良好的持油力、持水力以及葡萄糖和胆固醇吸附能力,并且还表现出较好的抗氧化性。此外,灌胃RBIDF能够在一定程度上改善高脂膳食造成的大鼠肠道微生物数量和组成变化,提高与短链脂肪酸产生相关的Butyricicoccus、Marvinbryantia和unidentified_Ruminococcaceae丰度。RBIDF表现出较好的体内体外活性,可作为膳食纤维的良好来源。本研究为开发RBIDF及其作用机理探索提供了理论参考。
