圣草次苷的合成及其对过氧化氢诱导人脐静脉内皮细胞氧化损伤的保护作用
2021-08-31梁曾恩妮汪秋安张菊华苏东林付复华李高阳
梁曾恩妮,汪秋安,张菊华,苏东林,付复华,李高阳,刘 伟,*,单 杨,*
(1.湖南省农业科学院农产品加工研究所,湖南 长沙 410125;2.果蔬贮藏加工与质量安全湖南省重点实验室,湖南 长沙 410125;3.湖南大学化学化工学院,湖南 长沙 410082)
血管内皮细胞呈扁平形或多角形,通过黏附连接、紧密连接和缝隙连接的方式在血管以及淋巴管内表面形成单层细胞,起到调节血管张力、细胞屏障等作用。血管内皮细胞的损伤和功能失调导致血管功能削弱,从而引起高血压、冠心病、心肌梗塞、动脉粥样硬化等心血管性疾病[1]。自由基是细胞代谢的中间产物或副产物,是维持生命所必需的,具有信号传导、预防微生物感染、激活细胞活性等多种生理功能[2]。然而,过剩的自由基利用氧化作用攻击健康细胞的不饱和脂肪酸和蛋白质,引起脂质、代谢酶系、蛋白质和DNA等物质氧化,还会诱导细胞凋亡,导致细胞和机体衰老、损伤或死亡。氧自由基的产生和清除失衡诱发的氧化应激是损伤血管内皮的主要病理因素之一[3]。近年来,自由基对人体的危害备受重视,开发具有清除自由基功能的食品和天然抗氧化剂成为学者研究的重要内容。黄酮类化合物能够调节机体内的自由基水平和增强机体的氧化防御能力,是天然抗氧化剂的重要来源[4]。柑橘是世界第一大水果和重要的天然黄酮化合物来源,其消费量呈稳定上升趋势[5]。由于黄酮化合物具有抑制羟自由基和提供氢原子的能力,因此它们具有抗氧化能力,是极佳的羟自由基清除剂。
圣草次苷是一种存在于柠檬或酸橙柑桔中的黄烷酮,具有抗氧化、抗癌和抗过敏等多种生物活性[6]。国内对圣草次苷活性功能的报道较少,仅有张晓愉等[7]采用圣草次苷治疗小鼠慢性帕金森疾病。他们发现圣草次苷可以通过小鼠神经元细胞的死亡缓解1-甲基-4-苯基-1,2,3,6-四氢吡啶诱导的小鼠慢性帕金森疾病。国外有文献报道圣草次苷还具有其他生理功能。例如,圣草次苷可以通过上调p53、细胞周期蛋白A、细胞周期蛋白D3和周期素依赖性激酶6抑制S期细胞周期,进而抑制肝癌细胞的生长[8];食用圣草次苷(32 mg/(kgmb·d))28 d可以增加线粒体大小和线粒体DNA含量,改善血脂异常和高脂饮食引起的肝脂肪变性[9]。圣草次苷和白藜芦醇联合可抑制体外脂多糖诱导的一氧化氮(NO)、肿瘤坏死因子α和白细胞介素1β的分泌,减轻体内12-O-十四烷酰佛波-13-乙酸酯引起的水肿和皮下组织炎症[10]。Miyake等[11]使用亚油酸体系评估圣草次苷抗氧化活性发现,圣草次苷在亚油酸自氧化系统中的抗氧化活性与α-生育酚相当,与柠檬酸共同使用时抗氧化活性增强。
然而,圣草次苷在枳壳或新鲜柠檬或酸橙中的含量很低,其含量约为柚皮苷、新橙皮苷等柑橘黄酮含量的1/40[12]。企业多利用柠檬自然生理落果和多步法提取圣草次苷,即柠檬等柑橘落果经乙醇提取、树脂分离以及体积分数75%、85%和95%的乙醇溶剂3 步纯化精制,不仅提取效率极低(≤1%),而且产品纯度在10%以内,加工流程繁琐、成本高[13]。而圣草次苷化学合成法使用较少,这种方法可以采用来源丰富、含量高、价格相对低廉的天然二氢黄酮类资源橙皮苷制备圣草次苷,工艺简单可控,不仅简化了生产流程,降低了成本,而且提高了产率和纯度。本实验采用橙皮苷结构修饰合成圣草次苷,对分离纯化后的目标产物通过1H核磁共振(nuclear magnetic resonance,NMR)和13C NMR进行结构表征,以过氧化氢(H2O2)诱导的人脐静脉内皮细胞系(human umbilical vein endothelial cells,HUVEC)作为体外细胞氧化损伤模型,研究圣草次苷的细胞毒性作用及其对H2O2诱导的HUVEC细胞保护作用,评价圣草次苷的抗氧化潜力,为其开发和利用提供理论参考。
1 材料与方法
1.1 材料与试剂
橙皮苷(纯度≥98%) 绵阳迪澳药业有限公司;HUVEC细胞 上海中乔新舟生物科技有限公司;CCK-8(cell counting kit-8)试剂盒 日本同仁化学研究所;DMEM培养基 美国Sigma公司;胎牛血清(fetal calf serum,FBS) 美国Gibco公司;胰酶消化液、双抗(青链霉素)、BCA法蛋白定量检测试剂盒、RIPA裂解液 上海碧云天生物技术有限公司;活性氧(reactive oxygen species,ROS)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、过氧化氢酶(catalase,CAT)和丙二醛(malondialdehyde,MDA)检测试剂盒 南京建成生物工程研究所;Super ECL Plus超敏发光液 美国 Advansta公司;一抗Bax、Bcl-2、p53、β-actin 美国Proteintech公司;其他试剂均为分析纯。
1.2 仪器与设备
BSC-1300IIA2超净工作台 苏净安泰科技有限 公司;Forma Series II CO2培养箱、5424离心机 德国Eppendorf公司;LDZΧ-50KBS高压蒸汽灭菌锅 上海 申安医疗器械厂;LGJ-12D真空冷冻干燥机 北京四环科学仪器厂有限公司;AS200.R2电子天平 波兰 RADWAG公司;Avanti J-26 ΧP高速冷冻离心机、Cytoflex流式细胞仪 美国Beckman公司;MK3酶标仪 美国Thermo公司;CKΧ41SF荧光倒置显微镜 日本Olympus公司;ZWY-100D振荡摇床 上海智城分析仪器制造有限公司;JB-10磁力搅拦器 上海仪电科学仪器股份有限公司。
1.3 方法
1.3.1 圣草次苷制备工艺
将100 g干燥橙皮苷加入由900 mL吡啶溶剂和0.6 g三氯化铝催化剂组成的混合溶液中,在(90±5)℃条件下反应12 h。真空减压回收吡啶,加入550 mL蒸馏水搅拦均匀成浸膏。待浸膏温度低于30 ℃,加入500 mL体积分数10%盐酸水解铝盐2 h,冷却至常温,用活性炭20 g脱色,脱色液上样至大孔树脂柱(高度1 m、内径0.06 m),用3 倍体积的体积分数70%乙醇溶液洗涤该树脂柱至流出液无色,浓缩洗脱液,采用3 倍体积的体积分数85%乙醇溶液搅拦溶解3 h,过滤,收集滤液,减压蒸发浓缩,冷冻干燥并粉碎,得到淡黄色固体。圣草次苷制备工艺流程见图1。
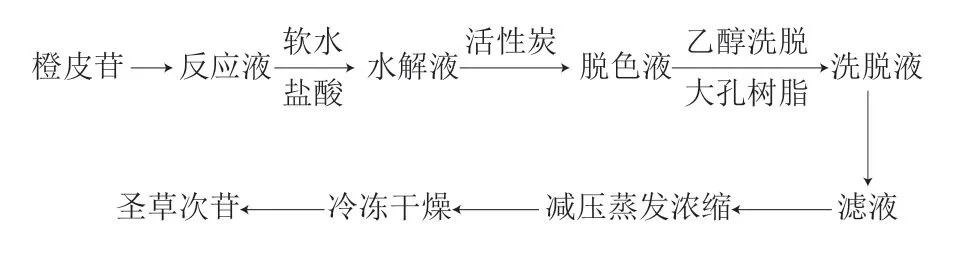
图1 圣草次苷制备工艺流程Fig.1 Flow chart for the preparation process of eriocidin
1.3.2 合成化合物结构测定
对所合成化合物的结构通过1H NMR和13C NMR进行表征,均采用四甲基硅烷作内标,二甲基亚砜(dimethyl sulfoxide,DMSO)-d6作溶剂,1H NMR检测频率400 MHz,13C NMR检测频率101 MHz。
1.3.3 HUVEC细胞培养
在37 ℃、5% CO2、饱和湿度条件下,HUVEC细胞培养于含有10% FBS的DMEM培养基(含100 μg/mL青霉素、100 μg/mL链霉素)中,每2~3 d更换培养液,取对数生长期细胞进行后续实验。
1.3.4 圣草次苷和H2O2对HUVEC细胞生长影响的分析
采用CCK-8法检测圣草次苷和H2O2对HUVEC细胞生长的影响。取对数生长期HUVEC细胞,胰酶消化计数后,以5×103个/孔密度接种于96 孔板内。培养12 h后,加入不同浓度H2O2(终浓度分别为0.1、0.2、0.4、0.6、0.8、1.0、1.2、1.4 mol/L)或不同质量浓度圣草次苷(终质量浓度为50、100、200、400 μg/mL)分别在37 ℃、5% CO2条件下培养24 h后,每孔加入10 μL CCK-8试剂孵育4 h,用酶标仪在450 nm波长处测定光密度(optical density,OD)值。设空白组(仅培养基)和正常组(无药物处理的细胞),细胞存活率按下式计算。

1.3.5 圣草次苷对H2O2诱导HUVEC细胞生长的保护 作用分析
取对数生长期HUVEC细胞,以5×103个/孔密度接种于96 孔板内,37 ℃、5% CO2条件下培养12 h,分别加入0.4 mol/L H2O2或/和不同质量浓度圣草次苷(50、100、200 μg/mL)。设正常对照组(无药物处理的细胞),仅添加H2O2处理作为模型组,同时添加H2O2和圣草次苷处理作为干预组,分别记作ERI-50、ERI-100和ERI-200组。培养24 h后,每孔加入10 μL的CCK-8试剂孵育4 h后,用酶标仪在450 nm波长处测定OD值,按1.3.4节公式计算细胞存活率,根据细胞存活率评价圣草次苷对H2O2诱导HUVEC细胞生长的保护作用。
细胞经过相应药物处理后,每组处理在荧光倒置显微镜100 倍亮视野下观察并拍照。
1.3.6 圣草次苷对H2O2诱导HUVEC细胞内ROS水平 影响的分析
取对数生长期HUVEC细胞接种于6 孔板中,接种密度为1×105个/mL,每孔2 mL,37 ℃、5% CO2条件下培养12 h,分别加入0.4 mol/L H2O2和不同质量浓度圣草次苷(50、100 μg/mL),设正常对照组(无药物处理的细胞)。按照1∶1 000用无血清培养液稀释ROS探针2’,7’-二氯荧光黄双乙酸盐(2’,7’-dichlorodihydrofluorescein diacetate,DCFH-DA),使其终浓度为10 μmol/L。吸去细胞中的细胞培养液,加入1 mL 10 μmol/L DCFH-DA,37 ℃、5% CO2孵育20 min,用无血清细胞培养液洗涤细胞3 次,用胰酶消化收集细胞,采用流式细胞仪检测细胞的ROS水平。ROS水平以DCFH荧光强度表示。
1.3.7 圣草次苷对H2O2诱导HUVEC细胞MDA水平 和抗氧化物酶系活力影响的分析
取对数生长期HUVEC细胞接种于6 孔板中,接种密度为1.0×105个/mL,每孔2 mL,37 ℃、5% CO2条件下培养12 h,分别加入0.4 mol/L H2O2和不同质量浓度圣草次苷(50、100 μg/mL),设空白组(仅培养基)和正常组(无药物处理的细胞)。吸去细胞培养液后,用pH 7.4磷酸缓冲液清洗细胞3 次,加入100 μL RIPA细胞裂解液,1 500×g、4 ℃离心10 min,收集上清液待测。按相应试剂盒说明书测定MDA含量及SOD、CAT、GSH-Px活力(均以每毫克蛋白计)。
1.3.8 圣草次苷对H2O2诱导HUVEC细胞蛋白表达影响的分析
取对数生长期HUVEC细胞接种于6 孔板中,接种 密度为1×105个/mL,每孔2 mL,37 ℃、5% CO2条件下培养12 h,按1.3.7节分组方法加药处理和裂解细胞后,将裂解液离心,收集上清液,采用BCA法检测蛋白浓度。配制质量分数10%分离胶和5%浓缩胶,上样,分离目的蛋白,采用半干法将目的蛋白电转至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,5%脱脂牛奶室温封闭1 h,将PVDF膜放入抗体Bax(体积比1∶5 000稀释)、Bcl-2(体积比1∶500稀释)和p53(体积比1∶1 000稀释)稀释液中4 ℃孵育过夜,加入二抗室温孵育1 h,暗室中加入超敏发光液1 mL与膜孵育1 min,吸进液体,曝光显影,采用ImageJ软件进行定量分析。
1.4 数据统计分析
采用SPSS 24软件进行数据统计分析,用方差分析进行显著性检验,采用Tukey法进行组间差异比较,结果以平均值±标准差表示,P<0.05为差异显著。
2 结果与分析
2.1 圣草次苷的合成及表征结果
以来源丰富、价廉的天然二氢黄酮类资源橙皮苷为原料,经吡啶在三氯化铝催化下发生去甲基反应得到圣草次苷(图2)。常规提取工艺需经过不同体积分数乙醇溶液纯化3 次,本研究仅需通过树脂分离、乙醇纯化1 次,再经过滤和干燥,即可得到圣草次苷质量分数为80%~98%的成品,与常规多步法提取相比,合成时间由常规提取的72 h缩短至48 h,产率由一般常规提取的40%~60%提高至75%以上,产品纯度由常规提取的70%~80%提高至80%~98%[14]。
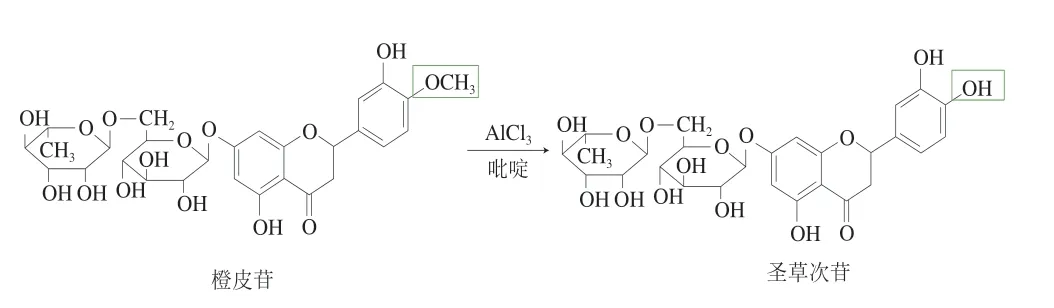
图2 圣草次苷合成的反应式Fig.2 Chemical reaction for synthesis of eriocidin
圣草次苷:黄色固体,产率83%,熔点为161~164 ℃。如图3所示,圣草次苷1H NMR(400 MHz,DMSO-d6)δ:12.06(s, 1H, 5-OH)、9.14(s, 1H, 4’-OH)、9.09(s, 1H, 3’-OH)、6.92(dd, 1H,J= 8.5, 2.5 Hz, 6’-H)、6.82(d, 1H,J=2.5 Hz, 2’-H)、6.78(d, 1H,J=8.5 Hz, 5’-H)、6.17(d, 1H,J= 2.3 Hz, 8-H)、6.14(d, 1H,J=2.4 Hz, 6-H)、5.46(d,J= 12.5 Hz, 1H, 2-H)、5.24(d,J=7.2 Hz, 1H, 1’’-H)、5.01(d,J=2.5 Hz, 1H, 1’’’-H)、4.75~3.15(m, 15H, 2”, 3”, 4”, 5”, 6”, 2’’’, 3’’’, 4’’’, 5’’’ -H)、3.12(dd,J= 16.5, 12.6 Hz, 3a-H)、2.75(dd,J=16.5, 3.0 Hz, 3b-H)、1.11(d,J=6.0 Hz, 3H, CH3);圣草次苷13C NMR(101 MHz,DMSO-d6)δ:197.61(4-C)、165.53(7-C)、163.50(5-C)、163.08(9-C)、146.24(4’-C)、145.64(3’-C)、129.74(1’-C)、118.50(6’-C)、115.88(2’-C)、114.89(5’-C)、101.06(10-C)、96.78(1’’’-C)、96.05(1’’-C)、79.15(6-C)、 79.06(8-C)、76.73(2-C)、75.97(3’’-C)、73.46 (5’’-C)、72.54(2’’-C)、71.20(4’’-C)、70.73(3’’’-C)、 70.0(2’’’-C)、68.78(4’’-C)、66.51(5’’’-C)、 60.23(6’’-C)、42.75(3-C)、18.28(6’’’-C)。以上数据与文献[15-16]报道基本一致,故鉴定合成化合物为圣草次苷。

图3 化学合成圣草次苷的1H NMR(A)和13C NMR(B)谱图Fig.3 1H NMR (A) and 13C NMR (B) spectra of the synthetic eriocidin
2.2 圣草次苷对HUVEC细胞的毒性作用及其对H2O2 诱导HUVEC细胞生长的保护作用
CCK-8是一种广泛应用于细胞生长和细胞毒性的快速高灵敏度检测方法,其检测原理为2-(2-甲氧基-4-硝苯基)-3-(4-硝苯基)-5-(2,4-二磺基苯)-2H-四唑单钠盐在电子载体1-甲氧基-5-甲基吩嗪硫酸二甲酯作用下被细胞线粒体中脱氢酶还原为具有高度水溶性的黄色甲臜产物,在450 nm波长处有最大吸收峰[17]。由图4A可知,与正常组(圣草次苷质量浓度0 μg/mL)相比,不同质量浓度圣草次苷作用HUVEC细胞24 h后,细胞存活率显著增加 (P<0.05),其中50 μg/mL圣草次苷促细胞生长效果最好,随圣草次苷质量浓度的增加,促生长作用有所减弱。结果表明,50~400 μg/mL质量浓度范围内的圣草次苷对HUVEC细胞无毒性作用。因此,选取50、100、200 μg/mL圣草次苷研究其对H2O2诱导HUVEC细胞生长的影响。

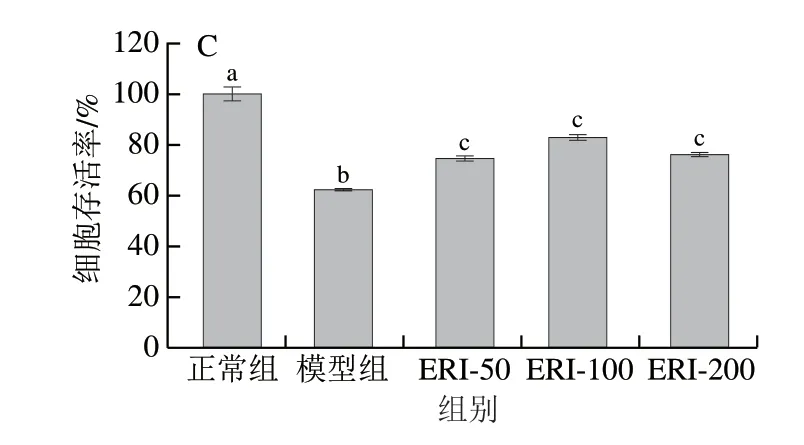
图4 H2O2和圣草次苷对HUVEC细胞生长的影响Fig.4 Effects of H2O2 and eriocitrin on the growth of HUVEC cells
氧化应激是一种自由基积累过多导致的负面作用,会使健康细胞损伤和死亡。细胞存活率是反映氧化还原失衡环境对细胞损伤和死亡程度的最直观指标,因此,细胞存活率下降是氧化应激模型建立成功的重要标志之一[18]。如图4B所示,HUVEC细胞存活率随着H2O2浓度的增加而降低,当H2O2浓度不超过0.4 mol/L时,其对HUVEC细胞损伤不明显,细胞存活率仍在80%以上;当H2O2浓度为0.4 mol/L以上时,其对HUVEC细胞损伤明显增强;当H2O2浓度为1.4 mol/L时,细胞存活率低于40%,表明成功构建了H2O2诱导HUVEC细胞氧化应激模型。本实验主要研究圣草次苷在自然衰老模型中对血管内皮细胞的保护作用,H2O2浓度太高会导致细胞损伤严重难以恢复,因此,选取0.4 mol/L H2O2刺激HUVEC细胞建立氧化损伤模型。
由图4C可知,与模型组相比,50、100、200 μg/mL圣草次苷处理均可显著提高细胞存活率(P<0.05),100 μg/mL圣草次苷对H2O2致HUVEC细胞氧化损伤的保护作用最强,但剂量效应不明显。这与细胞形态学所观察到的结果一致(图5)。正常组HUVEC细胞呈棱形,贴壁紧密,生长良好;H2O2处理后细胞皱缩,呈圆形或椭圆形,且贴壁不紧密,与正常组相比,细胞 间距增加,细胞数量明显减少。不同质量浓度圣草次苷 与H2O2同时处理HUVEC细胞24 h后,大多细胞呈棱形,形态正常,与模型组相比细胞数量明显增多。综合以上结果,选取50、100 μg/mL圣草次苷进行后续实验。

图5 圣草次苷对H2O2诱导的HUVEC细胞形态的影响(×100)Fig.5 Effect of eriocitrin on the morphology of HUVEC cells treated with H2O2 (× 100)
2.3 圣草次苷对H2O2诱导HUVEC细胞内ROS水平的影响
ROS由烟酰胺腺嘌呤二核苷酸磷酸氧化酶、脂氧化酶或环氧化酶还原形成[19]。当机体受到外界胁迫时,ROS可以作为信号分子调节生物学和生理过程以缓解胁迫,细胞分化、组织再生和防止衰老等细胞过程都需要ROS作为氧化还原信号参与[20]。然而,高水平的ROS引起氧化还原状态失衡及细胞DNA、脂质和蛋白质破坏[21]。 ROS探针DCFH-DA进入细胞后水解成DCFH,被细胞内ROS氧化发出荧光,胞内ROS水平与其荧光强度成正比。由图6可知,与正常组相比,暴露在H2O2环境下HUVEC细胞内ROS水平显著升高(P<0.05);采用圣草次苷和H2O2共培养HUVEC细胞,细胞的ROS水平较模型组显著降低(P<0.05),表明圣草次苷能通过阻止H2O2诱导胞内ROS水平升高,减轻ROS对HUVEC细胞造成的氧化损伤。

图6 圣草次苷对H2O2诱导HUVEC细胞ROS水平的影响Fig.6 Effect of eriocitrin on ROS level in HUVEC cells induced by H2O2
2.4 圣草次苷对H2O2诱导HUVEC细胞MDA含量的影响
暴露于臭氧、氮氧化物、高氧和某些异质生物等环境可能会促使生物膜的多不饱和脂肪酸脂质过氧化,促进MDA等脂质过氧化物的产生。细胞内的MDA由细胞膜磷脂中类似的脂肪酰基过氧化物分解而产生,也是前列腺素合成中环氧合酶反应的产物[22]。由图7可知,与正常组相比,H2O2刺激HUVEC细胞的MDA含量显著上升(P<0.05);与模型组相比,50、100 μg/mL圣草次苷均显著降低了氧化应激模型细胞MDA含量的上升 (P<0.05),且呈现剂量依赖性。模型组MDA含量显著升高表明HUVEC细胞受到H2O2刺激后,细胞膜发生严重脂质氧化损伤;而圣草次苷显著降低细胞MDA含量,表明圣草次苷能减轻H2O2引发的脂质氧化作用,对抗氧化应激损伤。


图7 圣草次苷对H2O2诱导HUVEC细胞MDA含量的影响Fig.7 Effect of eriocitrin on MDA content in HUVEC cells induced by H2O2
2.5 圣草次苷对H2O2诱导HUVEC细胞抗氧化物酶系 活力的影响
SOD、CAT和GSH-Px等抗氧化酶组成了机体的抗氧化酶系,一旦机体氧化还原平衡失衡,抗氧化酶系统催化抗氧化反应以抵御外界氧化应激刺激原,避免组织和细胞遭受过氧化物损害[23]。抗氧化酶系统通过将能量代谢产生的电子传递给ROS发挥抗氧化活性。当体内氧化胁迫较弱时,抗氧化系统能有效发挥电子传递作用,使细胞完成抗氧化反应。然而,当细胞氧化胁迫较强,体内ROS短期内大量增加,细胞就需要通过外源抗氧化剂获得更强的抗氧化能力[24]。由图8可知,与正常组相比,模型组的GSH-Px、CAT、SOD活力显著降低 (P<0.05);与模型组相比,50、100 μg/mL圣草次苷显著抑制了H2O2引起的HUVEC细胞中GSH-Px、CAT、SOD活力的下降(P<0.05),且呈明显剂量效应。结果表明,H2O2降低HUVEC胞内抗氧化酶系活力,破坏了细胞的氧化应激动态平衡,从而引起细胞氧化损伤,HUVEC细胞氧化应激模型构建成功;而在圣草次苷与H2O2联合培养HUVEC细胞24 h后,细胞抗氧化物酶系活力的下降趋势得到明显缓解,表明圣草次苷能减轻H2O2对细胞抗氧化物酶系的破坏作用,提高了细胞的氧化应激调控能力,从而减轻了细胞的氧化损伤。
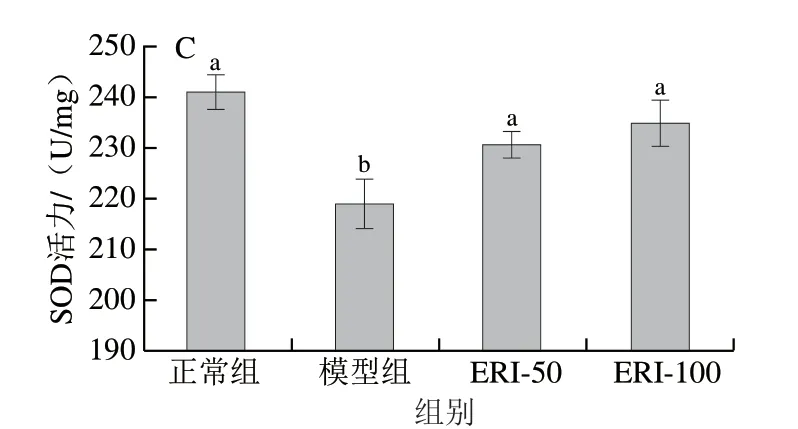
图8 圣草次苷对H2O2诱导HUVEC细胞抗氧化物酶系活力的影响Fig.8 Effect of eriocitrin on the activity of antioxidant enzymes in HUVEC cells induced by H2O2
2.6 圣草次苷对H2O2诱导HUVEC细胞Bax、Bcl-2和p53蛋白表达的影响
抗凋亡蛋白Bcl-2和促凋亡蛋白Bax在细胞凋亡过程中扮演重要角色,Bcl-2/Bax比值与细胞凋亡的发生与发展密切相关。p53蛋白可介导DNA损伤后发生的细胞应激反应,参与DNA损伤修复和细胞周期运行等活动。正常细胞内Bax和p53蛋白含量较低,Bcl-2蛋白含量较高。当外界环境刺激损伤细胞DNA时,胞内Bax和p53表达量上升,Bcl-2表达量下降,细胞努力自我修复损伤的DNA,若无法修复,细胞则发生死亡[25]。由图9可知,与正常组相比,模型组的Bax和p53蛋白相对表达量显著增加 (P<0.05),Bcl-2蛋白相对表达量降低,Bcl-2/Bax比值显著降低(P<0.05);与模型组相比,50、100 μg/mL 圣草次苷处理组中Bax和p53蛋白表达量均显著降低 (P<0.05),Bcl-2蛋白表达量显著升高,Bcl-2/Bax比值显著升高(P<0.05),具有剂量依赖效应。
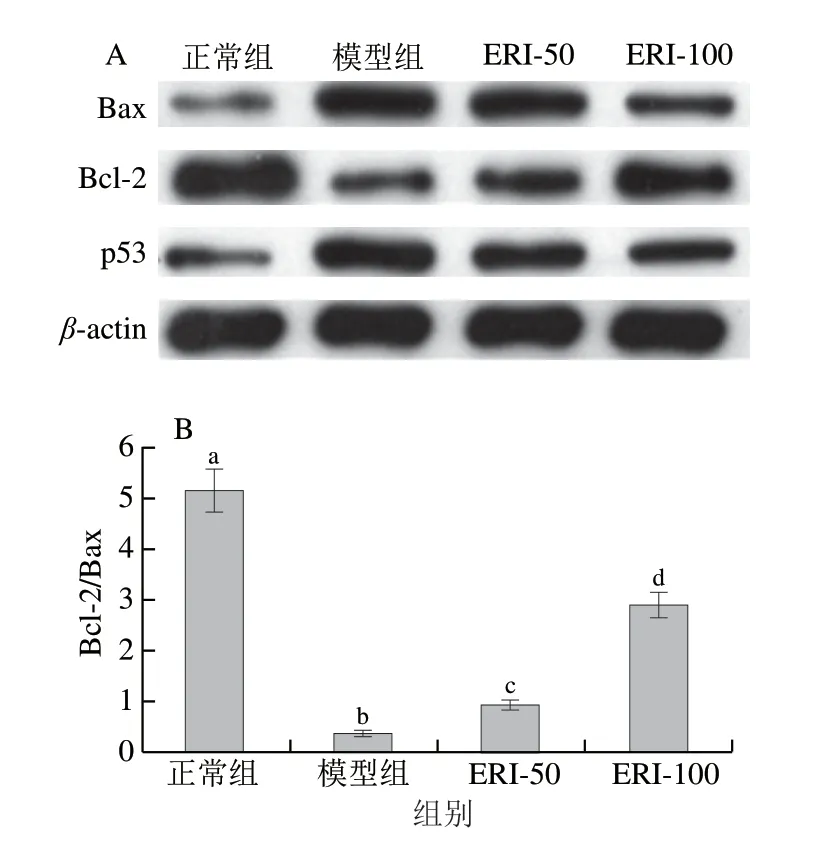
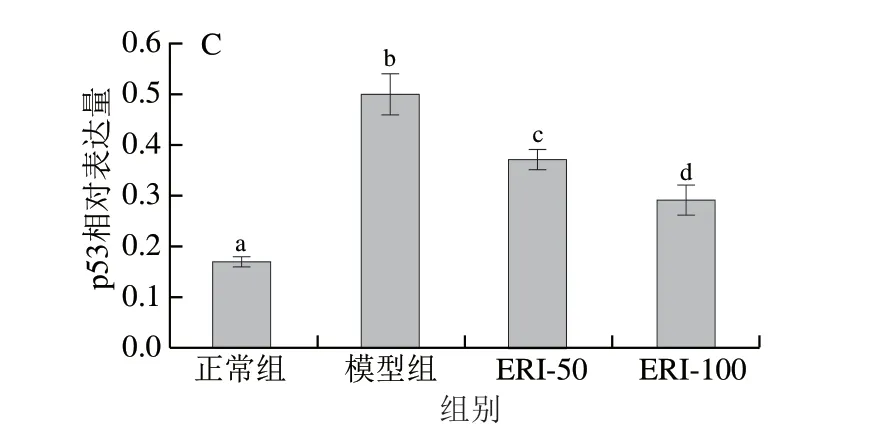
图9 圣草次苷对HUVEC细胞中Bcl-2、Bax和p53蛋白表达的影响Fig.9 Effect of eriocitrin on Bax/Bcl-2 ratio and p53 protein expression in HUVEC cells
3 讨 论
H2O2是一种重要的ROS分子,常作为体外氧化应激损伤的造模药物,氧化应激引起的血管内皮细胞损伤是动脉粥样硬化形成的重要发病机制之一,可导致血管内皮细胞氧化损伤和功能障碍[26-27]。本研究采用橙皮苷制备圣草次苷,构建了HUVEC细胞H2O2氧化应激损伤模型,研究圣草次苷对HUVEC细胞氧化损伤的保护作用,并对其抗氧化损伤作用机制进行了探讨。研究发现,圣草次苷明显缓解了H2O2对HUVEC细胞造成的氧化损伤,这种保护作用至少可以持续24 h,且50~400 μg/mL质量浓度范围内圣草次苷对HUVEC细胞没有明显的细胞毒性作用,表明圣草次苷具有较好的预防和治疗内皮细胞损伤的潜力。
ROS属于体内高活性分子,可由机体新陈代谢产生,过量的ROS会升高脂质过氧化产物MDA水平。机体抗氧化酶(SOD、CAT和GSH-Px)是人体抗氧化天然防御系统的重要组成部分[28]。本研究结果显示,圣草次苷可明显降低H2O2诱导氧化应激HUVEC细胞的ROS水平和MDA含量,提高GSH-Px、SOD和CAT活力,提示圣草次苷可以提高机体清除氧自由基效率和抗氧化能力,减轻HUVEC细胞受到氧化应激损伤。
细胞氧化还原状态也是细胞凋亡执行的“开关”。促凋亡蛋白Bax与抗凋亡蛋白Bcl-2是调节细胞凋亡的主要参与者和解码者,通过调节氧化还原平衡状态实现对细胞凋亡的控制[29]。在氧化应激条件下,p53蛋白能够与线粒体基质中的亲环素D形成复合物,使线粒体膜通透性转换孔打开,引起线粒体内容物释放,最终导致细胞坏死[30]。一般,p53与Bax的表达变化趋势一致。抗氧化剂N-乙酰半胱氨酸促进Bcl-2表达,但同时抑制Bax和p53表达。然而,也存在p53与Bax表达水平不一致的特殊情况,例如,抗氧化剂二硫代氨基甲酸吡咯烷促进Bax表达以抵抗Bcl-2的作用,而对p53的影响较小[31]。本研究采用Western blotting法分析HUVEC细胞中Bax、Bcl-2和p53蛋白表达情况。结果表明,模型组中H2O2能下调Bcl-2表达和Bcl-2/Bax比值,上调p53和Bax蛋白表达;与模型组相比,圣草次苷能上调Bcl-2表达和Bcl-2/Bax比值,下调p53和Bax蛋白表达,说明圣草次苷对p53与Bax蛋白表达的影响趋势基本一致。综上所述,圣草次苷对H2O2诱导的HUVEC细胞氧化应激损伤具有一定的保护作用,其机制可能与提高自由基清除能力和抑制细胞凋亡有关。
4 结 论
本实验采用的合成方法能有效简化传统圣草次苷提取纯化工艺,提高圣草次苷得率和纯度。圣草次苷对氧化应激损伤HUVEC细胞具有良好的保护作用,主要是通过降低细胞MDA含量、提高抗氧化酶系活力、上调Bcl-2/Bax 比值和下调p53表达来抑制氧化应激和细胞死亡。本研究为圣草次苷作为功能性营养添加剂在心血管疾病防治中的应用提供了理论参考。若将具有较好抗氧化作用且对HUVEC细胞无毒性作用的活性物质与圣草次苷协同使用,可能会更好地缓解内皮细胞抗氧化应激损伤。心血管疾病发生发病机理复杂,需要进一步采用体内实验和验证性临床实验探讨圣草次苷对血管的保护作用。
