增鲜剂5’-肌苷酸二钠恶化老龄db/db小鼠 脂质代谢紊乱的分子机制
2021-08-31姜允嘉刘金艳许赛君
姜允嘉,刘金艳,许赛君,王 洋,张 彬,成 钟,许 扬,谢 勇*
(中国医学科学院/北京协和医学院药用植物研究所,中草药物质基础与资源利用教育部重点实验室,北京 100193)
5’-肌苷酸(inosine 5’-monphosphate,IMP)是让人体感知鲜味特性的主要物质之一,具有呈味作用稳定持久的优点,容易分离提取,pH 7.5环境结晶的IMP为二钠盐。GB 2760—1996《食品添加剂使用卫生标准》规定,IMP二钠盐可在各类食品中按生产需要适量使用。添加5%~12% IMP二钠盐并与谷氨酸钠混合使用,其呈味作用较单独使用谷氨酸钠高约8 倍,IMP二钠盐有“强力味精”之称,是日常生活中所用豆瓣酱、酱油、鸡精等调味品的主要成分之一。在生物体内,IMP是嘌呤核苷酸从头合成途径中最先合成的化合物,是合成腺苷酸基琥珀酸(S-AMP)、鸟苷酸等的前体[1], 这些化合物具有调节细胞代谢、能量迁移、增殖、死亡和DNA、RNA合成等功能[2]。S-AMP是嘌呤核苷酸从头合成途径中IMP的下一个产物,也是一种天然胰岛素分泌促进剂[3]。王楠等[4]基于酶促动力学,以IMP为原料实现了S-AMP大量合成;王洋等[5]研究发现S-AMP和一磷酸腺苷(adenosine 5’-monophosphate,AMP)活化蛋白激酶(AMP-activated protein kinase,AMPK)形成复合体后促进AMPK活化,降低饮食诱导的高血脂症小鼠肝内脂质蓄积和血脂浓度,可作为治疗非酒精性脂肪肝的先导化合物开展成药性研究。IMP和S-AMP均为AMP的分子结构类似物,由此推测IMP可能也具有活化AMPK提高糖脂代谢效率而改善糖脂代谢紊乱疾病的功能,且IMP与AMP的分子结构相似度高于S-AMP,因此,IMP可能较S-AMP更具有药物或功能性食品的开发前景。然而,目前鲜有相关研究成果报道。C57/KsJ-db/db(简称db/db)小鼠是一种长期罹患严重糖尿病和高血脂症的模式动物。为深入了解IMP活化AMPK后引起小鼠等模式动物的代谢变化规律并探讨IMP是否具有保健功能或食品安全隐患,本研究对6 月龄自发性糖尿病db/db小鼠灌胃IMP 8 周,分析小鼠生理学指标变化和作用机制,为全面理解IMP等嘌呤核苷酸的生物学功能提供基础生物学领域研究证据。
1 材料与方法
1.1 材料、动物与试剂
HepG2细胞由国家实验细胞资源共享服务平台提供;大肠杆菌质粒pET-21a由本实验室保存。
SPF级db/db小鼠和C57/BL/6j(简称C57)小鼠购自北京维通利华实验动物技术有限公司(生产许可证号:SCΧK(京)2019-0001),在中国医学科学院药用植物研究所SPF动物房内按照实验动物饲养规程饲养和给药(使用许可证号:SYXK(京)2017-0020,有效期2017年 6月16日至2022年6月16日)。
IMP(食品级) 希杰(聊城)生物技术有限公司;尿酸(uric acid,UA)、碱性磷酸酶(alkaline phosphatase,ALP)、谷草转氨酶(aspartate aminotransferase,AST)、谷丙转氨酶(alanine aminotransferase,ALT)、乳酸脱氢酶(lactate dehydrogenase,LDH)检测试剂盒 美国Abcam公司;乙酰辅酶A羧化酶(acetyl CoA carboxylase,ACC)、磷酸化ACC1(phospho-ACC1,p-ACC1)、p-ACC2、甘油三酯水解酶(adipose triglyceride lipase,ATGL)、AMPK、p-AMPK等一抗 美国Cell-Signal Technology公司;二抗辣根过氧化物酶-山羊抗兔免疫球蛋白G(H+L)、 青霉素-链霉素 北京博奥龙免疫技术有限公司;蛋白质电泳分离胶(聚丙烯酰胺质量分数4%~12%递增) 南京金瑞斯生物科技有限公司;PrimeScrip RT MasterMix反转录试剂盒、SYBR Premix ExTaq实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qRT-PCR)试剂盒 日本Takara公司;DMEM低糖培养基、磷酸盐缓冲液(phosphate buffered saline,PBS)、0.25%胰蛋白酶(25 g胰蛋白酶溶于0.975 L的PBS) 美国HyClone公司;胎牛血清(fetal bovine serum,FBS) 美国Gibio Life Technologies公司;油酸、洛伐他汀等试剂 美国Sigma-Aldrich公司;bodipy 493/503中性脂质染色剂 美国Thermo Fisher公司;乙酰辅酶A含量测定试剂盒 上海索桥生物科技有限公司;活性氧(reactive oxygen species,ROS)红色荧光染料MitoSOΧ Red 美国Molecular Probes公司;血糖仪及配套血糖试纸 美国Roche公司。
1.2 仪器与设备
FortéBio型表面等离子共振(surface plasma resonance,SPR)仪 美国Pioneer公司;AU480型全自动生化仪 美国Beckman公司;M1000型多功能连续 波长分光光度计 瑞士Tecan公司;IΧ51型荧光倒置显微镜 日本Olympus公司;LightCycler® 96 SW 1.1型qPCR仪 美国Roche公司。
1.3 方法
1.3.1 实验小鼠的药物处理及分组
称取一定量IMP,配制为pH 7.5的饱和水溶液,置于4 ℃冰箱内12 h重结晶,回收晶体,于70 ℃恒温箱中干燥48 h,准确称量,配制成50 mg/mL水溶液。
挑选6 月龄、空腹血糖浓度约15 mmol/L、体质量52~64 g的雄性db/db小鼠,分为两组,每组10 只。设定未给药小鼠为模型组,另一组为给药组,按剂量 50 mg/(kgmb·d)灌胃IMP溶液,连续给药8 周。以月龄相同的雄性C57小鼠5 只作为正常对照组,全部小鼠均使用正常饲料喂养。给药开始后每隔7 d用电子天平称量小鼠体质量,并测定小鼠空腹血糖浓度,每次测定前小鼠禁食12 h,剪尾法取血,将血糖试纸安装在血糖仪中,添加约20 μL血液到血糖试纸的进样口内,记录血糖仪上显示的血糖浓度。
1.3.2 小鼠生理学指标测定
给药8 周后,小鼠禁食16 h后进行取样。收集小鼠尿液,按照UA检测试剂盒说明书步骤测定UA浓度。采集小鼠血清,用相应检测试剂盒分别测定血清ALP、AST、ALT、LDH活力;用全自动生化仪测定血清甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白(high-density lipoprotein,HDL)、低密度脂蛋白(low-density lipoprotein,LDL)浓度。
采集血样后立即处死小鼠,取心脏、肝脏和肾脏,收集的小鼠器官用10%福尔马林溶液固定后石蜡包埋,切片。肝组织切片用苏木精-伊红(hematoxylin-eosin,HE)染色后用油红O复染,心肌切片分别用天狼猩红和油红O染色,肾脏组织切片分别用HE染色和过碘酸-希夫(periodic acid-Schiff,PAS)染色后用显微镜观察并拍照保存。剩余小鼠器官样品于-80 ℃冰箱中冻存。
1.3.3 IMP与AMPKγ1亚基的分子互作分析
根据文献[6]报道的蛋白质表达和纯化方法利用大肠杆菌质粒pET-21a表达人源AMPKγ1亚基(NCBI参考序号:NP_002724.1)。室温下利用SPR仪按照王洋等[5]的方法进行IMP和AMPKγ1亚基相互作用分析。用分子对接方法预测IMP-AMPKγ1亚基复合体的三维结构,以AMPK-AMP复合体结构(PDB登录号:4EAI)[6]为受体分子,利用Pymol软件(http://www.pymol.org)确定AMPK结合部位中与小分子形成氢键的氨基酸。分别将AMPK结构和小分子IMP导入Autodock分子对接软件中,利用Autodock Tools计算Gasteiger电荷,添加原子类型得到其坐标文件,对配体小分子IMP加极性氢、计算电荷、确定扭矩中心、选择可旋转的键得到其坐标文件。设定对接的格点参数文件,格点间距设置为0.375 Å,结合空间大小为40 Å×40 Å×40 Å,以保证配体完全处在酶活性中心范围内,然后设定对接参数文件,利用半柔性对接方法进行分子动力学稳定性计算,使用拉马克遗传算法,算法对接轮数设置为50,其他参数取默认值,利用Autodock 4软件计算出IMP-AMPK复合体的空间结构。
1.3.4 肝脏蛋白免疫印迹分析
小鼠肝组织加入含有蛋白酶抑制剂和磷酸酶抑制剂的RIPA细胞裂解液,用手术剪尽量剪碎后用超声波破碎细胞,离心取上清,采用BCA蛋白定量法测定蛋白浓度,制备十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分析样品。按照Wu Chongming等[7]所述条件进行蛋白免疫印迹分析。
1.3.5 qPCR分析脂质代谢通路中蛋白mRNA相对表达量
提取各组小鼠肝组织的总RNA并测定其浓度,随即使用反转录试剂盒将总RNA反转录为cDNA文库。采用qPCR法测定脂蛋白脂肪酶(lipoprotein lipase,LPL)、脂肪酸合酶(fatty acid synthase,FASN)、肉毒碱棕榈酰基转移酶1A(carnitine palmitoyltransferase 1A,CPT1A)、固醇酰辅酶A脱氢酶1(stearyl coenzyme A dehydrogenase 1,SCD1)的mRNA相对表达量。反应体系:SYBR Premix ExTaqqPCR试剂盒中的Supermix试剂6.25 μL,正向引物、反向引物溶液(10 μmol/L)各0.25 μL,cDNA 200 ng,添加ddH2O至总体积12.5 μL。反应条件:95 ℃变性10 min,95 ℃退火15 s,60 ℃延伸30 s,扩增40 个循环。选择18S rRNA为内参基因,采用2-ΔΔCt法计算目的基因相对表达量。扩增基因引物由上海捷瑞生物技术公司合成,引物序列如表1所示。

表1 IMP与AMPKγ1亚基相互作用参数Table 1 Parameters of interaction between IMP and AMPKγ1 subunit

表1 qRT-PCR引物序列Table 1 Primer sequences for quantitative real-time polymerase chain reaction used in this study
1.3.6 IMP的体外降脂活性实验
5% CO2的细胞培养箱中用含有1%青霉素-链霉素和10% FBS的DMEM低糖培养基于37 ℃培养HepG2细胞,铺96 孔板,细胞数约为1×104个/孔,分为对照组、模型组、阳性对照组和给药组。IMP、洛伐他汀和油酸溶液均用上述培养HepG2细胞的培养基溶液配制。以100 μmol/L油酸100 μL诱导形成脂质蓄积细胞,作为模型组。油酸造模同时给药,加入100 μL的10 μmol/L IMP为给药组,以加入100 μL的10 μmol/L洛伐他汀为阳性对照组,于含有5% CO2的细胞培养箱中37 ℃培养24 h后用100 μL的4%多聚甲醛固定细胞,加入100 μL 2 μmol/L bodipy 493/503染色,用荧光倒置显微镜观察并记录细胞内脂质蓄积情况。
HepG2细胞按上述方法分组并给药处理后,弃去培养基,每孔加入含5 μmol/L MitoSOΧ Red的DMEM基础培养基,细胞培养箱内37 ℃避光培养30 min,用PBS清洗3 次,再加入DMEM基础培养基,用荧光倒置显微镜观察细胞ROS蓄积情况。
1.3.7 乙酰辅酶A含量测定
准确称取小鼠心、肝组织,按照0.1 g组织加入1 mL RIPA裂解液,于冰浴下匀浆破碎细胞,4 ℃、16 000×g离心20 min,取上清液,待测。按照试剂盒所述方法配制工作液,取工作液92 μL和样品溶液10 μL混匀后开始计时,于混匀后20 s和80 s时测定反应体系340 nm波长处吸光度。乙酰辅酶A的总量按如下公式计算。
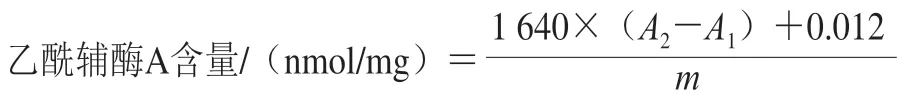
式中:A1、A2分别为混匀后20 s和80 s时反应体系340 nm波长处吸光度;m为组织样品质量/mg。
1.4 数据处理与分析
使用GraphPad Prism 5.0软件进行数据统计分析,结果以平均值±标准差表示,采用单因素方差分析、Tukey’s检验或Newman-Kueuls检验分析组间差异,P<0.05表示有显著性差异。
2 结果与分析
2.1 IMP处理db/db小鼠的生理学指标
由图1可知,给药期间模型组db/db小鼠体质量高度显著高于正常对照组C57小鼠(P<0.001),且各组小鼠体质量均无明显变化(图1A)。给药前模型组db/db小鼠空腹血糖浓度(>15 mmol/L)约为C57小鼠的3 倍,表明其患有严重的糖尿病,IMP给药期间给药组小鼠空腹血糖浓度较模型组小鼠显著降低(P<0.05),但依然为高血糖水平(>10 mmol/L),可以认为IMP降糖活性较弱(图1B)。给药结束后,正常对照组小鼠尿液中UA浓度最高,模型组小鼠次之,IMP给药后db/db小鼠尿液UA浓度最低,但与模型组差异性不显著(图1C)。与模型组相比,给药组小鼠血清TC浓度显著升高(P<0.05),HDL浓度极显著升高(P<0.01),TG和LDL浓度虽有所升高,但两组间差异不显著(图1D)。由图1E~H可知,与模型组相比,给药组小鼠ALP、AST、ALT和LDH活力均显著上升(P<0.05、P<0.01、P<0.001)。AST/ALT活力比值大于1,表明肝脏受到实质损害[8],ALP、LDH活力显著升高,表明发生了肝硬化[9]。



图1 IMP给药结束后各组小鼠的生理学指标Fig.1 Physiological indicators of mice in each group after IMP administration
Manne等[10]通过观察小鼠肝组织形态发现,即使是C57小鼠,随着年龄增长肝组织也会出现脂质蓄积,可能患有轻度非酒精性脂肪肝。由图2可知,本实验中,与正常对照组C57小鼠相比,模型组db/db小鼠肝组织中呈现大量脂肪颗粒,表明微泡脂肪变性并发脂质蓄积,脂肪肝程度明显加重,而给药组小鼠肝组织脂肪颗粒较模型组更多,此现象和小鼠血清脂质含量的变化趋势 (图1D)一致,表明IMP给药后反而加重了db/db小鼠肝脏内脂质蓄积。对比各组小鼠心肌组织形态,天狼猩红染色结果表明IMP未对心肌造成明显损伤,油红O染色结果表明模型组和给药组小鼠心肌组织内脂质蓄积较正常对照组严重,IMP给药后没有发生明显变化。肾脏组织HE染色结果表明,各组小鼠肾脏组织没有发生明显改变,而PAS染色结果显示,IMP给药后db/db小鼠肾小球内有糖含量降低的现象,这与IMP有一定降糖效果一致。这些结果证明,IMP给药后反而加重了db/db小鼠脂质代谢紊乱症状,并造成了更严重的肝损伤,但对心脏和肾脏没有造成损伤,血糖与UA浓度的降低表明对肾脏有保护作用[11]。以上研究结果显示IMP损伤的靶器官为肝脏。
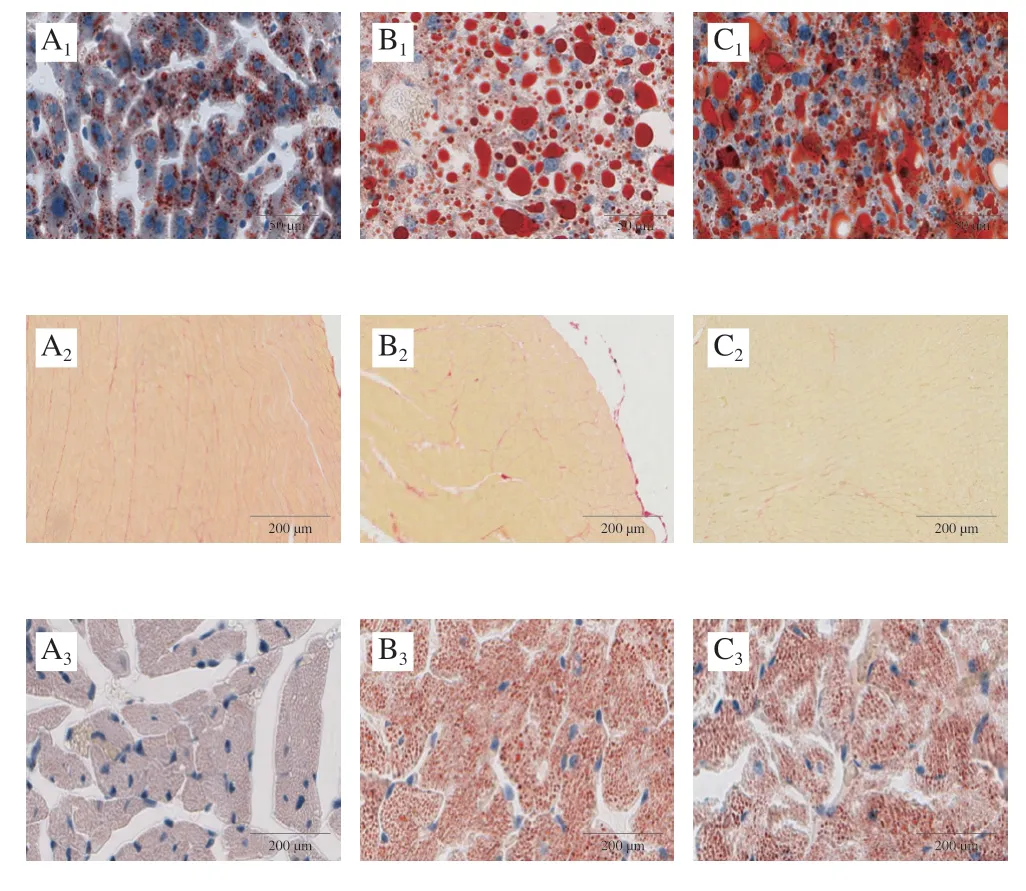
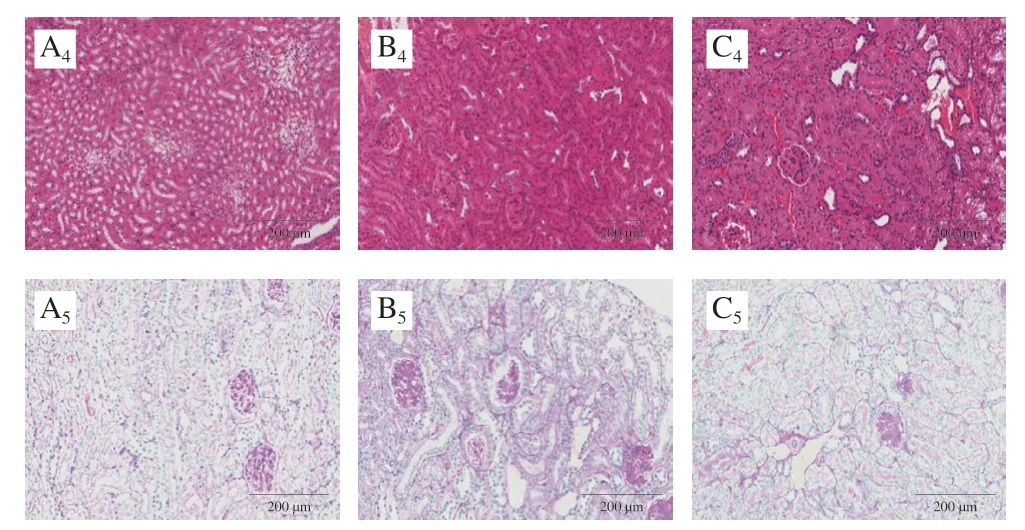
图2 IMP给药后各组小鼠肝脏、心脏和肾脏组织形态Fig.2 Histological morphology of liver, heart, and kidney in each group of mice after IMP administration
2.2 IMP-AMPK相互作用结果
SPR分析可显示小分子和靶标蛋白相互作用过程中靶蛋白分子质量随时间的变化,响应值的变化趋势可直观显示分子间结合和解离[7]。如图3A所示,IMP和AMPKγ1亚基瞬间结合,在SPR整个测试周期(300 s)内没有显示解离,这与S-AMP与AMPKγ1亚基相互作用时产生的SPR信号相似,但与AMP和AMPKγ1亚基相互作用产生的SPR信号[5]不同。由 表1可知,AMP与AMPKγ1亚基形成复合体的KD值为 (174±3)μmol/L,S-AMP与AMPKγ1亚基形成复合体的KD值为(12.0±0.2)μmol/L[5],而IMP-AMPKγ1亚基复合体KD值为(211±4)μmol/L,明显高于AMP和S-AMP,但IMP与AMPKγ1亚基结合后形成的复合体稳定性仍较弱,但由于AMPKγ1亚基具有4 个结合位点[12], 每个位点都能与IMP实现瞬间结合和解离,因此宏观来看,IMP和AMPKγ1亚基在一定时间内能够形成稳定复合体,因此监测到的响应值与IMP浓度呈正相关。此外,分子对接计算结果显示IMP结合在AMPKγ1亚基中AMP结合位点时的最佳结合能为-28.368 kJ/mol,得到的 IMP-AMPKγ1亚基复合体结构中IMP的构型与AMP-AMPKγ1复合体结构中AMP构型相同,且可能形成更多氢键 (图3B),这些结果证明IMP和AMPK可以形成复合体。
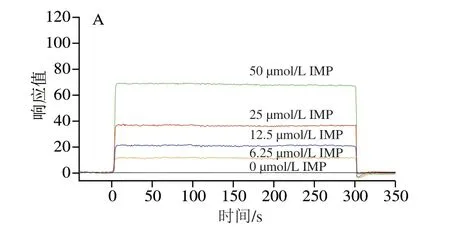

图3 IMP和AMPK的分子互作结果Fig.3 IMP interacted with AMPK
2.3 脂质代谢通路中蛋白相对表达量
人体细胞内AMPK是糖脂代谢通路中的关键蛋白,AMP或AMP结构类似物与AMPKγ亚基结合后,其α亚基Thr172位点被磷酸化,磷酸化的AMPK诱导活化糖、脂质等代谢通路,AMPK的磷酸化水平反映了其活性的高低[13]。由图4A~C可知,与模型组相比,IMP和AMPKγ亚基形成复合体可提高db/db小鼠肝脏细胞内AMPK磷酸化水平,给药组小鼠在AMPK活化的下游脂质代谢通路中ATGL相对表达量与模型组相比也无显著变化,表明肝脏细胞内蓄积脂肪的分解没有被促进[14],因此IMP不能促进脂肪分解为脂肪酸。ACC包含ACC1和ACC2两种亚型[15], ACC1分布于胞质中,可催化长链脂肪酸的合成[16],ACC2分布于线粒体膜上,其磷酸化水平上升表明细胞内脂肪酸氧化被促进[17]。与模型组相比,IMP使小鼠肝脏总ACC表达量极显著升高(P<0.01),ACC1和ACC2的磷酸化水平提高,由此可见,IMP和AMPK形成复合体后显著提高小鼠肝脏内脂肪酸氧化。
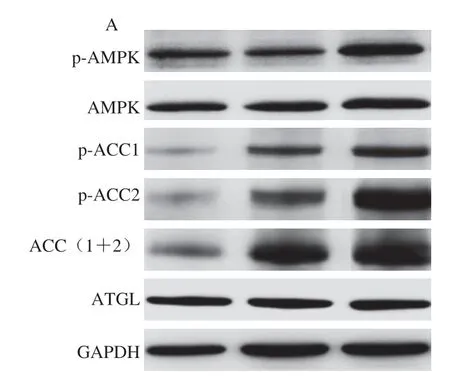
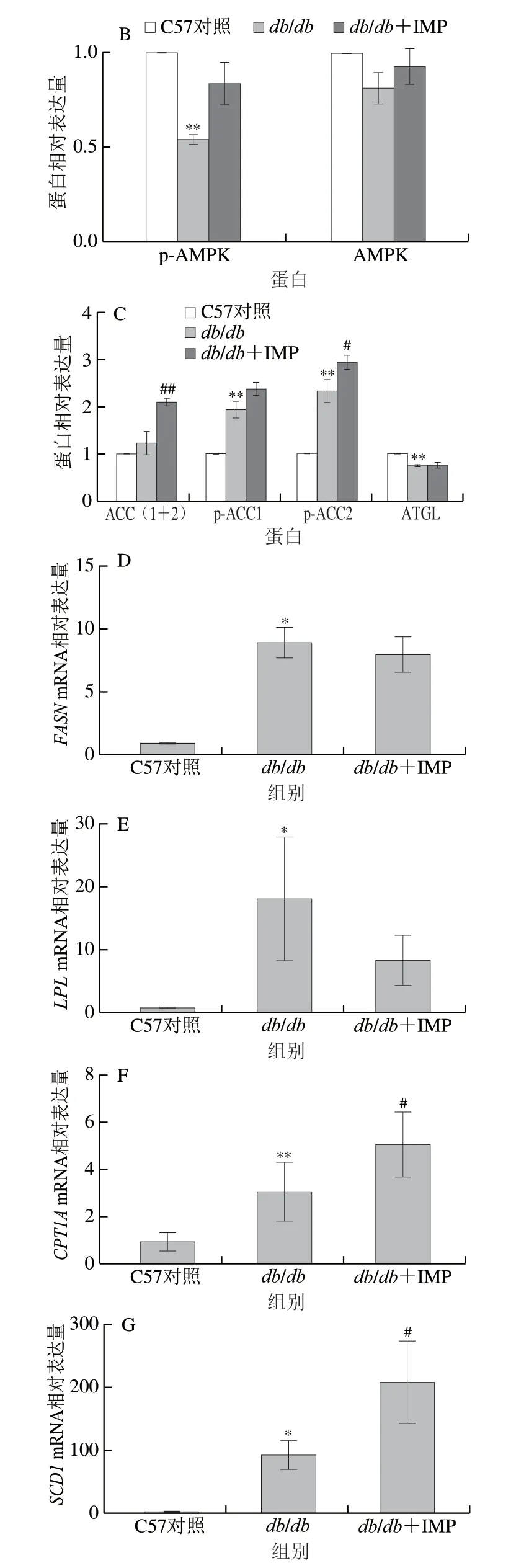
图4 各组小鼠肝脏内脂肪分解相关蛋白相对表达量Fig.4 Relative expression levels of proteins related to lipolysis in mice
FASN、LPL、CPT1A和SCD1是脂质代谢通路中的限速酶[18]。由图4D~G可知,与模型组相比,IMP可显著提高db/db小鼠CPT1A和SCD1mRNA表达量 (P<0.05),CPT1A催化长链脂肪酸由胞浆转移到线粒体氧化[19],SCD1催化饱和脂肪酸转化为不饱和脂肪酸,促进脂肪酸分解[20],这两种基因表达水平的增加表明IMP促进了线粒体内脂肪酸氧化。与正常对照组相比,模型组小鼠FASN和LPLmRNA表达量均显著升高(P<0.05),IMP给药后db/db小鼠FASN和LPLmRNA表达量较模型组降低,但组间无显著性差异。FASN催化乙酰辅酶A从头合成棕榈酸酯的全过程,是造成脂质蓄积的重要蛋 白质[21],LPL催化TG水解[22],二者mRNA表达量降低表明肝内脂肪蓄积和分解被干扰,发生了更严重的脂质代谢紊乱,这与IMP给药后db/db血清中HDL和LDL浓度均高于模型组的结果一致。
2.4 IMP对脂质蓄积HepG2细胞的降脂活性
通过荧光显微镜可以观察10 μmol/L IMP和10 μmol/L 洛伐他汀给药24 h后各组HepG2细胞内的脂质和ROS蓄积情况。由图5可知,bodipy 493/503染色结果表明,IMP组细胞内脂质蓄积量明显低于相同浓度的洛伐他汀。IMP能加速脂肪酸氧化,导致HepG2细胞内脂肪加速分解为甘油和脂肪酸,脂肪酸用于满足氧化代谢需求,因而体外细胞实验观察到IMP的降脂活性明显高于洛伐他汀。MitoSOΧ Red染色结果显示,对照组和模型组细胞红色荧光无明显差异,洛伐他汀作用后依稀可见微弱的红色荧光,而IMP组可见明显的红色荧光,表明IMP增加了肝细胞ROS的生成。ROS产生的主要部位是线粒体[23],由于IMP促进脂肪酸加速氧化,细胞在应激条件下产生过多的ROS以完成相应氧化反应,还原型辅酶II氧化酶和过氧化物酶被活化,进一步增加了肝细胞的氧化应激[24],线粒体稳态降低并导致DNA损伤[25],从而导致小鼠肝损伤。
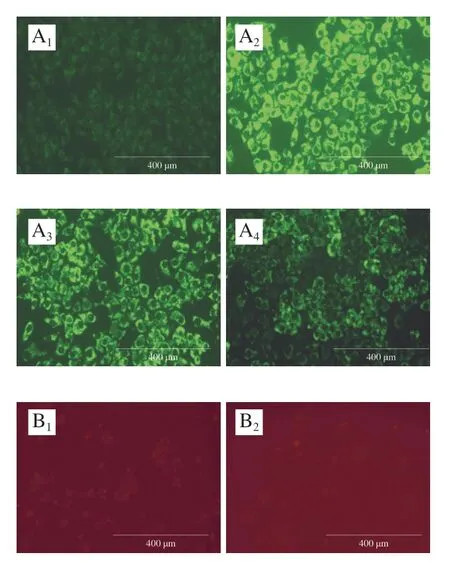

图5 IMP对HepG2细胞内脂质和ROS蓄积的影响Fig.5 Fluorescence micrographs describing lipid and ROS accumulation in HepG2 cells treated by IMP
2.5 小鼠肝脏和心脏乙酰辅酶A含量
如图6所示,正常对照组C57小鼠肝脏和心脏组织中乙酰辅酶A含量分别约为3 nmol/mg和6 nmol/mg,而模型组db/db小鼠肝脏和心脏内乙酰辅酶A含量急剧降低,为无检出状态;与正常对照组相比,IMP处理后db/db小鼠肝脏乙酰辅酶A含量高度显著升高(P<0.001),约为其6 倍,心脏乙酰辅酶A含量较模型组明显升高,但低于正常对照组,约为其50%。乙酰辅酶A是动物体内一种重要的代谢中间产物[26]。蛋白质、糖、脂肪三大营养物质分解代谢都会生成乙酰辅酶A,乙酰辅酶A除进入三羧酸循环最终代谢为CO2和H2O之外[27],也是肝脏内合成新的 脂肪、胆固醇和酮体的原料[28]。由于脂肪酸氧化分解的主要途径是β-氧化,而β-氧化会产生乙酰辅酶A[29],当长期罹患代谢综合征小鼠肝脏内三羧酸循环不足以消耗脂肪酸过度氧化产生乙酰辅酶A时,过剩的乙酰辅酶A被合成为TC和TG,表明小鼠脂代谢紊乱症状加剧恶化,同时引发血清HDL和LDL浓度升高,表明这种模式动物肝脏内的三羧酸循环效益显著低下。此外,心脏自动收缩的过程需要消耗大量能量,心肌细胞的三羧酸循环活性高于肝细胞,相对而言,心肌细胞内IMP刺激产生的过剩乙酰辅酶A容易被彻底代谢为H2O和CO2,为心脏自主运动供给能量,不易发生氧化应激损伤,因此未观察到小鼠心脏损伤。
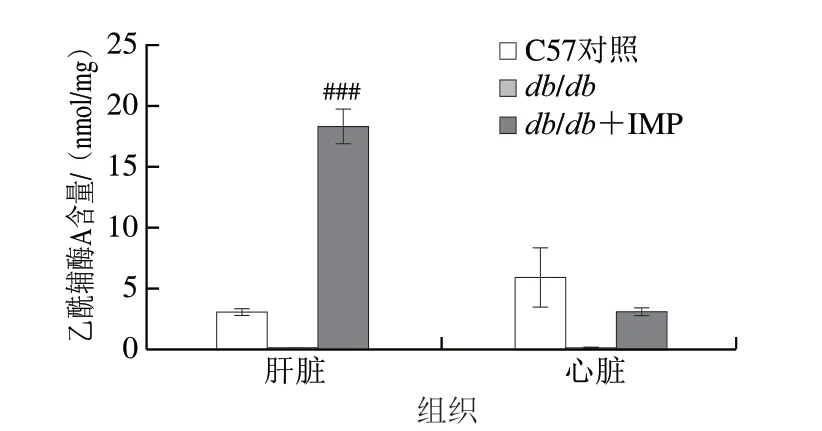
图6 给药结束后各组小鼠的肝脏和心脏内乙酰辅酶A含量Fig.6 Acetyl-CoA contents in liver and heart of mice in each group after IMP administration
3 讨 论
AMPK是调控脂质代谢的一种关键蛋白,能与其形成复合体提高其磷酸化水平的化合物都潜在具有提高脂质代谢效益的功能,前期研究已发现S-AMP具有这一功能[5],提示IMP可能也具有这样的功能。IMP作为广泛使用的食品添加剂,毒理学研究证明IMP满足食品安全要求[30],因此,本研究探索其作为新药或保健食品的可行性。一般认为AMPK的激动剂能促进脂质代谢,降低受试动物血清TG等水平,抵抗肝脏脂肪蓄积[2,5-6],但本实验结果表明IMP长期作用于老龄db/db小鼠后,小鼠脂质代谢紊乱症状更加恶化,血清TC浓度较模型组显著升高(P<0.05),可引发血管硬化,同时通过体外细胞实验还观察到IMP促进HepG2细胞内ROS产生。原因可能是老龄db/db小鼠体内,尤其是骨骼肌内三羧酸循环活性低下,IMP促进脂肪酸氧化生成的乙酰辅酶A不能被彻底代谢为CO2和H2O,导致肝脏内乙酰辅酶A含量较高。为抵抗乙酰辅酶A蓄积,肝脏产生氧化应激,产生大量ROS以氧化分解乙酰辅酶A,造成了肝氧化应激损伤;另一方面,乙酰辅酶A是合成TC、TG的原料,可导致体内TC、TG过量合成,因而导致老龄db/db小鼠体内脂质代谢紊乱更加恶化。因此可推测,用IMP治疗饮食诱导产生高血脂症的青壮年小鼠,小鼠的高血脂症可能得到改善,与S-AMP给药后的效果[5]相似。今后应开展不同生长周期的高血脂症模型动物体内乙酰辅酶A代谢机制研究,从中发现非酒精性脂肪肝发病的新机制,并确定新的药物作用靶标,为筛选治疗非酒精性脂肪肝的新药奠定基础。在实现AMPK活化的同时促进乙酰辅酶A代谢,可能是研发治疗非酒精性脂肪肝等脂质代谢紊乱疾病药物的新思路。
鉴于高龄db/db小鼠代谢综合征的发生发展机制和长期罹患糖尿病、高血脂症等代谢综合征的老年人相似,饮食中过多摄入IMP可能加重病情,由此建议对于患有代谢综合征的老年人群应减少从食物中过度摄取IMP,同时尽快研究建立IMP的食品安全新标准,规定IMP食用范围。加强运动能提高三羧酸循环,有助于降低乙酰辅酶A在肝脏内的蓄积,可能降低IMP促进体内脂肪酸过度氧化对身体产生的损伤,综上所述,本研究结果为清淡饮食和适当运动有利于身体健康提供了新的科学依据。
综上,IMP和AMPK形成复合体后可提高AMPK磷酸化水平,可显著活化肝脏内脂肪酸氧化通路。动物体内三羧酸循环活性低下时,在肝脏部位容易形成乙酰辅酶A蓄积,为抵抗乙酰辅酶A蓄积引发的应激反应,肝脏产生ROS将其氧化分解和将其用于合成TG、TC等,在衰老动物体内造成肝氧化应激损伤,并进一步加剧脂质代谢紊乱。
