苦荞中可溶性及不可溶性膳食纤维调控 糖尿病小鼠糖脂代谢的功效
2021-08-31吴伟菁
仇 菊,朱 宏,吴伟菁*
(1.农业农村部食物与营养发展研究所,北京 100081;2.厦门医学院公共卫生与医学技术系,福建 厦门 361023)
膳食纤维对人体的健康作用越来越受到关注。我国对正常成年人的膳食纤维每日推荐摄入量为25~35 g[1],而据统计我国居民的平均摄入量只有11 g[2],不到推荐量的一半。所以,在日常膳食中非常有必要补充膳食纤维。已有大量研究发现,总膳食纤维的摄入与2型糖尿病的患病风险显著相关,其中谷物膳食纤维降低糖尿病患病风险的作用最为明显,蔬菜其次,水果的膳食纤维与患病风险无明显关联[3-5]。可见,谷物作为膳食纤维的重要来源在平衡膳食营养及预防2型糖尿病中发挥重要作用。
由于不可溶性膳食纤维(insoluble dietary fiber,IDF)在谷物中占比较大,多数营养干预研究将谷物膳食纤维等同于IDF。例如,有研究将燕麦膳食纤维作为IDF,与瓜尔豆胶可溶性膳食纤维(soluble dietary fiber,SDF)进行对比,发现燕麦IDF比瓜尔豆胶SDF能更有效地改善肥胖小鼠的胰岛素敏感性[6]。然而,燕麦中最受关注的SDF为β-葡聚糖,β-葡聚糖在调控血糖及血脂方面的功效均已获得广泛的认可[7-10]。然而,除了燕麦及大麦[11]中的β-葡聚糖作为SDF受到了较多关注,其他谷物中SDF及IDF功效尚不明确,更缺乏对谷物中SDF及IDF功效比较的研究。
苦荞经证实是一种具有改善血糖、血脂代谢的功能性谷物[12]。大部分研究认为苦荞的功效来自类黄酮[12-13]、D-手性肌醇[14]、蛋白质[15]等,却忽视了苦荞中含量较高的膳食纤维。苦荞中膳食纤维含量(质量分数)约为25.97%[16],远远高于小麦(11~17 %)[17]、大米(3.24 %)[18]等谷物中膳食纤维的含量。目前,关于苦荞膳食纤维的研究,主要集中在提取工艺及改性上,对其调控血糖的作用仅局限在体外抑制α-D-葡萄糖苷酶活性的作用[19]。虽然,谷物膳食纤维维持糖脂稳态功能的研究已有较多报道,但苦荞膳食纤维的功能活性,特别是体内功效活性却鲜有研究。
因此,本实验从苦荞麸皮粉中分别提取SDF及IDF,通过对比二者对糖尿病小鼠血糖、血脂、肝脏脂肪积累及盲肠中短链脂肪酸(short-chain fatty acids,SCFAs)的影响,探究不同膳食纤维调控糖脂代谢的功效差异及相关调控机制的异同。本研究不仅为苦荞膳食纤维的调控糖脂代谢功效提供直接科学证据,也为探究谷物SDF及IDF的作用差异提供了思路。
1 材料与方法
1.1 动物、材料与试剂
4 周龄雄性清洁级C57BL/6小鼠,购于上海斯莱克实验动物有限责任公司,生产许可证号:SCΧK(沪)2017-005。
‘西荞二号’苦荞麸皮粉,由国家燕麦荞麦产业技术体系凉山综合试验站提供。其中,麸皮质量占全籽粒的37%。
SCFAs标准品、蛋白酶Alcalase 2.4L(活力大于2.4 U/g)、芦丁标准品、链脲佐菌 美国Sigma 公司;淀粉葡萄糖苷酶(100 IU/mg)、耐高温α-淀粉酶(20 000 U/mL) 北京百灵威试剂公司;胰岛素试剂盒 武汉华美生物有限公司;葡萄糖、糖化血清蛋白(glycosylated serum protein,GSP)、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、甘油三酯(triglyceride,TG)、高密度脂蛋白(high density lipoprotein cholesterol,HDL-C)、丙氨酸转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)试剂盒 南京建成生物工程研究所;其他常用试剂均购自国药集团化学试剂北京有限公司。
1.2 仪器与设备
7890B气相色谱仪(配有火焰离子化检测器) 日本 岛津公司;ICS-3000离子交换色谱仪(配有脉冲安培检测器) 美国赛默飞世尔公司;ACCU-CHEK Active血糖仪 瑞士Roche公司;Alpha-2-4-LSC真空冷冻干燥机 德国Christ公司;Infinite M200酶标仪 奥地 利Tecan公司; Avanti JΧN-26 离心机 美国贝克曼公司; SΧL-1208马弗炉 上海精宏实验设备有限公司;Kieltec Analysister全自动凯氏定氮仪 美国FOSS仪器有限公司。
1.3 方法
1.3.1 苦荞麸皮粉的组成分析
苦荞麸皮粉中膳食纤维(包括SDF和IDF)质量分数测定采用AOAC方法991.43《膳食纤维的测定方法-酶重量法》;苦荞麸皮粉中的蛋白质量分数测定参考GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》;脂肪质量分数测定参考GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》;总淀粉质量分数测定参考GB 5009.9—2016《食品安全国家标准 食品中淀粉的测定》;水分质量分数测定参考GB 5009.3—2016 《食品安全国家标准 食品中水分的测定》;灰分质量分数测定参考GB 5009.4—2016《食品安全国家标准 食品中灰分的测定》;抗性淀粉质量分数测定采用AOAC方法2002.023《淀粉与植物性基质中的抗性淀粉-酶消化法》;芦丁质量分数参考文献[13]测定。
1.3.2 SDF及IDF提取制备
本实验膳食纤维提取参考AOAC方法991.43,并做适当修改。苦荞麸皮粉于80 ℃、体积分数85%的乙醇溶液中于浸泡1 h,过滤。经60 ℃干燥过夜后,将苦荞麸皮粉与水混合(1∶10,m/V)均匀,加热至95 ℃保持15 min,使得淀粉糊化。加入耐高温α-淀粉酶(1∶500,V/V) 水解淀粉,95 ℃保持30 min,直至碘反应显色为阴性。冷却至60 ℃后,将pH值调节为7.5,再加入碱性蛋白酶(1∶500,V/V),于60 ℃反应4 h,除去蛋白质。用盐酸调pH值为4.5,并加入淀粉葡萄糖苷酶,于55 ℃反应2 h,将淀粉水解产物进一步水解。水解结束后,将混合液pH值调至7.0,加热至80 ℃反应10 min以灭酶。混合物于5 500 r/min离心20 min,分别收集上清液和沉淀,获得的沉淀即为IDF。IDF依次采用蒸馏水、无水乙醇及丙酮进一步洗涤、离心(5 500 r/min、10 min),收集沉淀获得洗涤后的IDF。上清液加入4 倍体积预热至60 ℃的无水乙醇,并于室温沉淀1 h。离心(5 500 r/min、10 min)收集沉淀,随后采用无水乙醇和丙酮洗涤沉淀、离心(5 500 r/min、10 min),收集沉淀获得SDF。SDF及IDF分别进行真空冷冻干燥。
1.3.3 膳食纤维单糖组成测定
参考文献[20],采用离子交换色谱仪,配Carbo PacTMPA20分析柱(3×150 mm,6 μm),测定膳食纤维的单糖组成。
1.3.4 葡萄糖结合能力测定
体外葡萄糖结合测定实验参考文献方法[21]。将1 g的膳食纤维样品加入10 mL不同浓度的葡萄糖溶液中,于37 ℃水浴水平振荡6 h后,离心(4 000×g、20 min),取上清液测定葡萄糖浓度。上清液的葡萄糖浓度采用葡萄糖试剂盒进行测定。葡萄糖结合能力根据公式(1)计算。

1.3.5 糖尿病模型的建立及实验设计
标准鼠维持饲料购自于北京华阜康生物科技股份有限公司,所有小鼠适应喂养1 周(温度(23±1)℃、相对湿度(60±5)%、12 h/12 h的昼夜交替)。随机抽取9 只小鼠作为健康组,饲喂标准鼠维持饲料。其余小鼠的处理参考文献[22],建立糖尿病模型。糖尿病模型组先通过饲喂高脂饲料(如表1所示,高脂饲料中脂肪供能比为45%)5 周后,禁食16 h,腹腔注射链脲佐菌素 120 mg/kg后,继续禁食2 h。注射链脲佐菌素后第1周及第2周分别测定空腹血糖浓度,选取连续2 周空腹血糖均超过11.1 mmol/L的小鼠纳入糖尿病模型组。糖尿病模型小鼠分为4 个组(9 只/组),分别为糖尿病组、1% SDF组、1% IDF组、5% IDF组。各组饲料组成如表1所示,饲喂8 周,期间小鼠自由摄入饲料与饮用水。每周记录小鼠的体质量、饲料摄入量及饮水量。

表1 饲料配方和热量密度Table 1 Composition and energy density of experimental diets used in this study g/kg
1.3.6 空腹血糖浓度的测定及口服葡萄糖耐受实验
干预期内空腹血糖浓度(禁食16 h)在尾部采血后通过血糖仪测定。口服葡萄糖耐受实验在干预期最后1 d进行,禁食16 h后,实验动物灌胃2 g/kg(以体质量计)的葡萄糖溶液,尾部采血后采用葡萄糖试剂盒测定0、0.5、1.0、1.5、2.0 h的血糖水平。血糖曲线下面积(area under curve,AUC)采用公式(2)进行计算。
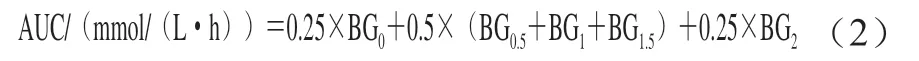
式中:BG0、BG0.5、BG1、BG1.5、BG2为灌胃葡萄糖溶液后0、0.5、1.0、1.5、2.0 h的血糖浓度/(mmol/L)。
1.3.7 血清及肝脏生化指标的测定
小鼠在禁食16 h后用异氟烷麻醉后,血液样本由眼眶采血,并于室温凝固离心后得血清。获取小鼠肝脏与预冷的生理盐水按1∶9(m/V)混合并于冰上均质,获得肝脏均质液。血清及均质液中生化指标(胰岛素、GSP、TG、TC、LDL-C、HDL-C、ALT、AST水平)均采用试剂盒法测定。
1.3.8 短链脂肪酸的测定
取小鼠盲肠内容物,加入5 倍体积的硫酸酸化的超纯水(pH 2.0)于4 ℃提取30 min。4 ℃离心(6 000 r/min、15 min)后,精确量取0.5 mL上清液,加入0.5 mL的乙醚,充分漩涡混匀后离心(6000 r/min、10 min),收集乙醚层后,用0.22 μm的滤膜过滤后进行气相色谱检测。进样量为1 μL。色谱温度程序:初始温度100 ℃;6 ℃/min 升温至170 ℃;20 ℃/min升温直至230 ℃,并保持2 min。进样口温度为250 ℃,检测器温度为280 ℃。配制SCFAs标准液(质量浓度0.1~2 mg/mL)进行定量分析。
1.4 数据统计与分析
采用SPSS 24.0进行统计分析。实验数据用平均值±标 准差表示。多组之间比较采用单因素方差分析,事后比较采用Duncan分析。P<0.05表示差异显著。
2 结果与分析
2.1 苦荞麸皮组成及其膳食纤维单糖组成
如表2所示,苦荞麸皮中含有丰富的蛋白质、抗性淀粉及膳食纤维。苦荞麸皮中总膳食纤维质量分数为23.54%,其中IDF的质量分数为19.52%,约为SDF质量分数(4.02%)的5 倍。苦荞膳食纤维中单糖组成分析结果显示,苦荞SDF中单糖组成(质量分数)分别为:53.56%葡萄糖、21.22%半乳糖、8.26%阿拉伯糖、6.47%甘露糖、5.74%木糖、4.76%鼠李糖;苦荞IDF中的单糖组成(质量分数)分别为:46.65%葡萄糖、21.36%阿拉伯糖、10.42%半乳糖,9.48%木糖、5.87%鼠李糖、5.18%半乳糖糖醛酸、1.04%葡萄糖醛酸。

表2 苦荞麸皮粉的主要成分和质量分数Table 2 Major composition of tartary buckwheat bran
2.2 苦荞SDF及IDF的葡萄糖结合能力
在不同浓度的葡萄糖溶液中,苦荞SDF及IDF均表现出葡萄糖结合能力,在各浓度梯度上,二者结合能力 无显著差异(P>0.05)(表3)。随着葡萄糖溶液的浓度从10 mmol/L升高至200 mmol/L,与SDF及IDF结合的葡萄糖分别为11.39~2 070.64、12.01~1 913.19 μmol/g。

表3 不同浓度的葡萄糖溶液中苦荞SDF及IDF的葡萄糖结合能力Table 3 Glucose binding capacities of SDF and IDF from tartary buckwheat at different concentrations of glucose
2.3 苦荞SDF及IDF对糖尿病小鼠血糖、血清GSP水平的影响
糖尿病组小鼠的空腹血糖水平及血清中GSP浓度均显著高于健康组小鼠(P<0.05),而经过8 周干预后,苦荞SDF及IDF干预显著降低了糖尿病小鼠的空腹血糖水平(P<0.05)(表4)。但1% SDF与1% IDF及5% IDF组间的空腹血糖水平无显著差异(P>0.05)。GSP浓度可反映1~2 周内机体的平均血糖的水平,不受临时血糖浓度波动的影响,可反映较长时间的血糖控制水平。其检测结果发现,SDF及IDF干预均显著降低了糖尿病小鼠的GSP浓度(P<0.05),而且5% IDF组的GSP水平显著低于1% SDF及1% IDF组(P<0.05)。虽然,SDF及IDF在干预期内降低空腹血糖的作用无显著差异(P>0.05),但5% IDF对GSP浓度的控制效果则更明显。
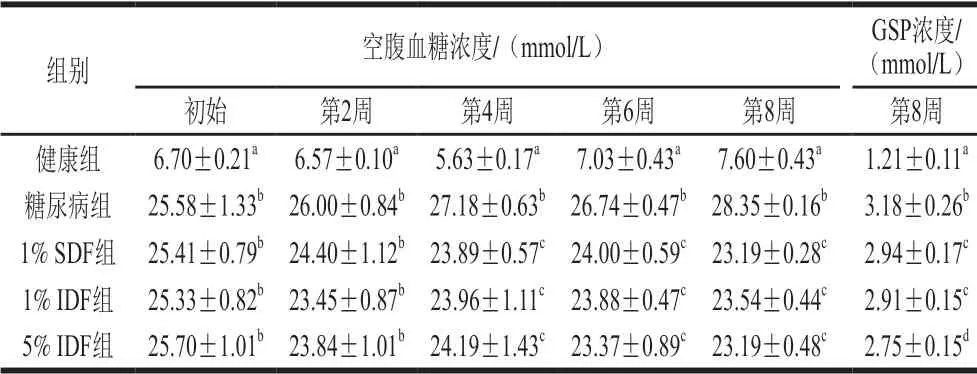
表4 膳食干预后糖尿病小鼠空腹血糖及GSP浓度的变化Table 4 Changes in fasting blood glucose and glycosylated serum protein (GSP) levels in diabetic mice during dietary intervention
如图1A所示,口服葡萄糖耐量实验中,与糖尿病组相比,1% SDF及5% IDF在0~2 h内能够降低血糖水平,而1% IDF对血糖的控制效果不明显,与糖尿病组无显著性差异(0.5 h及2 h,P>0.05)。如图1B所示,经过SDF及IDF干预后,AUC显著低于糖尿病组(P<0.05),但不同剂量组间无显著差异。如图1C所示,经过1% SDF及5% IDF干预后,糖尿病小鼠的血清胰岛素水平显著上升,而1% IDF对胰岛素水平无显著改善作用。上述结果表明,1% IDF控制血糖上升的作用没有1% SDF强,但当IDF剂量达到5%时,其控制餐后血糖上升的作用与1% SDF无明显差别。
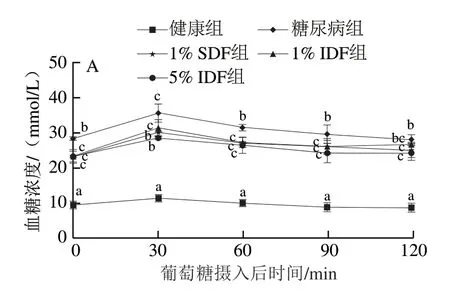

图1 膳食纤维对糖尿病小鼠血糖代谢的影响Fig.1 Effect of dietary fiber on glucose metabolism in diabetic mice
2.4 苦荞SDF及IDF对糖尿病小鼠血脂代谢的影响
如图2所示,与糖尿病组相比,苦荞SDF及IDF均能够显著降低糖尿病小鼠的血清TC及LDL-C水平 (P<0.05),且1% SDF、1% IDF对控制TC和LDL-C水平的效果无显著差异(P>0.05),但5% IDF比1% SDF及1% IDF更显著地降低了TC和LDL-C水平 (P<0.05)。SDF及IDF对于TG及HDL-C水平无显著影响(P>0.05)。上述结果表明,在降低血清TC及LDL-C水平上,1% IDF与1%的SDF效果相当,但5% IDF效果更强。
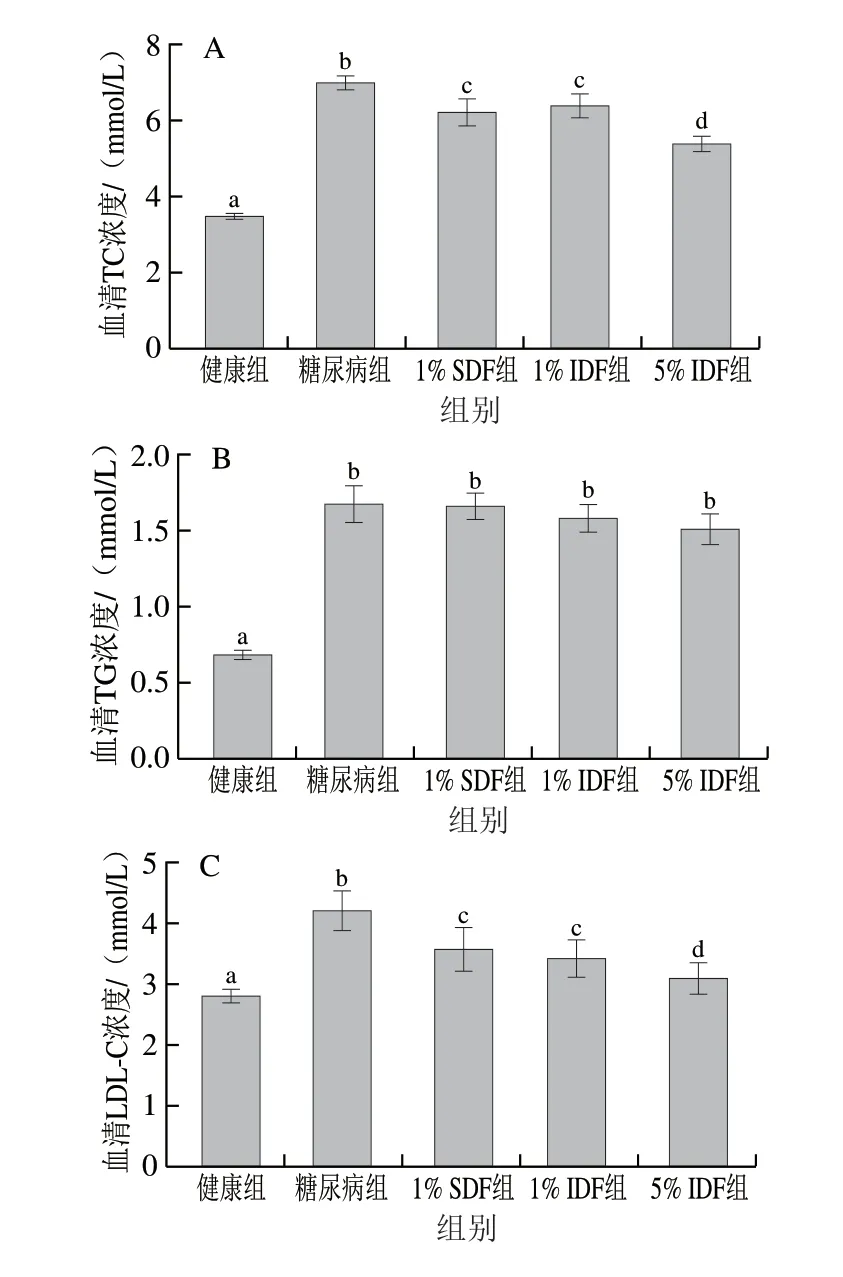

图2 膳食纤维对糖尿病小鼠血脂代谢的影响Fig.2 Effect of dietary fiber on serum lipid profile of diabetic mice
2.5 苦荞SDF及IDF对糖尿病小鼠肝脏脂质代谢及肝功能的影响
如图3所示,与糖尿病组相比,1% SDF能够显著降低肝脏TC、TG水平(P<0.05),而1% IDF无显著性降低TC及TG水平的作用(P>0.05);SDF及IDF均能够显著降低血清ALT水平(P<0.05),1% IDF及5% IDF对血清ALT水平影响无显著差异(P>0.05)。1% SDF降低血清ALT水平的作用显著高于1% IDF(P<0.05),而与5% IDF无显著差异(P>0.05)。SDF及IDF均对血清中AST活力无显著影响(P>0.05)(图3D)。上述结果表明,1% IDF对肝脏脂质无明显改善作用,5% IDF降低肝脏TC、ALT水平的作用与1% SDF效果相近,但在降低肝脏TG水平方面,1% SDF效果更强。
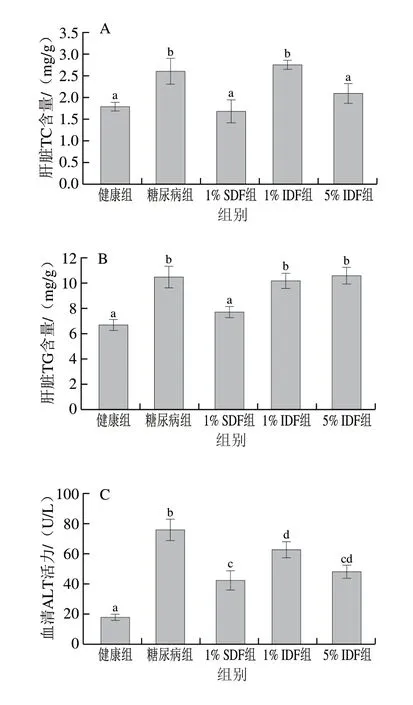

图3 膳食纤维对糖尿病小鼠肝脏脂肪组成及肝功能的影响Fig.3 Effect of dietary fiber on hepatic lipid profile and function parameters of diabetic mice
2.6 苦荞SDF及IDF对糖尿病小鼠盲肠中SCFAs质量浓度的影响
如图4所示,苦荞SDF及IDF干预能够显著提高糖尿病小鼠盲肠中的乙酸质量浓度(P<0.05)。1% SDF及5% IDF均能够显著提高糖尿病小鼠盲肠中的丙酸及丁酸质量浓度(P<0.05),但1% IDF对提高糖尿病小鼠盲肠中丙酸及丁酸质量浓度无影响。由此可见,IDF提高盲肠中SCFAs水平的效果与剂量紧密相关,1% SDF与5% IDF对盲肠中SCFAs质量浓度的影响相同。

图4 膳食纤维对糖尿病小鼠盲肠中SCFAs质量浓度的影响Fig.4 Effect of dietary fiber on caecal SCFAs in diabetic mice
3 讨 论
多数研究将IDF作为谷物膳食纤维的代表来解释谷物膳食纤维降低2型糖尿病患病风险的作用[3-4],却忽视了谷物中并存的SDF与IDF的作用贡献差异。有研究认为IDF与SDF不同,SDF通过发酵促进肠道有益菌生长,并产生SCFAs改善肠道健康从而发挥调控糖脂代谢等作用[23], 而IDF更多是通过促进肠道蠕动来发挥作用[24]。食物中的SDF及IDF作用也逐步受到关注,然而,谷物中IDF的含量远大于SDF,因此,比较其二者功效时,需考虑其在谷物中的原始比例。本研究测定苦荞麸皮中IDF含量约为SDF的5 倍。因此,在比较SDF及IDF在同等剂量下(1%)功效外,按照苦荞原料中的比例,比较1% SDF及5% IDF干预对糖尿病小鼠糖脂代谢的影响,旨在研究在苦荞食品真实体系下,SDF及IDF作用贡献。
本研究的体内、体外实验发现,苦荞SDF及IDF具有一定的调节血糖的作用。体外葡萄糖结合能力结果未发现二者在相同浓度下的差异,但根据以往研究来看,不同来源IDF的葡萄糖结合能力各异,大米IDF在5~200 mmol/L葡萄糖溶液中的结合能力为 10~1 040 μmol/g[25];燕麦IDF在100 mmol/L葡萄糖溶液中的结合能力为430 μmol/g[26],相比之下,苦荞SDF及IDF的葡萄糖结合能力较高。膳食纤维可能通过结合葡萄糖延缓餐后血糖升高[21]。进一步的血糖研究结果也发现,苦荞SDF及IDF在糖尿病小鼠体内降低空腹血糖的作用无显著差异,但对GSP水平的控制效果则是5% IDF更显著。这说明,IDF对血糖的调控存在剂量依赖性。随后的口服葡萄糖耐受实验也发现了同样的结果,1% IDF控制血糖上升的作用比1% SDF弱。这一发现与以往对比SDF及IDF的研究结果一致:在同等剂量下,脱脂小茴香SDF比IDF具有更显著降低血糖作用[23]。另外研究还发现,5% IDF的调控血糖的效果与1% SDF相同,说明虽然同等剂量下IDF作用较弱,但是由于IDF在谷物中占比大,它能与SDF一样调控血糖代谢。在接下来的研究中发现,苦荞IDF提高盲肠中SCFAs水平的效果也与剂量紧密相关,1% SDF与5% IDF对盲肠中SCFAs的含量具有相同作用,而1% IDF对丙酸和丁酸的产生无促进作用。膳食纤维通过发酵促进肠道菌群生长并提高SCFAs的作用已有较多报道。SDF可显著提高盲肠中SCFAs含量,例如,低聚果糖、β-葡聚糖、苹果果胶[27]、瓜尔胶[6]、脱脂小茴香的SDF[23]等,但纤维素无相关作用[27]。研究表明,膳食纤维发酵后产生SCFAs可能参与血糖调控,这与改善胰岛素抵抗、改善炎症、促进β胰岛细胞增殖及抑制凋亡、增加GLP-1分泌等机制有关[28-30]。
在调控脂质代谢方面,苦荞膳食纤维也呈现出剂量依赖效应。5% IDF能够比1% IDF及1% SDF更显著降低血清TC及LDL-C水平,且5% IDF降低肝脏TC、ALT水平的作用与1% SDF效果相同。已有研究报道,SDF(7%瓜尔胶[31]及2%、4%大麦β-葡聚糖[32])对模型鼠的血清TC、TG水平无影响。但大麦β-葡聚糖可以有效降低高脂诱导肥胖小鼠的肝脏TG及TC水平。膳食中添加甲基纤维素及车前草壳纤维等IDF能够降低高脂诱导肥胖大鼠的血清TG及TC,而纤维素无该作用[33]。另外,10%燕麦IDF能够比瓜尔胶(一种SDF)更显著降低高脂诱导肥胖小鼠肝脏的TG积累,其机理与肝脏中脂肪代谢相关酶的活力增加有关[6]。这些研究说明不同来源的SDF及IDF调控脂质代谢的效果存在差异。谷物膳食纤维能够降低血脂及肝脏脂肪积累已有科学证据,其作用机制可能是通过调控脂肪代谢相关基因FAS[32-33]及胆固醇相关基因CYP7A1[32],促使脂肪分解转化生成SCFAs。由此可见,苦荞SDF和IDF均能够通过促进SCFAs生成,改善糖尿病小鼠的脂质代谢。
综上所述,SDF及IDF干预均能够降低糖尿病小鼠的空腹血糖,相同剂量下SDF能够比IDF更有效的发挥降血糖作用,但当IDF剂量为SDF的5 倍时,即苦荞麸皮中的原始比例,IDF降低血清TC及LDL-C水平的作用比SDF更佳。1% SDF及5%的IDF具有同样的提高盲肠中SCFAs水平的效果。本研究揭示了苦荞SDF及IDF在维持血糖及血脂稳态作用的量效关系上的差异,以及通过促进胰岛素分泌改善糖耐量、通过促进SCFAs排出改善脂质代谢等相关作用机制方面的异同,为充分理解谷物中SDF和IDF的糖脂调控功效提供了科学证据。
