血清清蛋白水平与缺血性脑卒中患者出院后死亡风险的相关性*
2021-08-30吴恺迪尹霄任占云赵彦平董佳怡沈冲马铁梁陈如华江苏大学医学院江苏镇江220江苏大学附属宜兴医院a内科中心实验室江苏宜兴24200南京医科大学公共卫生学院南京266
吴恺迪,尹霄,任占云,赵彦平,董佳怡,沈冲,马铁梁,陈如华(.江苏大学医学院,江苏镇江 220;2.江苏大学附属宜兴医院a.内科,b.中心实验室,江苏宜兴 24200;.南京医科大学公共卫生学院,南京 266)
脑卒中目前已成为我国成年人群体残疾、死亡的首要因素[1-2]。缺血性脑卒中(ischemic stroke,IS)是发生最广泛的一类卒中,近年来发病率持续上升,占我国脑卒中的60%~80%[3]。构建风险模型对于及时识别和处理高风险IS 患者非常重要。血清清蛋白(Alb)有维持血液胶体渗透压与酸碱度、营养等[4]作用。研究表明,较高的Alb 水平可以降低发病风险[5],但Alb 水平与IS 死亡风险关系的流行病学研究鲜有报道。因此,本研究试图分析IS患者Alb水平与出院后死亡风险。
1 资料与方法
1.1 研究对象 连续纳入江苏大学附属宜兴医院2009年4月至2017年12月首次诊断为IS 的患者共2 207人,排除46例Alb信息缺失以及185例失访对象后,对剩余1 976例进行研究分析。
研究对象均符合《中国急性缺血性脑卒中诊治指南2010》[6]中IS 诊断标准,经计算机断层扫描(CT)或磁共振成像(MRI)确诊,同时满足:(1)急性起病,出现症状<48 h;(2)症状和体征持续数小时以上;(3)脑CT或MRI有梗死病灶,非脑出血及其他病变。排除标准:(1)自身免疫病史、肿瘤病史;(2)病前日常生活无法自理者;(3)重度肝、肾疾病者。
1.2 资料收集 由江苏大学附属宜兴医院神经内科采用统一编制的调查表,收集研究对象入院时的相关资料,包括基本信息(性别、年龄等)、家族史、既往病史(高血压史、糖尿病史等)、行为生活方式(饮酒为每周≥2 次,且持续半年以上;吸烟为每日≥1支,且持续3个月以上)。
1.3 标本采集与生化指标检测 患者入院后次日晨,在空腹情况下采集4 mL肘静脉血于促凝管中,4 000 r/min离心3 min,取上层血清,用溴甲酚绿法检测Alb,用双缩脲法检测总蛋白(TP),根据TP 和Alb计算球蛋白(Glo),用选择性清除法检测低密度脂蛋白胆固醇(LDL-C),用过氧化酶清除法检测高密度脂蛋白胆固醇(HDL-C),用甘油磷酸氧化酶-过氧化物酶(GPO-PAP)法检测三酰甘油(TG),用CHOD-PAP 法检测总胆固醇(TC)。
1.4 脑卒中病因分型 依据影像学检查结果及相关病史,将IS 按照TOAST 分型标准分为大动脉粥样硬化型卒中(large-artery atherosclerosis,LAA)、心源性脑栓塞(cardioembolism,CE)、小动脉闭塞或腔隙性脑卒中(small-artery occlusion or lacunar stroke,SAA)、其他病因所致缺血性卒中(stroke of other determined etiology,SOE)、原因不明的缺血性卒中(stroke of other undetermined etiology,SUE)5种亚型。
1.5 随访工作与结局的评估 以患者入院诊断为IS为起点,以随访终止或发生IS 死亡时为终点。2018年12月至2019年4月对患者进行集中随访。随访方式主要通过宜兴市疾病预防控制中心及公安户籍系统核对调查患者死因与时间,对于信息缺失者采用电话随访,死亡结局是患者出院6 个月后因IS而导致死亡。
1.6 统计学分析 通过Epidata 3.1 软件录入调查资料,用SPSS 25.0 软件进行统计学分析。不符合正态分布的连续性变量以M(P25,P75)描述,分类变量以频数(百分比)描述。用Mann-WhitneyU检验比较不符合正态分布的连续性变量的组间差异,用χ2检验比较分类变量的差异,用限制性立方样条回归(restricted cubic spline)分析入院时Alb 水平与IS死亡风险间的曲线关系,并确定适宜的Alb 截断点;运用COX比例风险模型分析Alb水平与IS死亡的关联;以双侧P<0.05为差异有统计学意义。
2 结果
2.1 研究对象的基线特征 见表1。纳入IS 患者1 976例,中位年龄68岁。

表1 研究对象的基线特征
2.2 不同Alb水平组的基线特征 限制性立方样条回归分析可以直观地拟合变量与结局之间的曲线关系,在调整混杂因素后,绘制Alb 水平与IS 死亡风险间的限制性立方样条回归分析曲线图发现,Alb水平与IS 死亡率呈负相关,有线性关联的趋势,基于本次研究对象的特点,选取Alb 中位数41 g/L作为截断点,将入院Alb≤41 g/L作为低Alb水平组,入院Alb>41 g/L作为高Alb水平组。
将总人群按Alb截断点分组后,低Alb 水平组985例,高Alb 水平组991 例。与高Alb 水平组相比,低Alb水平组年龄大,男性占比高,且两组人群血脂差异有统计学意义(P<0.01)。见表2。

表2 不同Alb水平人群基线特征比较
2.3 入院时Alb水平与IS死亡的关联 Alb>41 g/L组和Alb≤41 g/L组IS死亡人数分别为36、66人。通过多因素COX回归分析,未校正时,Alb≤41 g/L组相对于Alb>41 g/L 组,死亡风险增加1.714 倍(HR=1.714,95%CI:1.142~2.574,P<0.05),对混杂因素包括年龄、性别、吸烟、饮酒、血脂、高血压史、糖尿病史进行校正后,Alb≤41 g/L 组相对于Alb>41 g/L 组,死亡风险增加1.618 倍(HR=1.618,95%CI:1.060~2.469),P<0.05。
2.4 入院时Alb水平与发生IS死亡的分层分析 TOAST分型中,SOE 组与SUE 组各发生1 例死亡,总样本个数极少,因此仅对LAA、CE、SAA 进行分层分析。以Alb>41 g/L组作为参照组,研究Alb≤41 g/L组与发生IS死亡之间的关联,在LAA型、年龄≥65 岁、男性及高血压病史患者中,低Alb 水平增加IS的死亡风险,见表3。
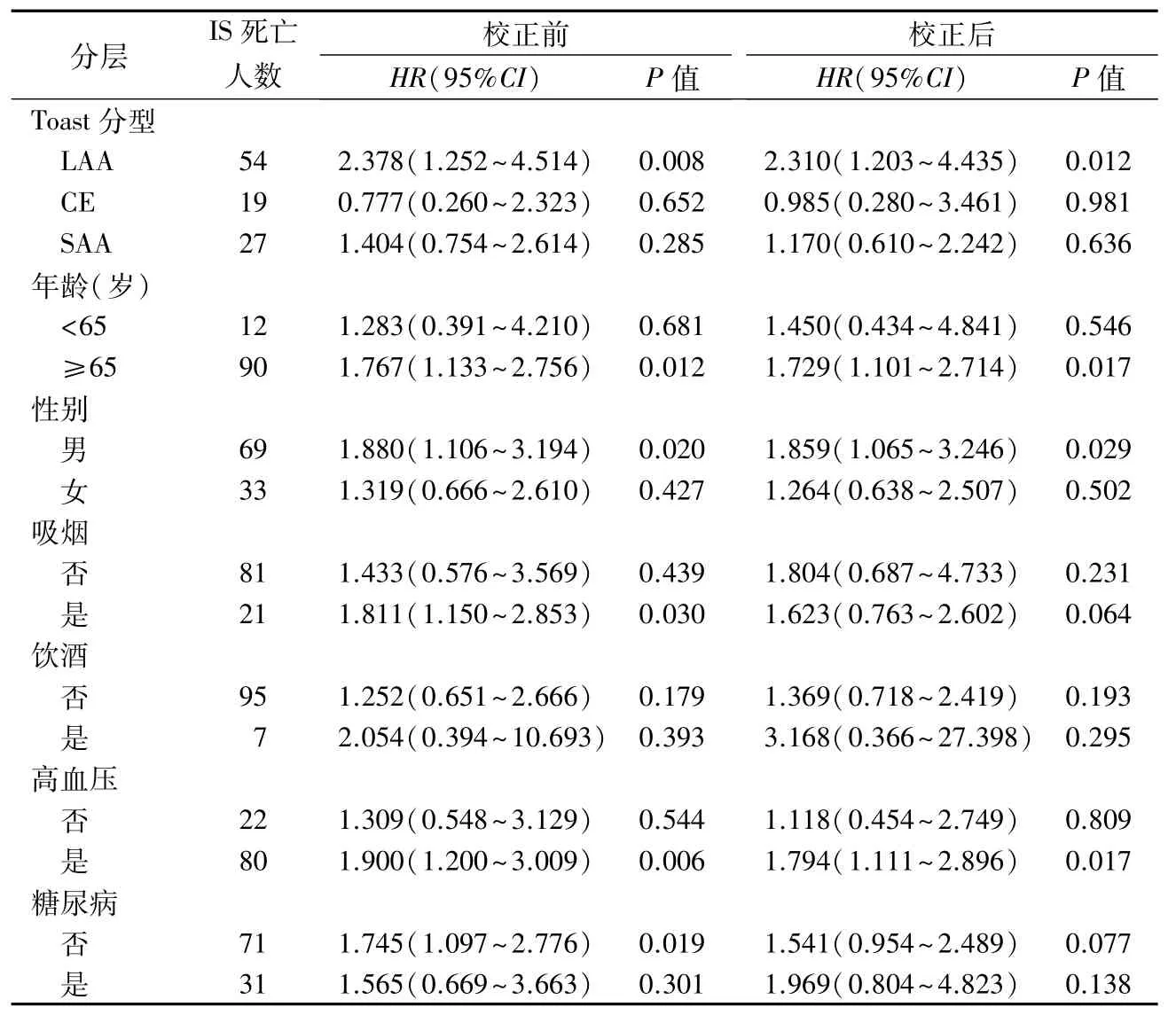
表3 不同亚组人群中Alb水平与IS死亡的关联分析
3 讨论
Alb 与IS 预后的关系已被一些临床研究证实[7-8]。本研究发现,低Alb 水平组相比高Alb 水平组IS死亡风险增加1.618 倍,而在LAA型、年龄≥65岁、男性、有高血压史的对象中,低Alb组相对于高Alb组死亡风险显著增加。
研究表明,Alb 水平低下与CE 型的发病率和预后不良有关[9]。本研究虽未获得一致结论,但是发现在LAA患者中,低Alb 水平IS 患者死亡风险增加。低Alb 的抗炎、抗氧化和内皮保护作用减弱,可能间接促进动脉粥样硬化的发展,从而致使IS患者预后不良[10]。老年患者随着生理机能减退,胃肠吸收功能及Alb 合成能力降低,基础营养状态偏低,若在此基础上进一步伴有营养不良和Alb低水平,其不良结局的发生风险更高。本研究发现,在男性患者中,低Alb水平增加IS死亡风险;男性肌肉比重较高,需要更多的蛋白质维持机体正常生理功能,一旦Alb 水平降低,更容易加剧病理状态,导致预后不佳。在既往高血压病史的患者中,低Alb水平同样是增加IS 死亡的危险因素;在低Alb水平状态下,血管损伤及斑块进展过程加速,致使病情加重,因此IS 死亡风险更高。因此,无论是患者还是健康者,都应该重视营养状况,养成良好的作息习惯,确保饮食规律,加强体育锻炼,避免发生营养不良。本研究还发现在吸烟和既往无糖尿病人群中,低Alb 水平增加IS 死亡风险,但是调整完混杂因素后,这种关系无统计学意义;说明在这两类人群中,低Alb水平并不能独立预测IS死亡风险,而是通过多种因素共同作用影响IS 的结局,其中的机制仍需进一步研究。
Alb预测死亡可能有以下几种病理生理机制。首先,由于循环代谢半衰期长,Alb可能是某些脑卒中前病理状态的生物标志物,低Alb 水平严重影响了预后,例如营养不良,可能还有其他疾病降低了Alb 水平并阻止了康复,例如合并肺炎和心力衰竭[11]。其次,缺乏Alb 可能会破坏凝血和抗凝之间的平衡。研究表明,Alb 是介导纤溶酶原与纤维蛋白结合的辅因子,并进一步参与组织纤溶酶原激活物的相互作用[12]。
本回顾性研究在多因素COX 风险模型中校正了多个可能导致IS 死亡的混杂因素,规避了相关因素对结果产生的干扰,结果可信度高。但是我们仅测量了一个时期的Alb 水平,患者入院及出院后Alb变化对其预后及死亡是否具备预测价值还需要通过设计更为深入的实验来研究。
