高效液相色谱-串联质谱法测定人血浆中异烟肼、利福平及其在健康男性体内的药物代谢动力学研究*
2021-08-30张美微陆优丽忻亮李水军刘罡一董春霞张梦琪梁立宇缪怡贾晶莹上海市徐汇区中心医院中国科学院上海临床研究中心中心实验室输血科上海200031
张美微,陆优丽,忻亮,李水军,刘罡一,董春霞,张梦琪,梁立宇,缪怡,贾晶莹(上海市徐汇区中心医院&中国科学院上海临床研究中心.中心实验室,.输血科,上海 200031)
异烟肼(isoniazid,INH)和利福平(rifampicin,RFP)是目前预防和治疗结核病(tuberculosis,TB)的一线药物,临床上常将二者联合应用以提高疗效,延缓结核杆菌(mycobacterium tuberculosis,MTB)的抗药性。
INH在体内经N-乙酰基转移酶2(N-acetyltransferase,NAT2)和酰胺水解酶(amide hydrolase,AH)催化直接或间接生成乙酰异烟肼和肼,两者均具有肝毒性[1]。慢性肝病或严重肾功能不全的患者使用INH后可发生严重甚至是致死性的药物性肝炎。RFP 可诱导肝药酶活性,加速乙酰异烟肼代谢为乙酰肼,INH与RFP 联合应用时肝毒性明显增强[2],已有治疗后发生卟啉症恶化的个案报道。有证据表明,NAT2的基因型决定RFP 的代谢基本分为快代谢[(半衰期t1/2)为1~2 h]和慢代谢(t1/2为2~5 h)两种,其中RFP 慢代谢型的危险性是快代谢型的28 倍[3-6],并且基因型与表型结果基本一致。因此准确测定血药浓度并结合代谢类型,合理地制定个性化用药方案尤为重要。
本研究旨在建立简便、可靠的高效液相色谱-串联质谱(high performance liquid chromatography tandem mass spectrometry,HPLC-MS/MS)分析方法,检测人血浆中INH和RFP 的浓度,研究中国健康男性体内药物代谢动力学特征,为临床进行治疗药物监测提供可靠的检测手段和临床数据。
1 材料与方法
1.1 主要仪器与试剂 API4000串联质谱仪(美国应用生物系统公司);液相系统(日本岛津公司)包括SIL-HTc 自动进样器,LC-20AD 输液泵,DGU-20A3在线脱气仪,CBM-20A控制器;EHMA切换阀(美国Valco Instrument 公司);Milli-Q 超纯水系统(美国Millipore公司)。
RFP、INH 标准品(欧洲药典);利福平-氘3(RFP-d3)、异烟肼-氘4(INH-d4)购自加拿大TRC公司;甲酸、甲醇、甲酸胺(HPLC 级)购自德国CNW公司;乙腈(HPLC 级)购自美国DIKMA 公司;抗坏血酸(VC)(分析纯)购自中国国药集团;水为Millipore Advantage A10 制超纯水;空白人肝素钠抗凝血浆来源于健康志愿者。
1.2 RFP 和INH的色谱条件 见表1。
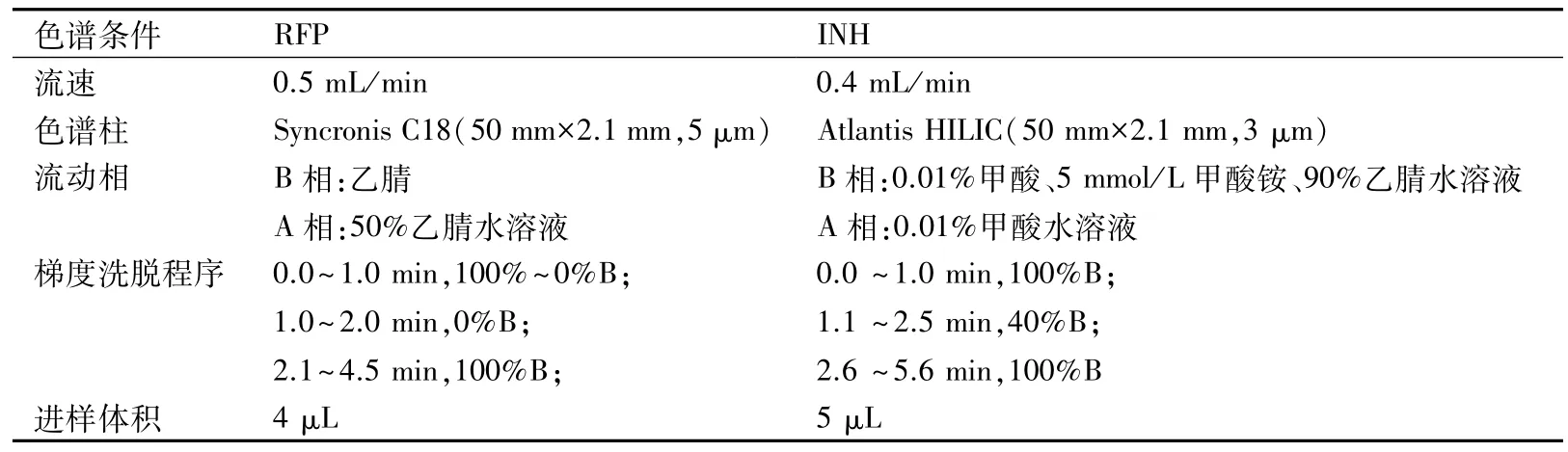
表1 RFP 和INH的色谱条件
1.3 INH和RFP 的质谱条件 采用电喷雾离子源正离子模式(ESI+)下多反应监测模式(MRM)进行质谱分析,质谱源参数:雾化气(GAS1)为60 psi(1 psi=6.895 kPa),辅助加热气(GAS2)为60 psi,气帘气(CUR)为30 psi,离子源加热温度(TEM)分别为550 ℃(INH)和500 ℃(RFP);离子喷雾电压(IS)分别为1 500 V(INH)和5 500 V(RFP);分析参数见表2。

表2 INH和RFP 的分析参数
1.4 溶液的制备 精密称取适量RFP 和INH,用甲醇制备成446 μg/mL(INH)、864 μg/mL(RFP)的标准储备液。取INH/RFP 储备液,加入适当体积含9.5 mmol/L VC的50%乙腈水溶液(稀释液),制成含INH/RFP 浓度为0.05/0.1、0.1/0.2、1/2、5/10、20/40、45/90、50/100 μg/mL 的标准添加液,0.05/0.1(定量下限)、0.15/0.3(低)、10/20(中)、40/80(高)、200/400(稀释)μg/mL的质控添加液,添加液临用时新鲜配制。精密称取适量INH-d4和RFP-d3,用甲醇制备成98 μg/mL(INH-d4和RFP-d3)的内标储备液,所有储备液置于-90~-70 ℃保存。临用时取稀释液稀释至所需浓度作为工作液备用。
1.5 血浆样品预处理 样品制备均在冰上操作且避免太阳光照射。取血浆100 μL,加入10 μL内标工作液和300 μL甲醇,混旋10 s,7 715×g(4 ℃)离心3 min。吸取上清液25 μL,加入100 μL 30%乙腈水溶液,混匀后用于RFP 的进样分析;另取上清液25 μL,加入100 μL 80%乙腈水溶液,混匀后用于INH的进样分析。
1.6 数据处理 用Analyst Software(1.6.1)软件进行质谱数据采集及定量计算,用SAS软件对血药浓度-时间数据以非房室模型方法对其药动学参数进行统计计算及分析。
2 实验与结果
2.1 方法学评价
2.1.1 选择性 分别取人空白血浆、加入标准添加液和内标工作液的血浆样品和服用试验药物研究对象的血浆样品,按“1.5”项下方法处理后进样分析,得到色谱图,见图1、2,各样品分离度良好,内源性物质对测定无干扰。
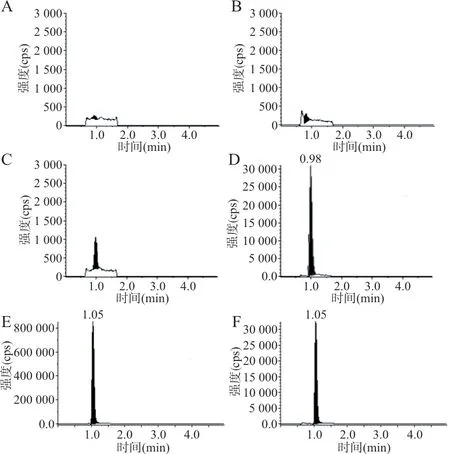
图1 INH及INH-d4 典型色谱
2.1.2 标准曲线和定量下限 取空白血浆90 μL,加入10 μL INH/RFP 标准添加液,漩涡混匀,配制成含INH/RFP浓度为5/10、10/20、100/200、500/1000、2 000/4 000、4 500/9 000、5 000/10 000 ng/mL的标准曲线样品,按“1.5”项下操作,以理论浓度为X轴,分析物和内标峰面积的比值为Y轴,按权重因子1/X,用最小二乘法进行线性回归分析。INH在5~5 000 ng/mL范围内,RFP 在10~10 000 ng/mL 范围内,线性关系良好,相关系数均>0.99。
2.1.3 精密度 取空白血浆90 μL,加入10 μL INH/RFP 质控添加液,漩涡混匀,制得5、15、1 000、4 000、20 000 ng/mL质控样品,每个浓度平行配制6份,按“1.5”项下操作,连续3 个批次,考察精密度,见表3。

图2 RFP 及RFP-d3 典型色谱
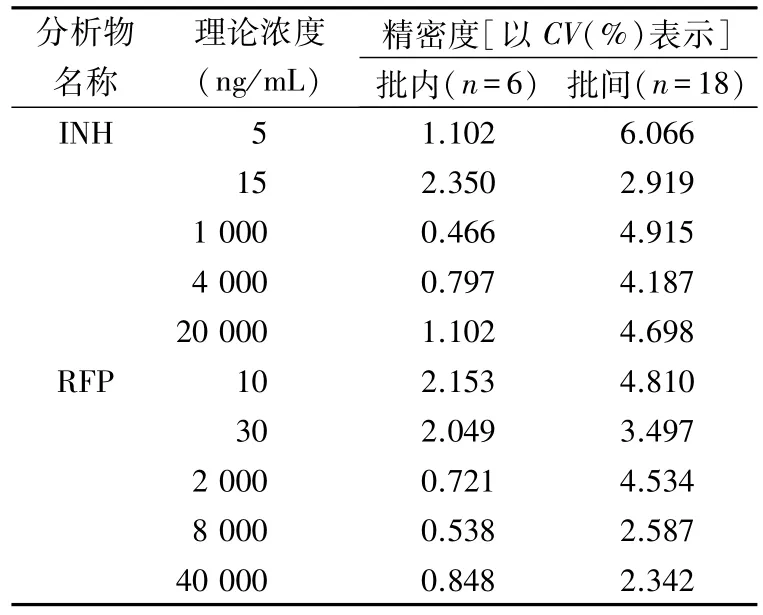
表3 HPLC-MS/MS法测定INH及RFP 浓度的精密度
2.1.4 提取回收率 制备低、中、高浓度质控样品,按“1.5”项下操作,得峰面积EPA;另取空白血浆,经过同样的预处理后,加入对应浓度的质控添加液和内标工作液进行分析,得峰面积UPA。以上样品重复测定6 次,计算提取回收率,公式为R(%)=EPA/UPA平均值×100%,结果见表4。
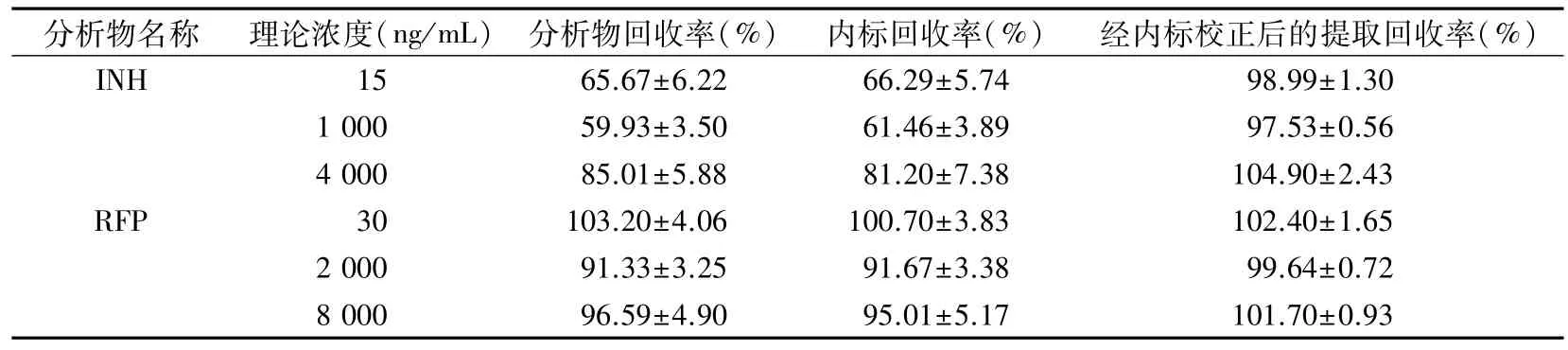
表4 HPLC-MS/MS法测定INH和RFP 的提取回收率
2.1.5 基质效应 取6个不同来源的空白血浆各6份,不加内标,按“1.5”项下操作,吸取上清液,加入低、高浓度质控添加液和内标工作液,进样分析得峰面积A;对应浓度化学品溶液进样分析得峰面积AC;以A/AC平均值的比值计算基质因子(MF),以MF(分析物)/MF(内标)的比值计算内标校正基质因子。结果表明,经内标校正后,INH 在0.899~1.294范围内,RFP 在0.970~1.049范围内,无明显基质效应。
2.1.6 稳定性 制备(INH 为15 ng/mL,RFP 为30 ng/mL)、高(INH为4 000 ng/mL,RFP 为8 000 ng/mL)浓度的血浆质控样品,考察短期(室温/2~8 ℃)放置、多次冻融及长期冻存(-90~-70 ℃)的稳定 性。制 备 低(INH 为15 ng/mL,RFP 为30 ng/mL)、高(INH为4 000 ng/mL,RFP 为8 000 ng/mL)浓度的全血质控样品,考察室温放置的稳定性。结果表明,INH和RFP 的血浆样品室温(15~25 ℃)放置2 h、冷藏(2~8 ℃)放置24 h,反复冻融3次,冷冻(-90~-70 ℃)保存28 d均稳定;全血样品室温放置1 h较稳定。结果见表5。

表5 INH和RFP 在血浆及全血中的稳定性
将同一来源的储备液和工作液分装,考察分析物储备液室温及长期冻存(-90~-70 ℃)和工作液室温放置的稳定性;内标工作液2~8 ℃和室温放置的稳定性。INH和RFP 储备液和工作液室温至少可存放4 h,储备液-90~-70 ℃下至少可保存31 d,内标工作液室温至少可存放4 h,2~8 ℃至少可保存24 h,结果均较稳定。
2.2 临床研究 选择年龄为18~55 周岁(含18、55周岁)的24 例中国健康男性(符合方案的入选标准)作为研究对象,进行单次口服Rifinah®(INH片150 mg/RFP300 mg)药动学研究。本研究经上海市徐汇区中心医院伦理委员会批准(文号:2014-28),所有研究对象均签署知情同意书。研究对象给药开始前10 h内以及服药后4 h内禁止饮食,分别于给药前(0 h)和给药后第15 min、30 min、45 min、1 h、1.5 h、2 h、2.5 h、3 h、3.5 h、4 h、5 h、6 h、8 h、10 h、12 h、14 h、24 h采集3 mL静脉血,肝素钠抗凝,并在2~8 ℃下,于采样完成30 min内离心(1 500×g离心5 min)获得血浆,血浆样品保存于-90~-70 ℃冰箱中待测。
各时间点INH和RFP 平均浓度与时间的曲线见图3,主要的药代动力学参数见表6,本研究中RIF的各项药代动力学参数个体间变异较小,而INH药代动力学特征存在明显个体差异,24例健康志愿者中11 例T1/2≥2 h 为慢乙酰化(45.8%),13例T1/2<2 h为快乙酰化(54.2%),峰浓度(Cmax)、个体间变异均较大(CV>30%)。本研究中NAT2酶快慢代谢能力、比率及INH半衰期与文献报道基本一致,与说明书中描述的大多数亚洲人属INH快代谢型相符。
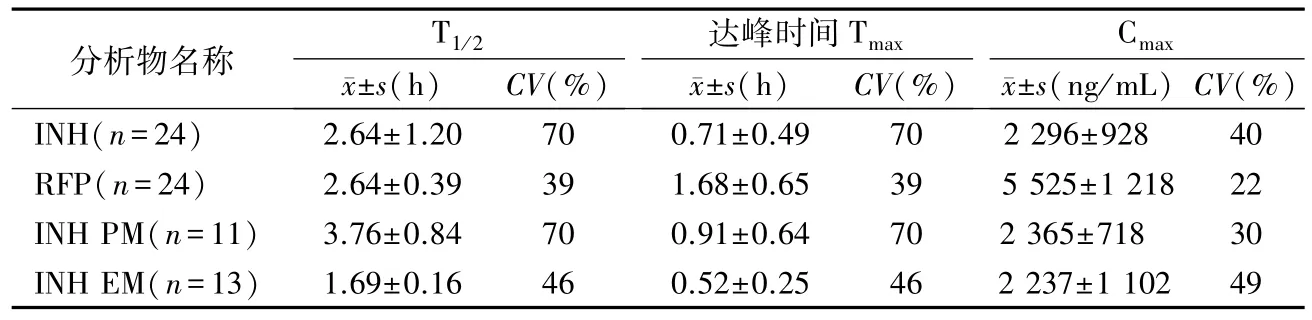
表6 研究对象单次口服150 mg INH和300 mg RFP 后的主要药代动力学参数

图3 研究对象口服150 mg INH 和300 mg RFP 后INH和RFP 的平均剂量-时间曲线(n=24)
3 讨论
研究表明,RFP 易被氧化且对光略敏感,需加抗氧化剂增加稳定性,另外INH 和RFP 的混合物对热不稳定,因此方法条件的探索时考察了抗坏血酸VC(含量分别为0、2.5、5.0、9.5 mmol/L)、光照(日光灯下2、6、24 h)、温度(冷藏/2~8 ℃,室温/15~25 ℃)对血浆样本中分析物稳定性的影响。结果显示,在血浆中加入VC 9.5 mmol/L 可显著增加分析物的稳定性;光照对RFP 的影响不显著,因此可在日光灯下进行样品的采集和处理;分析物在2~8 ℃下保存稳定性时间延长,因此血浆样品前处理在冰上操作。
从化合物结构判断(见图4),INH 属于极性较大的化合物,在亲水色谱柱上保留较好,因此选用Atlantis HILIC 作为分析柱,克服了INH 保留时间短的问题且提高了灵敏度。而RFP 极性中等偏弱,在反相色谱柱上有较好的色谱行为,所以选用Syncronis C18作为分析柱。
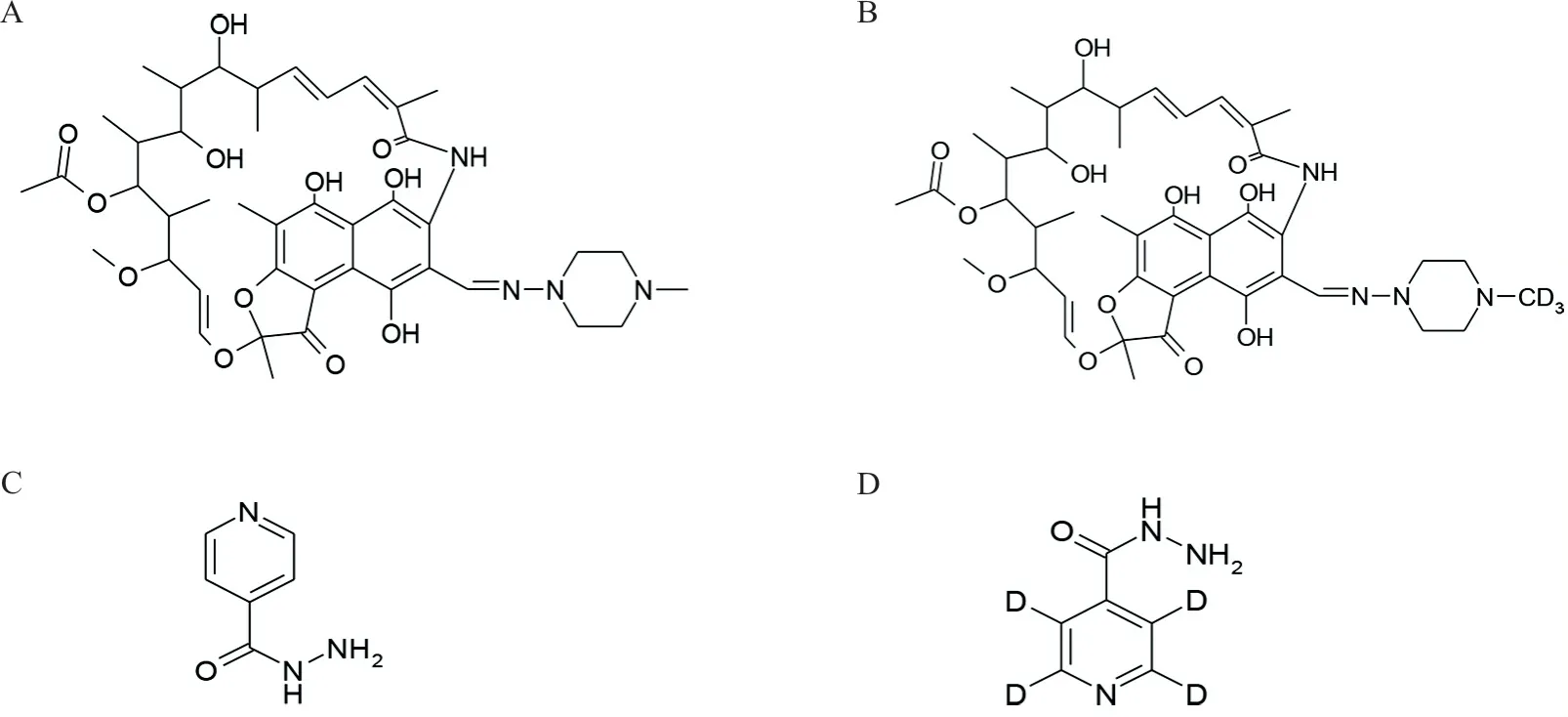
图4 化合物RFP、RFP-d3、INH及INH-d4 的化学结构
本研究通过向血浆样品中加入抗氧化剂来增加稳定性且样本预处理方法简便(蛋白质沉淀法),INH和RFP 的最低定量检测限分别为5 ng/mL 和10 ng/mL(已报道的国内外文献尚无低于本值者)。目前,国内外已有多篇文献报道单独或者同时检测INH 和 RFP 血药浓度的高效液相色谱法(HPLC-UV),但是这些方法有很多局限性,如样品预处理采用固相萃取(SPE)及衍生化方法样品制备步骤繁琐,样品使用体积较大,检测灵敏度低,分析时间长等问题[7-9];大多数HPLC 分析方法使用C18色谱柱检测INH,使其色谱保留有限,容易受内源性物质的干扰。
本研究中入组的男性体内INH 的药动学特征符合文献报道[10]的大多数亚洲人的代谢特征,INH代谢个体间差异显著主要与NAT2基因型有关,如若不能根据患者代谢类型制定个体化给药方案,直接影响到药物的疗效。临床应用时可通过监测患者血药浓度结合NAT2 代谢表型来判断给药剂量是否合理,后续可收集数据开发能指导临床给药的PK-PD模型,这对于患者(尤其是老年人,儿童等特殊群体患者)降低不良反应的发生率和程度,保证给药剂量,提高疗效、减少耐药性,以及减轻患者经济负担具有重大意义。
