中国急性胰腺炎临床研究注册的现状分析
2021-08-30姜娇蒋鑫曾馨仪夏慧芳彭燕吕沐瀚汤小伟
姜娇 蒋鑫 曾馨仪 夏慧芳 彭燕 吕沐瀚 汤小伟
西南医科大学附属医院消化内科,泸州 646000
临床试验是解决AP临床问题的有力研究工具,其中随机对照试验(randomized controlled trial, RCT)更是能为临床决策提供最高质量的证据[1]。临床试验注册是临床试验透明、规范的重要措施[2]。国际医学期刊编辑委员会(International Committee of Medical Journal Editors,ICMJE)宣布从2005年7月1日起,其成员期刊只发表已在公共临床试验注册机构注册的临床试验结果报告[3]。2006年5月正式启动的国际临床试验注册平台(International Clinical Trials Registry Platform,ICTRP)是实现临床试验透明化和提高临床试验质量的全球性举措[4]。早在1997年由美国国立卫生研究院(National Institutes of Health, NIH)联合美国食品药品监督管理局建立的ClinicalTrials.gov平台符合ICMJE标准,是目前全球最大的临床试验注册平台[5-6]。2007年7月25日,中国临床试验注册中心(Chinese Clinical Trial Registry,ChiCTR)成为第二批WHO ICTRP认证的一级注册机构。基于ChiCTR或ClinicalTrials.gov数据库的临床试验注册状况的调查已颇多,如关于糖尿病、高血压和放射治疗等临床试验注册状况分析[7-8],但尚无关于AP临床研究注册状况的相关报道。本研究基于ChiCTR和ClinicalTrials.gov数据库,对AP相关临床研究的注册内容进行分析,以探讨中国AP相关临床研究注册的现状和发展趋势。
资料与方法
一、纳入标准
收集所有注册于ChiCTR数据库内与AP相关且已获得伦理委员会批准并已上传伦理审批文件、不论采用何种设计或是否已完成的临床研究;收集所有注册于ClinicalTrials.gov数据库内与AP相关且研究实施地在中国的临床研究。
二、检索方法
在“注册题目”栏输入“急性胰腺炎”检索ChiCTR数据库,“获伦理委员会批准”一栏选择“是或yes”,注册状态不限;在“疾病或状态”栏输入“acute pancreatitis”检索ClinicalTrials.gov数据库,其余选项不设限制。临床研究的注册时间均为建库至2020年12月31日。
三、资料提取
由2名研究者独立检索数据库、提取资料并交叉核对。如有分歧,则通过讨论或与第三方协商解决。资料提取内容包括(1)注册研究的基本信息:研究题目、注册时间、注册状态、注册人或组长所在单位及地区;(2)注册研究的设计信息:研究类型、研究设计、所处阶段、样本量、国内或国外以及单中心或多中心数量、征募研究对象情况、盲法和随机方法;(3)其他:经费来源和有无数据管理委员会。
四、统计学处理
采用Excel软件收集和整理资料,采用SPSS20.0软件进行统计分析。计数资料采用频数、构成比或百分率(%)表示。采用χ2检验比较分类变量,根据不同χ2检验的应用条件,选择对应的统计量和概率P值。P<0.05为差异有统计学意义。
结 果
一、筛选流程及资料基本特征
检索ChiCTR和ClinicalTrials.gov数据库后分别获取105项和236项中国AP相关临床研究。逐条查看注册时间及内容后,ChiCTR数据库删除5项注册时间不符合纳入标准、1项未上传伦理批件,最终纳入99项研究;ClinicalTrials.gov数据库删除2项非AP相关研究、176项不在中国实施的研究,最终纳入58项研究。两个数据库共纳入157项注册的临床研究,其中预注册113项,补注册44项。
ChiCTR数据库中单中心86项,多中心13项;ClinicalTrials.gov数据库中单中心48项,多中心10项。ChiCTR数据库中征募研究对象情况尚未开始的有28项,正在进行42项,已结束29项;ClinicalTrials.gov数据库正在招募4项,已完成16项,未知状态33项,其他招募情况5项。157项注册临床研究中有数据管理委员会67项,暂未确定73项,无数据管理委员会17项。
二、历年注册试验数量分布
ChiCTR自2007年建库后,于2009年出现首个AP注册临床研究,到2013年达到13项,2018年进入上升期,到2020年达18项,注册数量整体呈上升趋势。在ClinicalTrials.gov数据库上注册的中国AP临床研究数量在2017年前的增长趋势与ChiCTR相似,自2017年后,ClinicalTrials.gov数据库中的注册研究数量明显少于ChiCTR(图1)。
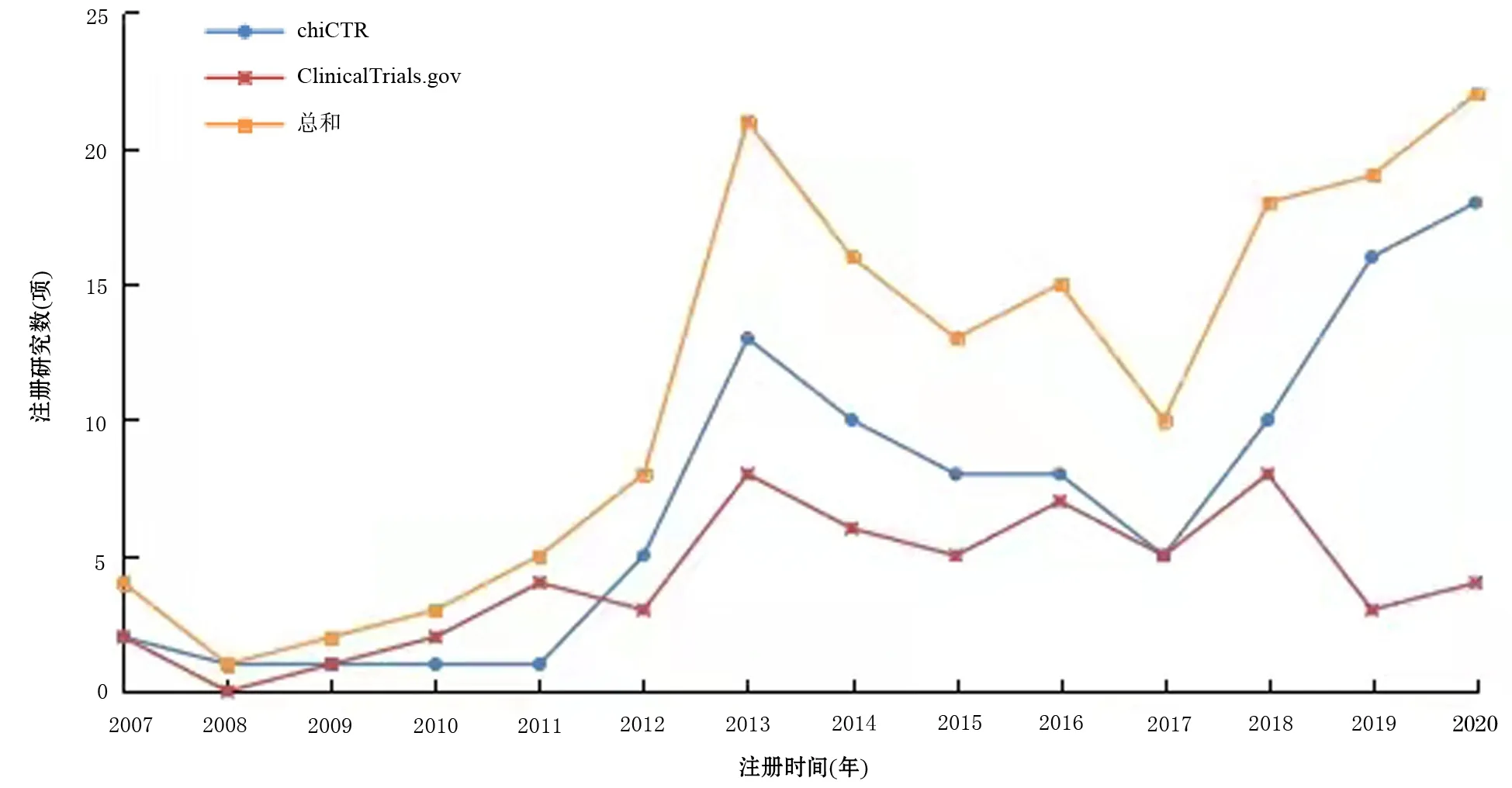
图1 中国急性胰腺炎临床试验注册数量
三、注册地区及主要负责单位
157项注册的AP临床研究分布在全国20个省、直辖市、自治区。注册项目数≥10项的地区分别是四川省(44项)、上海市(23项)、江苏省(19项)、江西省(14项)和浙江省(10项),其中前3位地区共占注册研究总数量的54.8%(图2)。研究实施负责(组长)单位共45家,注册项目数≥10项的研究单位共4个,分别是四川大学华西医院、南昌大学第一附属医院、东部战区总医院、海军军医大学第一附属医院,四川大学华西医院注册数量最多,占20.4%(表1)。

图2 中国急性胰腺炎临床试验地区分布

表1 中国急性胰腺炎临床试验的主要负责单位与注册试验数量[项(%)]
四、研究设计情况
157项注册的AP临床研究中干预性研究91项,观察性研究41项,其他类型25项,包括病因学或相关因素研究、诊断试验、基础科学研究、流行病学研究、预防性研究和治疗研究(表2)。研究类型以RCT为主,共84项(53.5%),其次为队列研究,共17项(10.8%)。

表2 157项中国急性胰腺炎注册临床试验的研究类型[项(%)]
ChiCTR数据库获得的50项干预性研究中49项(98%)为RCT,1项本属于观察性研究类型的横断面研究被错选填为干预性研究。盲法使用情况:未使用盲法5项,未说明34项,使用盲法11项(22%),其中6项提到了对何者使用盲法。50项(100%)均采用随机分组,多数随机序列产生方法仅简单描述为“随机数字表”,仅4项提及分配序列隐藏。ClinicalTrials.gov数据库获得的41项干预性研究中35项(85.4%)为RCT,单臂4项,交叉对照1项,非RCT 1项。盲法使用情况:未使用盲法18项,使用盲法23项(56.1%),均说明了对何者采取盲法。38项(92.7%)采用随机分组,未对随机分配序列的产生及隐藏方法进行描述。
ChiCTR数据库获得的24项观察性研究中队列研究7项(29.2%),连续入组6项,11项(45.8%)本属于干预性研究的设计类型(析因分组5项、单臂4项、非RCT 2项)被错选填为观察性研究。ClinicalTrials.gov数据库获得的17项观察性研究中病例对照研究8项,队列研究6项,单纯病例研究1项、信息丢失1项、其他1项。
ChiCTR数据库中临床研究所处的阶段分别为预试验17项(10.8%),Ⅰ期临床试验6项(3.8%),Ⅳ期18项(11.5%),其他或未知58项(36.9%),无Ⅱ、Ⅲ期临床试验注册。ClinicalTrials.gov数据库中Ⅳ期12项(7.6%),其他或未知36项(22.9%),另有少数Ⅰ期(3项)、Ⅰ或Ⅱ期(2项)、Ⅱ期(1项)、Ⅱ或Ⅲ期(2项)、Ⅲ期(2项)。两数据库所注册的临床研究以Ⅳ期临床试验(30项,19.1%)、其他或未知(94项,59.9%)为主。
纳入的157项注册临床研究中3项未说明样本量,18项样本量1~50,39项样本量51~100,42项样本量101~200,31项样本量201~500,24项样本量>500。样本量>100的注册研究共97项,占总注册试验数的61.8%。
五、经费来源情况
ChiCTR数据库中获得经费资助的注册临床研究92项(92.9%),根据经费来源分为自筹(48项)、企业资助(制药公司或企业5项)、公共经费(国家财政20项、地方财政16项、社会公益基金2项)、其他(1项)。ClinicalTrials.gov数据库中将经费来源分为美国国立卫生研究院、美国联邦机构、公司或企业以及其他,检索到的58项注册临床研究中1项被标注为由公司或企业资助,其余研究资助来源被标注为其他。
六、分组比较
根据注册时间将注册临床研究分为2007-2014年组、2015-2020年组。2007-2014年组注册试验60项,倾向于采用随机平行对照试验设计(68.3%比45.4%,P=0.005)和随机化分组(76.7%比47.4%,P=0.001),2015-2020年组97项,倾向于较大样本量(72.6%比47.4%,P=0.002)和有数据管理委员会(53.6%至25.0%,P=0.001),两组间差异均有统计学意义,而是否多中心、盲法和注册状态等方面的差异均无统计学意义(表3)。

表3 不同注册年份的中国急性胰腺炎临床试验特征比较[项(%)]
ChiCTR数据库中自筹、企业、公共3组经费来源的注册研究在是否多中心、样本量、盲法和随机化方面的差异均无统计学意义(表4)。由于Clinical-Trials.gov数据库中无法获得中国AP注册临床研究的经费确切来源,故未能对其进行分组比较。

表4 不同经费来源的中国急性胰腺炎临床试验特征比较[项(%)]
讨 论
近几年我国临床试验注册数量虽出现大幅度增长,但总体的临床试验注册率仍远低于发达国家。截止2020年12月31日,共有157项AP相关临床研究在ChiCTR与ClinicalTrials.gov数据库上注册,远低于已收录在中国知网、万方等数据库中的AP临床研究数量,主要原因是目前我国中文医学期刊未实行“不发表未经注册的临床研究结果”这一政策[9]。
本研究结果显示,中国AP临床研究注册数量整体随时间呈增长趋势,ChiCTR与ClinicalTrials.gov数据库中注册的研究数量变化趋势较为一致,不同之处在于ChiCTR数据库中的AP临床研究注册数量在2017年之后快速增长,而ClinicalTrials.gov数据库中的中国AP临床研究注册数量在2017年之后维持在较低水平甚至略有下降。原因一方面是由于研究数量的增加和注册意识的提高,另一方面可能是根据实施地注册原则,美国ClinicalTrials.gov在2017年时回复了多封来自中国学者的申请注册邮件,告知其根据实施地注册原则,应考虑在ChiCTR上注册[10-14]。ICMJE要求临床试验应在招募受试者之前完成注册,但注册的AP临床研究中,仍有44项(28.0%)临床研究为补注册,可能原因是一些研究者错误理解临床研究注册的目的,认为注册只是为了顺利发表文章,在向国际医学期刊投稿后才知道需要进行临床试验注册,最终导致补注册[3,14]。数据质量既能反映临床试验的设计水平,也能反映临床试验的管理水平[11]。有学者认为,研究者对数据管理缺乏了解是导致临床试验质量较低的主要原因之一[12]。从2016年3月14日起,ChiCTR要求注册时必须提供数据管理信息,其中包括是否建立完备的数据管理委员会,这可以解释在2015年至2020年注册的临床研究中具备数据管理委员会的占比更多,但总注册研究中具备数据管理委员会的仍然较少,仅有67项(42.7%)。
我国AP相关临床研究的注册情况存在较大的地区不均衡性,注册数量位于前5位的地区多为经济发达的省(市)。注册数量较多的单位包括四川大学华西医院、南昌大学第一附属医院、东部战区总医院、海军军医大学第一附属医院、上海交通大学医学院附属瑞金医院、空军军医大学第一附属医院。可能的原因应考虑到上述医院的综合实力较强,属于国内大型的AP诊治中心,AP诊疗的水平较高。
在循证医学领域中,RCT提供的证据质量等级最高,但现实实践中的RCT常常是不规范注册和实施的。就盲法和随机化而言,本研究纳入的157项注册的AP临床试验中研究设计以RCT为主,共84项,其中使用盲法的仅34项(40.5%)。ChiCTR数据库中有5项模糊地将盲法使用情况描述为“单盲”、“双盲”等,未提及对何者采用盲法。ChiCTR数据库中虽然有50项注册的RCT全部说明是随机化分组,但存在假随机、随机序列产生和分配序列隐藏方法说明不充分的情况。多数随机序列产生方法仅简单描述为“随机数字表”,仅4项提及分配序列隐藏方法。有研究表明,对盲法、随机序列产生、分配序列隐藏的说明不清晰或不充分会夸大干预效果,比值比分别为0.87、0.89、0.93[13-14]。在注册项目时,部分研究者对概念理解有偏差,ChiCTR数据库注册的99项临床试验中有12项关于研究设计选填错误,例如横断面研究本属于观察性研究设计类型,注册者却认为其属于干预性研究设计类型;析因分组、单臂、非随机对照试验本属于干预性研究设计类型,注册者却认为其属于观察性研究设计类型[15]。在ClinicalTrials.gov数据库中有2项注册的临床研究的研究设计是单臂,注册者却标明了采取随机化。中国正在经历着从无注册观念到观念建立,再到规范、严谨的注册之中[16]。
本研究纳入的注册试验中绝大多数由非营利性机构资助,由制药企业资助的注册试验仅6项。虽然不同经费来源的试验都有可能出现误差,但经费来源于制药企业的试验有更大的发表偏倚,因为利益关联普遍存在于研究者、学术机构和企业之间[17]。因此全面收集基金资助的完整信息利于反映试验的真实信息、鉴别发表偏倚[18]。研究者在注册时应完整规范地填写基金项目名称或经费确切来源。在2015年至2020年注册的随机对照试验数多于2007年至2014年,但占比较少,可能是由于越来越多的非干预性研究在ChiCTR和ClinicalTrials.gov数据库上注册。样本量越大,检验效能越高,试验结果的可靠程度越高。2015年至2020年时间段的随机对照试验数占比较前一时间段减少,因此倾向于更大样本量,以提高试验结果的真实性。
本研究仅纳入在ChiCTR和ClinicalTrials.gov数据库上注册的AP临床研究,未考虑在其他注册平台注册的在我国开展的AP临床研究和未注册的临床研究,不能代表我国AP临床研究的整体水平。
综上所述,注册的中国AP临床研究数量整体随时间呈上升趋势,研究的经费来源以自筹和公共财政为主,Ⅱ、Ⅲ期临床试验仍较为缺乏。
利益冲突所有作者均声明不存在利益冲突
