增强CT的动脉早期与动脉晚期扫描对胰腺癌肝脏小转移灶的诊断价值
2021-08-30史红媛程申濠张晶徐青
史红媛 程申濠 张晶 徐青
南京医科大学第一附属医院放射科,南京 210009
胰腺导管腺癌恶性程度高,预后差,5年总体生存率低于6%[1]。评估肿瘤的可切除性及准确的N分期、M分期对确定最合适的治疗方案和评估患者的预后至关重要。多期增强CT是胰腺癌术前分期最主要的影像手段[2],动脉晚期(胰腺实质期)被认为是诊断胰腺癌的最佳时相,可以获得正常胰腺组织和肿块间的最佳对比度[3]。但动脉晚期对于胰腺癌肝脏转移,尤其是小转移灶(长径<1 cm)的检出有无优势,目前尚无相关报道。因此,本研究比较增强CT动脉早期及动脉晚期扫描对胰腺癌肝脏小转移灶的诊断效能,以提高胰腺癌术前分期的准确率,优化术前分期CT扫描方案。
资料与方法
一、一般资料及分组
回顾性分析南京医科大学第一附属医院2017年12月至2020年8月间93例经病理证实的胰腺导管腺癌患者的临床资料。其中男性56例,女性37例;年龄45~85岁,平均53岁。纳入标准:(1)术前行CT增强检查;(2)伴有单发或多发肝脏转移灶并经术中活检病理证实;(3)既往无其他恶性肿瘤史。排除标准:(1)在CT检查前接受过化疗或局部治疗;(2)任一肝脏转移灶长径≥1 cm;(3)图像质量不佳。按数字表法随机将患者分为2组,其中47例行动脉早期+门静脉期扫描(动脉早期组),46例行动脉晚期+门静脉期扫描(动脉晚期组)。
二、CT扫描
采用Siemens Emotion 64排螺旋CT机扫描,电压120 kV,管电流160 mAs,常规扫描层厚5 mm,层间距5 mm,重建薄层层厚1.5 mm。患者检查前禁食4 h,扫描前口服500~1 000 ml水作为胃肠阴性对比剂。增强扫描采用静脉注射对比剂欧乃派克350 mgI/ml,注射速率4 ml/s,采用对比剂跟踪触发扫描,触发阈值为100 Hu,触发后于20、60 s分别行动脉早期及门静脉期扫描。
采用Siemens Force CT扫描机,对比剂及扫描参数同上。增强扫描于35、60 s分别行动脉晚期及门静脉期扫描。
三、图像观察与数据处理
CT图像由2名有经验的放射科医师采用盲法独立阅片。转移灶的显示情况分为5级:1级为肯定无转移灶,2级为可能无转移,3级为不确定是否转移,4级为可能有转移,5级为肯定有转移。只要有一个病灶被1位医师评为4级或5级,即认为该病例为阳性。测量每个转移灶横断面的最长径,观察并记录动脉早期、晚期病灶是否环形强化及静脉期病灶强化情况(强化主要与周围正常肝实质做对比)。强化情况意见不统一时,由两位医师协商决定达成一致。
四、统计学处理

结 果
一、胰腺癌肝脏小转移灶的影像学特征
93例胰腺导管腺癌患者中41例伴有57个肝脏小转移灶,其中单发28例,多发13例(2~5个)。肝脏小转移灶长径为(7.49±1.53)mm。
动脉早期组47例中21例伴28个肝脏小转移灶,病灶长径为(7.33±1.40)mm;动脉晚期组46例有20例伴29个肝脏小转移灶,病灶长径为(7.69±1.67)mm。两组患者肝脏小转移灶长径的差异无统计学意义(t=-0.547,P=0.664)。动脉早期组的28个小转移灶在动脉早期显示环形强化12个(42.9%),动脉晚期组的29个小转移灶在动脉晚期显示环形强化20个(69.0%);57个肝脏小转移灶静脉期强化均低于周围肝实质(图1)。
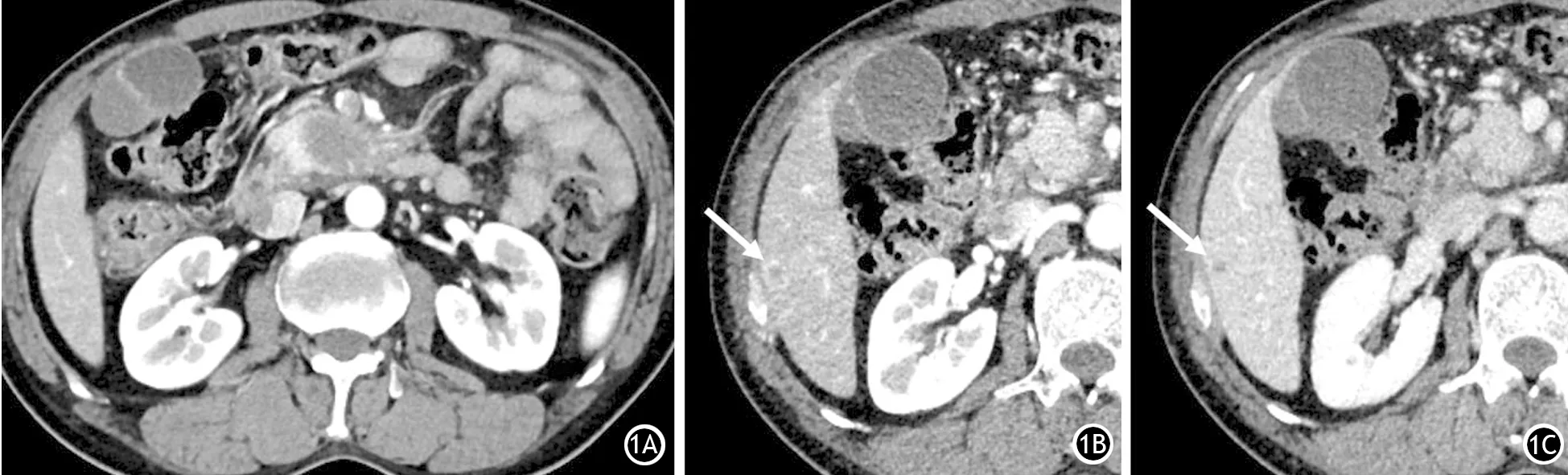
图1 增强CT的动脉晚期扫描示胰头钩突部一乏血供软组织肿块(1A),肝脏S6段一小低密度灶,边缘环形强化(1B,↑),门静脉期示病灶强化低于正常肝实质(1C,↑)
二、两组的诊断结果
动脉早期组47例患者中肝脏小转移灶评估结果为1~3级者35例,4~5级12例。动脉晚期组46例患者中评估结果为1~3级者34例,4~5级12例。
三、两组的诊断效能
动脉早期组和晚期组检出肝脏小转移灶的ROC曲线下面积分别为0.657(95%CI0.531~0.782)、0.810(95%CI0.672~0.947);动脉早期组准确度、灵敏度、特异度、阳性预测值及阴性预测值分别为68.1%、61.9%、75.0%、88.5%、42.9%,动脉晚期组分别为82.6%、65.7%、100%、100%、75.8%,动脉晚期组对肝脏小转移灶的检出效能高于动脉早期组(图2)。

图2 动脉早期组(2A)和动脉晚期组(2B)检出肝脏小转移灶的ROC曲线
讨 论
根治性手术切除是胰腺癌患者获得生存的唯一有效手段,然而仅有15%~20%的患者有根治性手术切除的机会。近一半患者在发现时已有远处转移,其中肝脏是最常见的远处转移脏器。对于体积较大的肝脏转移灶,影像学检查可做出准确诊断,而术前对肝脏转移灶,尤其是长径<1 cm小转移灶的鉴别仍具有较大挑战。约19%的患者由于术前未发现肝脏转移而进行不必要的手术探查[4]。
既往研究表明,MRI的普美显(Gd-EOB-DTPA)增强及扩散加权成像对胰腺癌肝转移灶,尤其<1 cm的小转移灶的检出具有较高的灵敏度,可达80%以上[5-6]。但目前有关胰腺癌术前评估相关指南,包括美国国家综合癌症网络(NCCN)、欧洲肿瘤内科学会(ESMO)及美国临床肿瘤协会(ASCO)等并未推荐对所有患者术前进行MRI检查。然而有研究表明胰腺癌患者肝脏常常会伴有<1 cm的局灶性病变,其中近16%为肝脏转移[7]。因此,提高增强CT对于肝脏小转移灶的检出,对胰腺癌准确分期及后续治疗方案的选择至关重要。
最近一篇Meta分析报道3期和4期CT增强扫描相比单期或双期扫描对肝脏转移的检出灵敏度最高[8]。既往也有研究认为CT静脉期显示乏血供肝脏转移瘤优于其他期相,但研究纳入的转移灶的长径为22 mm(4~105 mm)[9],而对于小转移灶的CT显示率尚不明确。本研究结果显示,相比动脉早期,动脉晚期(胰腺实质期)对胰腺癌肝脏<1 cm的转移灶有较大的优势,其检出率高的主要原因是在动脉晚期转移灶边缘出现环形强化的概率较高(69.0%),再结合静脉期呈低密度表现,有利于小转移灶的诊断。有研究表明,转移灶周边环形强化可能与肿瘤周围的纤维基质增生密切有关,同时伴炎症细胞浸润及血管增生[10]。也有文献报道,胰腺癌的肝转移灶多呈侵袭性生长,侵犯周边血管,尤其是门静脉管壁较薄,压力较小,肿瘤易造成门静脉管腔狭窄,血供减少,从而导致动脉代偿血供增加[11]。动脉早期不利于环形强化的显示推测可能与强化的肝动脉血弥散到肿瘤周围血管的间隔时间有一定关系。
本研究结果表明,动脉早期组和晚期组对肝脏小转移灶检出灵敏度分别为61.9%和65.7%,与Motosugi等[5]采用双动脉期+门静脉期+延迟期研究的3位阅片者对肝脏转移灶(平均直径为1 cm,范围0.2~4.1 cm)检出的灵敏度均为60%的结果是一致的。间接提示双动脉期检出的灵敏度并未获得显著提高,采用动脉晚期+门静脉期即可提高肝脏小转移灶的检出。此外,胰腺癌相关指南也推荐增强CT动脉晚期是诊断胰腺癌的最佳期相,同时能够满足胰周动脉的评估。因此在临床评估中可取消动脉早期,减少患者的受线量。需要指出的是虽然动脉晚期可提高小转移灶的检出,但相比MRI敏感度仍较低,因此,对于可疑或不确定病例仍需进行MRI扫描。
本研究的局限性主要在于动脉早期及动脉晚期的两种扫描方案非同一组患者,会导致研究结果可能存在一定误差。其次,未对多发转移灶进行病灶逐一分析。
综上所述,增强CT的动脉晚期扫描可提高胰腺癌肝脏小转移灶(<1 cm)检出率,采用动脉晚期+门静脉期即可达到胰腺癌原发肿块、胰周血管及远处转移情况的评估。
利益冲突所有作者均声明不存在利益冲突
