PRSS1基因突变导致的遗传性胰腺炎一例及其家系突变分析
2021-08-30陆妍郑玉灿李玫李里林谦
陆妍 郑玉灿 李玫 李里 林谦
1南京医科大学附属儿童医院消化科,南京 210008;2南京医科大学附属儿童医院科研科,南京 210008
【提要】 遗传性胰腺炎(HP)是一种临床罕见的常染色体显性遗传的疾病。患者发病较早,表现为反复的急性胰腺炎发作,后逐渐进展为慢性胰腺炎,甚至出现胰腺癌和其他并发症。目前已发现多个与HP相关的基因突变位点,其中以PRSS1基因R122H突变最为常见。对可疑的HP患者进行基因测序,实现早期诊断、早期干预和管理,对延缓疾病进展、改善疾病预后具有重要意义。
遗传性胰腺炎(hereditary pancreatitis,HP)是一种罕见的常染色体显性遗传疾病[1]。HP患者一般具有胰腺炎的临床症状,排除酗酒、胆石、创伤、药物、感染等常见的胰腺炎诱因,经基因检测可发现相关致病基因的功能性突变[2]。目前已知的HP相关基因主要有丝氨酸蛋白酶1(serine protease 1,PRSS1)、丝氨酸肽酶抑制因子Kazal型1(serine protease inhibitor kazal-type 1,SPINK1)、糜蛋白酶C(chynotrypsin C,CTRC)和囊性纤维跨膜转导调节子(cystic fibrosis transmembrane regulator,CFTR)。其中,PRSS1基因在欧美人群中被认为是导致HP的主要原因,占HP的80%[2-7],而其中又以R122H突变最为常见[8-9]。然而,HP相关基因突变频率在不同遗传背景的人群中差异较大,在亚洲人群中,PRSS1突变频率极低[10-12],中国人群中R122H突变也十分罕见,也未有过R122H突变相关HP家系的报道[13-15]。本研究报道1例中国人群R122H基因突变导致的HP家系,并对其突变情况、发病特征、疾病管理进行探讨。
一、临床资料
患儿男性,6岁。因“腹痛5 d”入院。5 d前无明显诱因出现阵发性腹痛,脐周为主,无放射痛,伴非喷射性呕吐2~3次,呕吐物为胃内容物,未见胆汁。当地医院查淀粉酶升高,腹部MRI示急性胰腺炎,予禁食、头孢他啶、奥曲肽、补液等治疗5 d,患儿腹痛改善,近2 d未呕吐,复查淀粉酶仍高于正常,故转至我院。病程中患儿无腹泻,无发热,大小便正常。患儿近1年来有3次急性胰腺炎病史,均予禁食、抑酸、抗感染、静脉营养等治疗7~20 d后症状改善。入院体检:生命体征正常,体重17 kg,身高115 cm;神志清楚,精神可,呼吸平稳,皮肤黏膜无皮疹及黄染,心肺听诊无特殊;腹软,脐周轻压痛,无反跳痛,无包块,肝脾肋下未及,双下肢无水肿。实验室检查:血常规、尿常规、血生物化学、凝血常规、体液免疫、细胞免疫均无异常。胸片显示正常。入院第1天查抗核抗体IgG阳性,细胞核-致密斑点型1∶100;血淀粉酶367 U/L,血脂肪酶1 728 U/L。腹部MRI示胰腺体积增大,实质内见网格状长T1、T2信号影,胰腺周围见长T2信号影,胰管未见明显扩张;肝脏体积无扩大,边缘光滑,肝实质信号未见明显异常,肝内胆管及左右肝管无扩张;胆囊饱满,腔内未见明显充盈缺损;脾脏大小、形态及信号未见明显异常(图1)。MRCP示肝内胆管、肝总管、胆总管、胰管无扩张。诊断为急性复发性胰腺炎。予禁食、肠内及肠外营养、奥美拉唑抑酸、奥曲肽抑制胰腺分泌等治疗8 d后,血淀粉酶及脂肪酶水平降至正常,症状好转出院。出院后予高卡短肽高中链脂肪酸配方部分肠内营养。随访3个月,无胰腺炎再次发作,体重增长至19.5 kg。
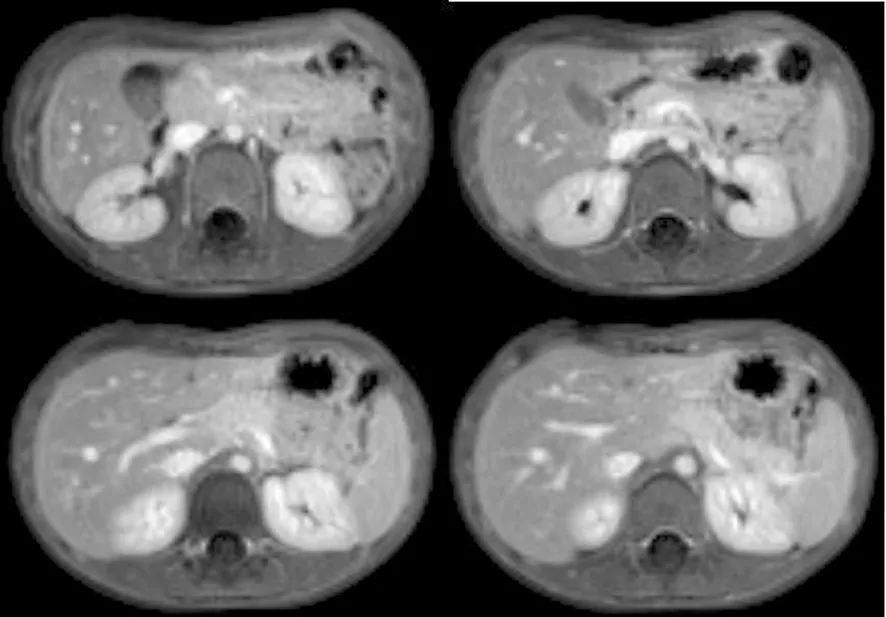
图1 患儿腹部MRI征象
二、家系调查
患儿(Ⅲ-3)父母非近亲婚配,患儿母亲(Ⅱ-2)孕期有血淀粉酶增高病史,父亲(Ⅱ-1)体健;大姐(Ⅲ-1)现13岁,体健,二姐(Ⅲ-2)现11岁,自10岁起曾有2次急性胰腺炎病史,予禁食、抑酸、静脉营养等治疗7~10 d后症状改善(图2)。否认其他家族成员遗传性疾病病史。
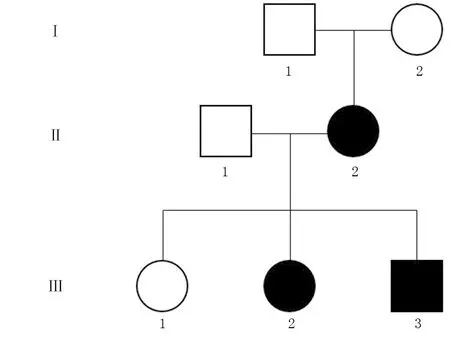
图2 遗传性胰腺炎患儿家族谱系图
三、基因检测
经家长知情同意,分别抽取患儿、患儿父母及患儿大姐、二姐外周静脉肝素抗凝血3 ml进行芯片捕获高通量测序(北京全谱医学检验实验室)。从受检者外周血中提取基因组DNA构建基因组文库,然后通过IDT The xGen Exome Research Panel v2.0全外显子捕获芯片捕获目前已知与疾病相关基因(约5 000个)的外显子区及相邻内含子区域(50 bp)并进行富集。富集后的目的基因片段通过高通量测序仪进行测序。测序所得基因数据经过分子生物学注释、生物学、遗传学及临床特征分析,结合致病突变数据库、正常人基因组数据库、已知4 000种遗传病临床特征数据库等对基因变异进行分级。变异分级采用3要素分级体系以及ACMG(美国医学遗传学会)基因变异分级体系。对测序得到的疑似致病突变的目标序列进行PCR扩增,上ABI3730测序仪进行Sanger测序验证,并经序列分析软件获得验证结果。
基因序列分析结果显示,患儿7号染色体PRSS1基因的3号外显子存在杂合变异:c.365 G>A(鸟嘌呤>腺嘌呤)/p.R122H(精氨酸>组氨酸)。按照ACMG变异分类标准,c.365 G>A/p.R122H变异可归类为“可能致病性变异(likely pathogenic)”。Clinvar数据库定义该变异为“致病性”。OMIM数据库表明,PRSS1基因杂合突变可导致遗传性胰腺炎(OMIM:167800)。
经Sanger测序验证,患儿母亲、患者二姐均携带c.365 G>A/p.R122H杂合变异,患儿父亲、患儿大姐PRSS1基因未检出c.365 G>A/p.R122H变异(图3)。患者家族谱系分析显示患儿、患儿二姐的突变c.365 G>A/p.R122H来源于母亲,符合常染色体显性遗传病。
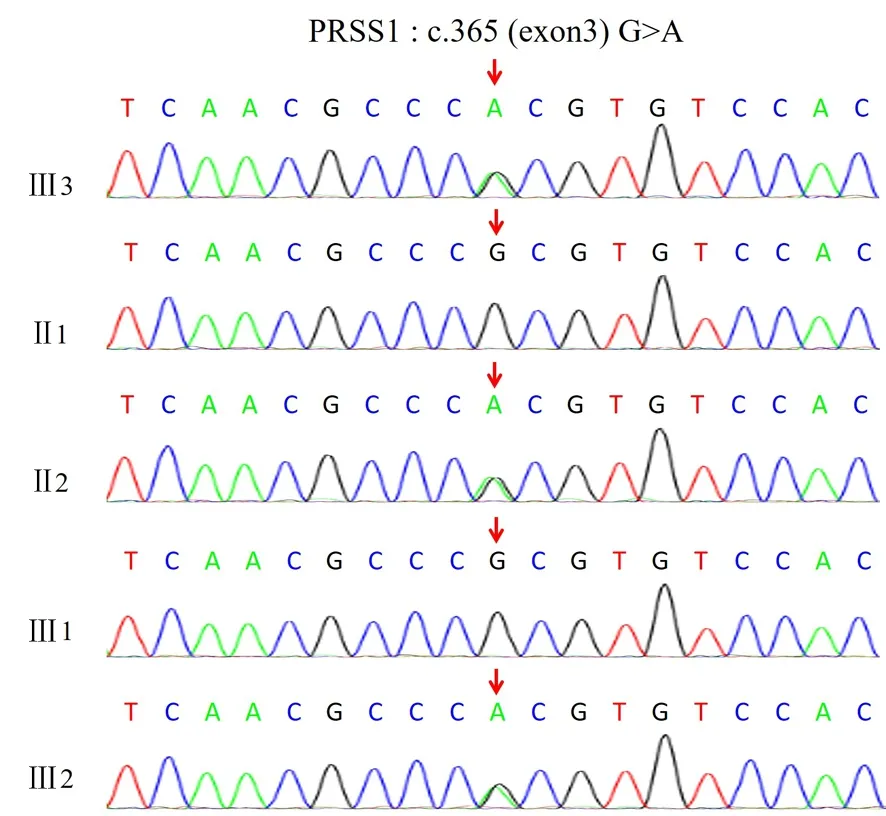
图3 遗传性胰腺炎家族谱系PRSS1基因分析结果
讨论HP由Comfort和Steinberg在1952年发现并确立[16]。该疾病早期常出现反复的急性胰腺炎发作,表现为突发的上腹部疼痛伴血清淀粉酶及脂肪酶水平升高>3倍正常值上限或存在胰腺急性炎症影像学改变[17]。HP在临床上十分罕见,许多患者在基因检测前无法确定病因,被诊断为特发性胰腺炎[17]。研究表明,HP是引发儿童胰腺炎的主要原因之一,诊断为先天性急性、复发性急性或慢性胰腺炎的患儿中分别有33.0%、45.4%和54.4%是遗传因素导致的[18]。
1996年Whitcomb等首次发现了与HP相关的基因PRSS1。该基因位于7号染色体长臂(7q35),含有5个外显子,仅在胰腺中表达,编码阳离子胰蛋白酶原[1-2,19-20]。通过基因序列分析,Whitcomb等[20]发现了PRSS1基因上与HP相关的R122H突变。R122H突变是一种功能获得性突变,胰蛋白酶第122位精氨酸到组氨酸的突变引起了胰蛋白酶自溶位点消失,使胰蛋白酶无法自溶,在胰腺组织内不断累积,导致胰腺自身消化,引起胰腺炎[21-22]。
R122H不仅是欧美人群中首个被发现与HP相关的基因突变,也是在HP中最常见的一种突变[8-9]。然而在不同遗传背景的人群中,HP相关基因突变的频率分布不同,中西方人群间具有较大差异。亚洲的研究报道,PRSS1突变频率很低[10-12]。对中国人群HP相关基因突变频率的几项大规模研究报道结果也显示R122H的发生率很低。2008年Liu等[13]在54例慢性胰腺炎和120例健康对照中未检测到R122H突变。2013年Wang等[14]在75例遗传性慢性胰腺炎患者中检测到5例R122H突变。2018年Zou等[15]在1 061例慢性胰腺炎患者和1 196例对照组中检测到19例R122H突变。然而,以“PRSS1”、“Chinese family”和“R122H”为关键词在PubMed和中国知网中均未检索到中国人群R122H突变的家系报道。本研究首次报道1例中国人R122H突变导致遗传性胰腺炎的家系。该家系中,先证者是一名6岁男童,近一年内有3次急性胰腺炎病史,其二姐,11岁,近1年内有2次急性胰腺炎病史,其母亲,孕期有血淀粉酶增高病史,其父亲、大姐均体健,且否认其他家族成员遗传性疾病病史。经全外显子测序发现,先证者及其二姐、母亲均带有PRSS1基因R122H突变,符合常染色体显性遗传病的遗传规律。
HP相关基因突变会使胰腺炎患病风险显著提升,不同基因突变的致病性也存在差异,其中R122H基因突变对胰腺炎患病风险的提升高达1 000~2 000倍[23]。相比之下,SPINK1基因的N34S杂合突变和CFTR基因突变提升胰腺炎患病风险为20~40倍,而酒精对胰腺炎患病风险的提升仅为3~11倍[24-25]。然而,并非所有R122H基因突变携带者都会发病,R122H的外显率为80%,即有20%的R122H基因突变携带者可能并不会发病[2,26]。本研究所报道的家系,由于未获得先证者外祖父母的血液样本,无法获知先证者母亲R122H基因突变的来源。该突变可能来自于其自发突变,也可能是遗传自其父母中的一方。而先证者外祖父母并无胰腺炎发病史,如果他们是R122H基因突变携带者却未发病,就可能是由于该基因的外显不全导致的。除此之外,HP的发病也与环境因素相关[23]。同一家族中的基因突变携带者是否发病、起病时间、严重程度可能也与环境中的触发因素有一定相关性。
HP通常起病年龄较早,随着病程进展,胰腺炎反复发作,使胰腺实质损伤加重、胰管变形,可能由急性复发性胰腺炎逐渐进展为慢性胰腺炎[17]。据报道,50%的PRSS1基因突变携带者会在起病25年内发展为慢性胰腺炎[23]。而慢性胰腺炎被认为一旦发生,其发展就不能逆转[27]。随着慢性胰腺炎的发展,HP患者罹患胰腺癌的风险也显著增加,较非HP患者高50~60倍[28];PRSS1基因突变的HP患者不论基因突变位点如何,其终身胰腺癌患病风险高达40%[28]。除此之外,HP出现外分泌功能不全、糖尿病、胰腺结石、脂溢等并发症的风险也显著高于其他形式的胰腺炎[2,15]。在对中国人群HP的大规模研究中,R122H被发现是一种极强的慢性胰腺炎诱发因素,在各种HP相关基因突变中排首位,平均起病年龄最早,胰腺结石风险也最高[15]。因此,对于这种具有强大影响的潜在遗传风险,对可疑HP患者进行基因检测实现早期诊断,从而进行早期干预和早期管理,对预防和延缓疾病进展、改善患者预后等具有非常重要的意义。
目前对于HP并没有特异性的治疗方法,患者一旦确诊,就应该注意生活方式管理和提升胰腺癌筛查意识,以预防和延缓疾病的发生。比如,吸烟和饮酒均被认为是会加快HP疾病进展的环境诱发因素。吸烟会使HP患者对胰腺癌的患病风险增加约1倍,且胰腺癌的发病年龄比相同人群约早20年[29];饮酒也会增加HP患者对慢性胰腺炎的患病风险[23]。因此,HP患者和家属应尽量避免已知会加重或恶化胰腺炎的环境诱发因素,包括吸烟、饮酒、高脂饮食、脱水、情绪压力等[5,30]。同时,HP患者也应注意胰腺癌的早期筛查。国际胰腺遗传病研讨会专家共识指南建议,HP患者应在40~45岁开始胰腺癌的筛查,如果HP患者具有胰腺癌家族史,则筛查的开始年龄应比家系成员中胰腺癌发病的最小年龄再提前10~15年,并且每1~3年进行一次筛查[31-32]。本研究报道的家系成员确诊HP后,笔者也对该家系进行了关于生活方式管理和胰腺癌筛查的健康宣教,目前家系成员健康状况均良好。笔者也将定期随访以进一步认识疾病进展规律,并为患者提供健康指导。
利益冲突所有作者均声明不存在利益冲突
