‘伏蜜’桃果实成熟期间的色泽和抗氧化活性变化
2021-08-28苏明申叶正文刘苗会杜纪红周慧娟李雄伟张夏南
苏明申,叶正文∗,刘苗会,杜纪红,周慧娟,李雄伟,张夏南,潘 琦
(1上海市农业科学院林木果树研究所∕上海市设施园艺技术重点实验室,上海201403;2上海苗荟农产品专业合作社,上海201301)
桃果实生长发育过程中,果皮色泽、果肉色泽、抗氧化系统和硬度都发生了变化[1-4]。桃果实成熟度主要根据果皮底色和果重及果肉底色和硬度等判断[4-7]。无损方法是用来鉴定桃果实成熟度的重要手段,但不同品种间的表现差异较大[8]。桃果实发育早期,果皮色泽与硬度没有明显的相关性;发育中后期,硬度降到一定范围后,果皮色泽与硬度才有较好的相关性[2,9],且品种不同,相关性程度也不同[1,9]。
植物正常代谢会产生活性氧和丙二醛(MDA),逆境胁迫会增加活性氧和MDA含量[10],所以活性氧和MDA含量可反映植物的抗氧化胁迫程度[11-12]。抗氧化系统由抗氧化酶[如超氧化物岐化酶(SOD)、多酚氧化酶(PPO)、脂氧合酶(LOX)等]和抗氧化剂(如总酚、总类黄酮等)两部分组成,具有消除活性氧的作用[3,11,13]。
‘伏蜜’桃是中晚熟白肉品种,在上海地区果实采收期为7月下旬至8月上旬,果实套袋可有效防止病虫害对果实的侵害[14]。本试验对套袋‘伏蜜’桃果实中后期发育的色泽和抗氧化机制变化进行研究,以期为桃果实的成熟度和抗性水平的判别提供参考。
1 材料与方法
1.1 试验品种、地点、植株概况
试验桃品种为‘伏蜜’,2008年春定植于上海市奉贤区奉城镇花厅村上海花厅果林公司种植基地,树形为开心形,株行距为4 m×4.5 m,盛花期为3月24日,成熟期为8月1日,果实发育期约130 d。2015年选生长势较为一致的30株树作为试验植株,5月下旬供试果实均套上黄色不透明单层袋,其余田间管理同常规中晚熟桃管理。
1.2 发育时期果实样品的选取
2015年7月12日、7月22日和8月1日,在供试树的树冠外围分别随机采10个以上无机械和病虫害损伤的果实,测定纵、横、侧径及硬度和色差。分别取这3个发育时期的果肉,切成小块后置于-40℃冰箱中冷藏,待测定果肉的色素、活性氧、丙二醛、总酚和总类黄酮含量、总抗氧化活性、PPO、LOX和SOD酶活性。
1.3 果实生长和硬度的测定
用精确度为0.01 cm的游标卡尺测定果实纵径(果柄至果顶距离)、横径(两个缝合线果面距离)和侧径(两个无缝合线果面距离)[3]。使用8 mm直径探头的果实质构分析仪(南非GÜSS公司制造,2006-FTA型)测定去除了2—3 mm厚果皮的果肉硬度,结果以kg·cm-2表示。
1.4 果实色泽的测定
使用Konica minolta色差仪(日本Konica minolta公司制造,CR-400型)测定果实L∗(亮度值)、A∗(红绿色差值)和B∗(蓝黄色差值)值,并计算色泽饱和度Chroma(C∗)值,C∗=(A∗2+B∗2)0.5[15]。因取样的果实均为套袋果,果皮表面色泽较一致,取果实无缝合线的两个侧面部位测定果皮色泽,所测果皮色泽可基本反映果皮底色。‘伏蜜’桃中外层果肉基本不着红色,果肉色泽较一致,果表切除约2—3 mm厚果皮后测定果肉色泽,所测果肉色泽基本可反映果肉底色。
1.5 果肉总叶绿素和总类胡萝卜素含量的测定
果肉总叶绿素含量参照Yuan等[16]的方法测定,用Beckman7300分光光度计测652 nm处的吸收值,结果以mg·kg-1表示。果肉总类胡萝卜素含量参照Caprioli等[17]的方法测定,用Beckman7300分光光度计测450 nm处的吸收值,结果以mg·kg-1表示。
1.6 活性氧(O2-)和丙二醛(MDA)含量的测定
采用DU-6400紫外可见分光光度计(Beckman Coulter公司,美国),参照Elstner等[18]的方法测定活性氧含量,结果用nmol·h-1·g-1FW表示。丙二醛(MDA)含量参照Heath等[19]的方法进行测定,结果用nmol·g-1FW表示。
1.7 PPO、LOX和SOD酶活性的测定
多酚氧化酶(PPO)活性参照Tsantili等[20]的方法进行测定,结果用U·min-1·g-1FW表示。脂氧合酶(LOX)活性参照Maalekuu等[21]的方法进行测定,结果用U·min-1·g-1FW表示。超氧化物歧化酶(SOD)活性参照Wang等[22]的方法进行测定,结果用U·g-1FW表示。
1.8 总抗氧化活性、总酚和总类黄酮含量的测定
总抗氧化活性参照Razavi等[23]的方法进行测定,结果用mmol·L-1(TE,Trolox等量物)·g-1FW表示。总酚和总类黄酮含量参照Tsantili等[20]的方法进行测定,结果分别用GAE(没食子酸等量物)mg·(100 g)-1FW和CAE(绿原酸等量物)mg·(100 g)-1FW表示。
1.9 数据分析
采用SPSS15.0软件进行显著性分析和线性相关分析。数据以平均值±标准误差(SE)表示。采用Tukey测验分析P=0.05水平的差异显著性。
2 结果与分析
2.1 果实成熟期间的生长变化
果实采收前20 d至成熟期间的生长指标和硬度变化情况见表1。果实纵径、横径和侧径均呈增长趋势,采收前0—10 d的增长速率快于采收前10—20 d。果实硬度呈下降趋势,果实采收前10—20 d的下降速率快于采收前0—10 d。

表1 ‘伏蜜’桃果实成熟期间的纵、横、侧径(A)与硬度(B)变化Table1 Changes in longitudinal,transverse and lateral diameters,and firmness during maturation
2.2 果实成熟期间的果皮和果肉色泽变化
果实采收前20 d至成熟期间的果皮和果肉色泽变化情况见表2。果皮和果肉L∗值从采收前20 d的65.09和77.17分别上升至成熟时的78.17和81.59,采收前0—10 d的增长速率快于采收前10—20 d,果肉L∗值高于果皮L∗值。果皮和果肉A∗值从采收前20 d的-13.11和-12.42分别上升至成熟时的-7.89和-4.96,采收前0—10 d的增长速率快于采收前10—20 d,果肉A∗值高于果皮A∗值。果皮和果肉B∗值从采收前20 d的37.84和31.15分别下降至成熟时的34.49和19.94,果皮B∗值高于果肉B∗值,果肉B∗值的下降速率快于果皮B∗值。果皮和果肉C∗值从采收前20 d的40.07和33.54分别下降至成熟时的35.44和20.58,果皮C∗值高于果肉C∗值,果肉C∗值的下降速率快于果皮C∗值。
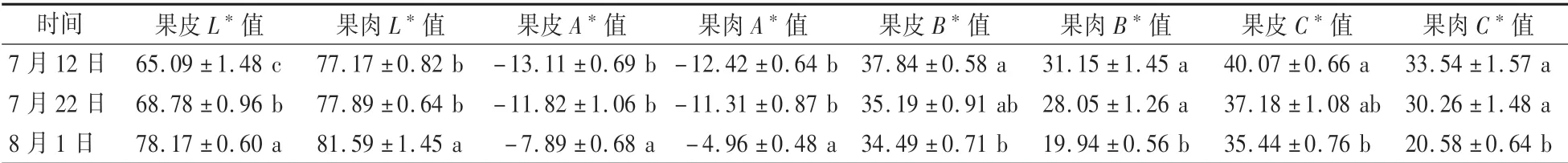
表2 成熟期间的果皮和果肉L∗、A∗、B∗和C∗值变化Table 2 Changes in L∗,A∗,B∗and C∗value of skin and flesh during maturation
2.3 果实成熟期间的果肉叶绿素和类胡萝卜含量变化
果实采收前20 d至成熟期,果肉叶绿素和类胡萝卜素含量均呈下降趋势。果肉叶绿素和类胡萝卜素含量分别从采收前20 d的4.32 mg·kg-1FW和7.87 mg·kg-1FW下降至成熟时的2.65 mg·kg-1FW和2.13 mg·kg-1FW,叶绿素采收前0—10 d的下降速率快于采收前10—20 d,类胡萝卜素采收前10—20 d的下降速率快于采收前0—10 d(图1)。
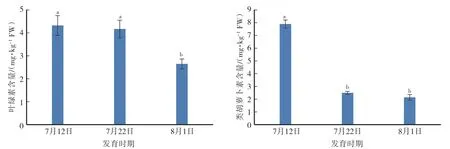
图1 ‘伏蜜’果实成熟期间的总叶绿素和总类胡萝卜素含量变化Fig.1 Changes in contents of total chlorophyll and total caroteniods during maturation of‘Fumi’peach
2.4 果实成熟期间的PPO、总抗氧化、SOD和LOX活性及活性氧和MDA含量变化
果实采收前20 d至成熟期,果肉PPO活性及总抗氧化活性均呈下降趋势。果肉PPO活性从采收前20 d的6.75 U·min-1·g-1FW下降至成熟时的5.75 U·min-1·g-1FW。果肉总抗氧化活性从采收前20 d的14.20 mmol·L-1(TE)·g-1FW下降至成熟时的1.05 mmol·L-1(TE)·g-1FW,果肉总抗氧化活性采收前10—20 d的下降速率快于采收前0—10 d(图2)。
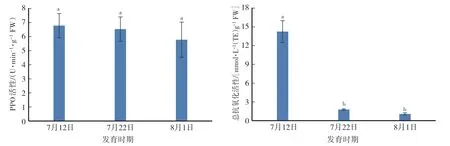
图2 ‘伏蜜’果实成熟期间的PPO和总抗氧化活性的变化Fig.2 Changes in activity of PPO and total antioxidant capacity during maturation of‘Fumi’peach
果实采收前20 d至成熟期间,果肉SOD活性和活性氧(O2-)含量均呈下降趋势。果肉SOD活性从采收前20 d的452.22 U·g-1FW下降至成熟时的315.95 U·g-1FW。果肉活性氧(O2-)含量从采收前20 d的1.09 nmol·h-1·g-1FW下降至成熟时的0.06 nmol·h-1g-1FW(图3)。
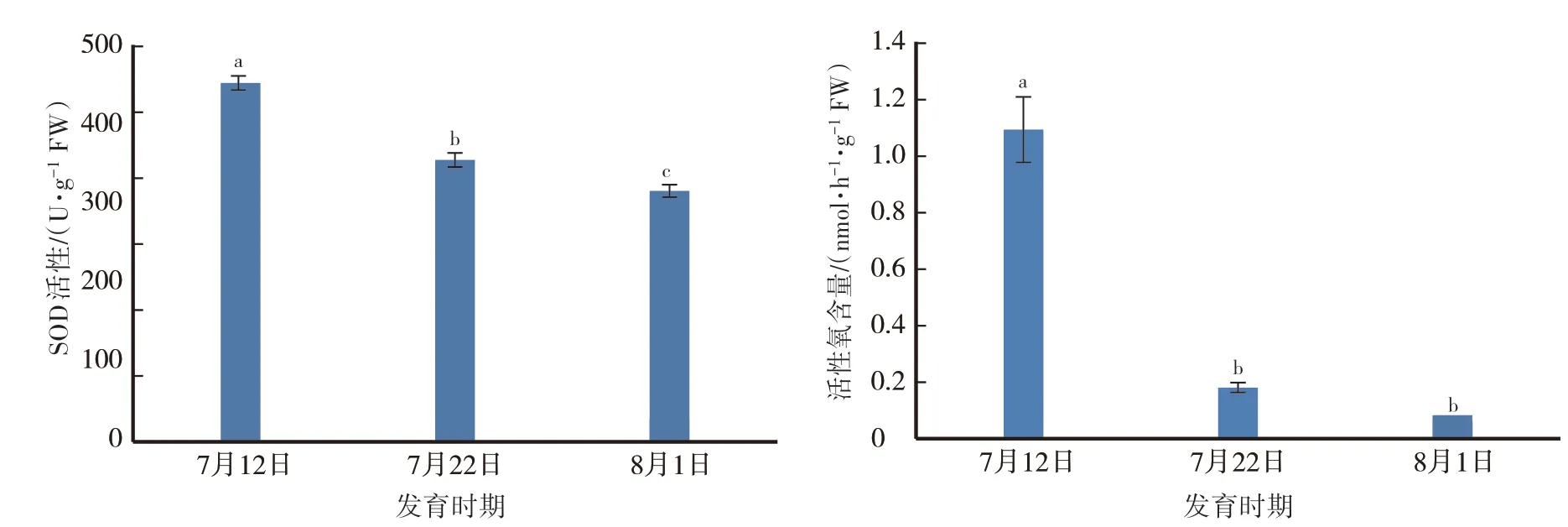
图3 ‘伏蜜’果实成熟期间的SOD活性和活性氧含量变化Fig.3 Changes in SOD activity and superoxide content during maturation of‘Fumi’peach
果实采收前20 d至成熟期间,果肉LOX活性及MDA含量均呈下降趋势。果肉LOX活性从采收前20 d的21.35 U·min-1·g-1FW下降至成熟时的10.15 U·min-1·g-1FW。果肉MDA含量从采收前20 d的40.60 nmol·g-1FW下降至成熟时的27.64 nmol·g-1FW(图4)。
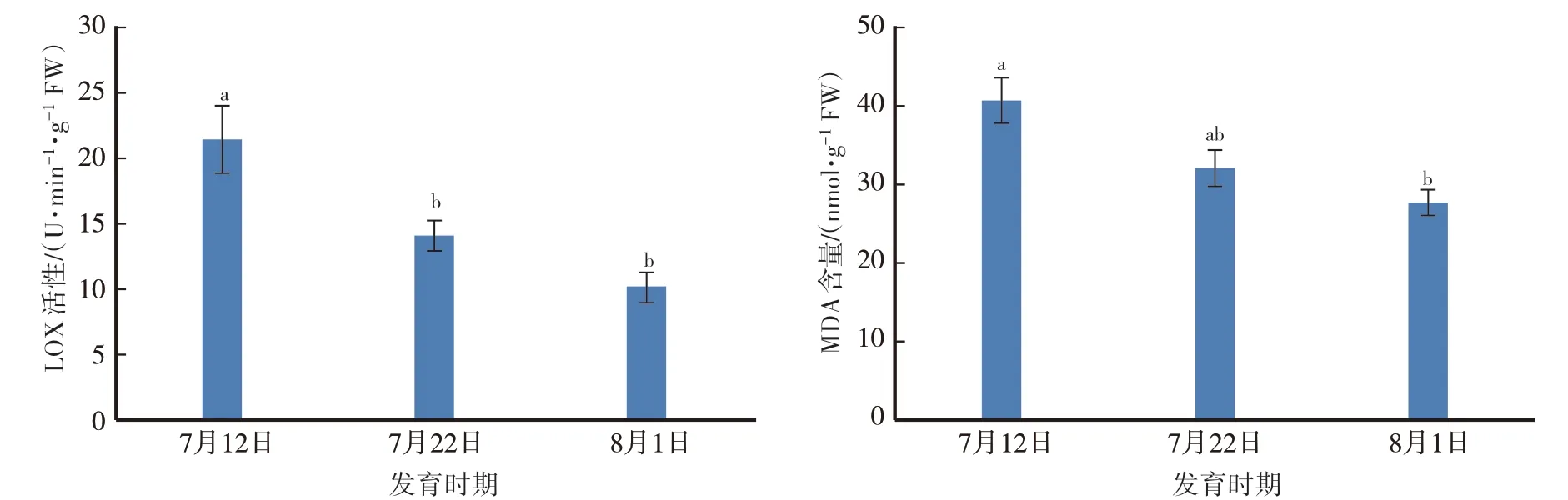
图4 伏蜜果实成熟期间的LOX活性和MDA含量变化Fig.4 Changes in LOX activity and MDA content during maturation of‘Fumi’peach
2.5 果实成熟期间的果肉总酚和总类黄酮含量变化
果实采收前20 d至成熟期间,果肉总酚和总类黄酮含量分别从采收前20 d的55.80 GAEmg·(100 g)-1FW和18.43 CAE mg·(100 g)-1FW下降至成熟时的8.13 GAE·mg·(100 g)-1FW和3.38 CAE mg·(100 g)-1FW。果肉总酚和总类黄酮含量采收前10—20 d的下降速率均快于采收前0—10 d(图5)。
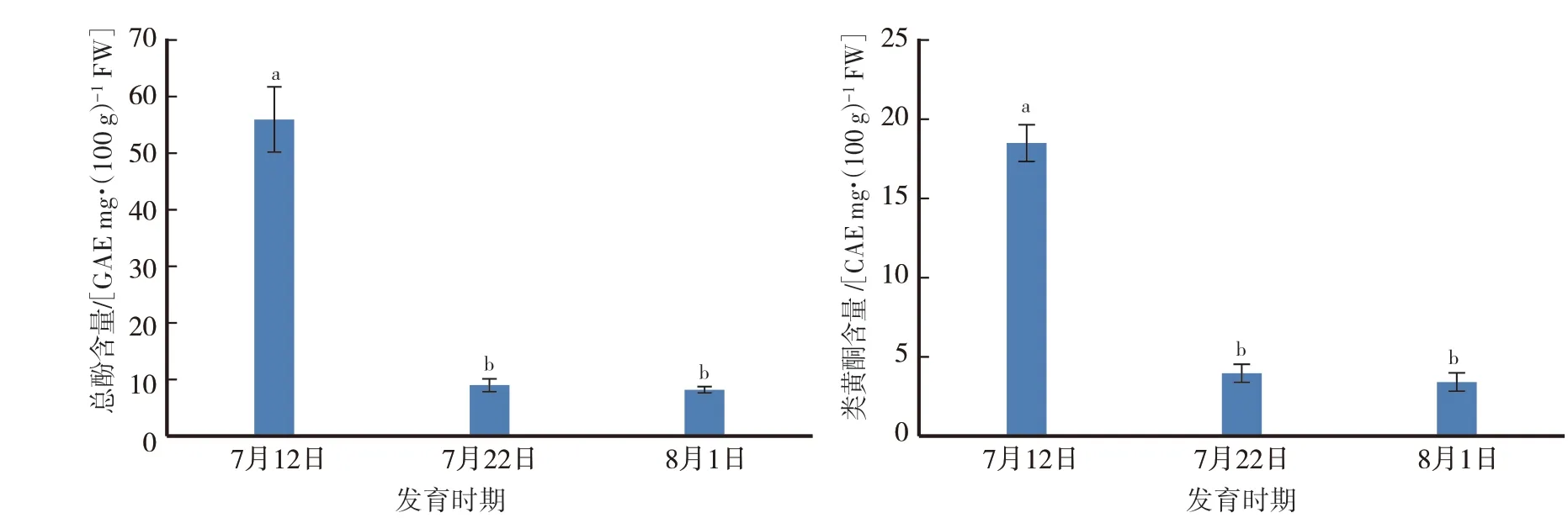
图5 ‘伏蜜’果实成熟期间的总酚和总类黄酮含量的变化Fig.5 Changes in contents of total phenonics and total flavonoids during maturation of‘Fumi’peach
2.6 果实成熟期间所测指标之间的线性相关关系
如表3所示,果实成熟期间硬度与果肉B∗、叶绿素、类胡萝卜素呈显著正相关,与果皮L∗和A∗、果肉A∗呈显著负相关。果肉L∗与A∗呈显著正相关,果肉L∗和A∗与果肉B∗呈显著负相关。果肉叶绿素与A∗呈显著负相关,与B∗呈显著正相关。硬度、LOX、MDA、SOD、活性氧、总抗氧化活性、总类黄酮和总酚相互之间均呈正相关关系(表4)。
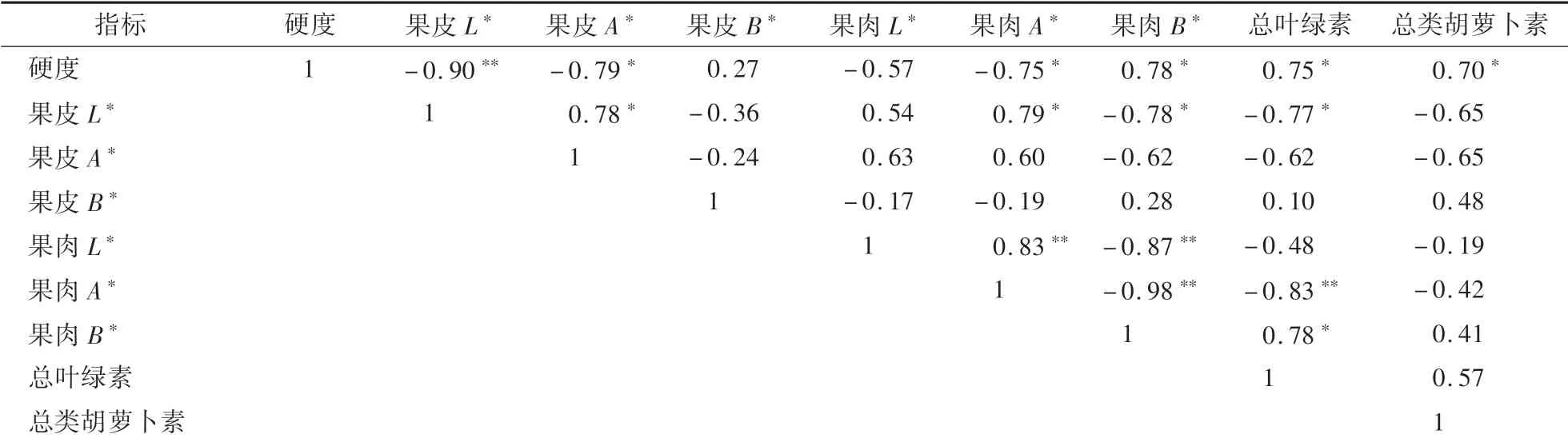
表3 成熟期间果皮和果肉色泽及果肉硬度、总叶绿素和总类胡萝卜素的线性相关关系Table 3 Correlation coefficients of linear relationships between color of skin and flesh,flesh firmness,total chlorophyll and total caroteniods during fruit maturation
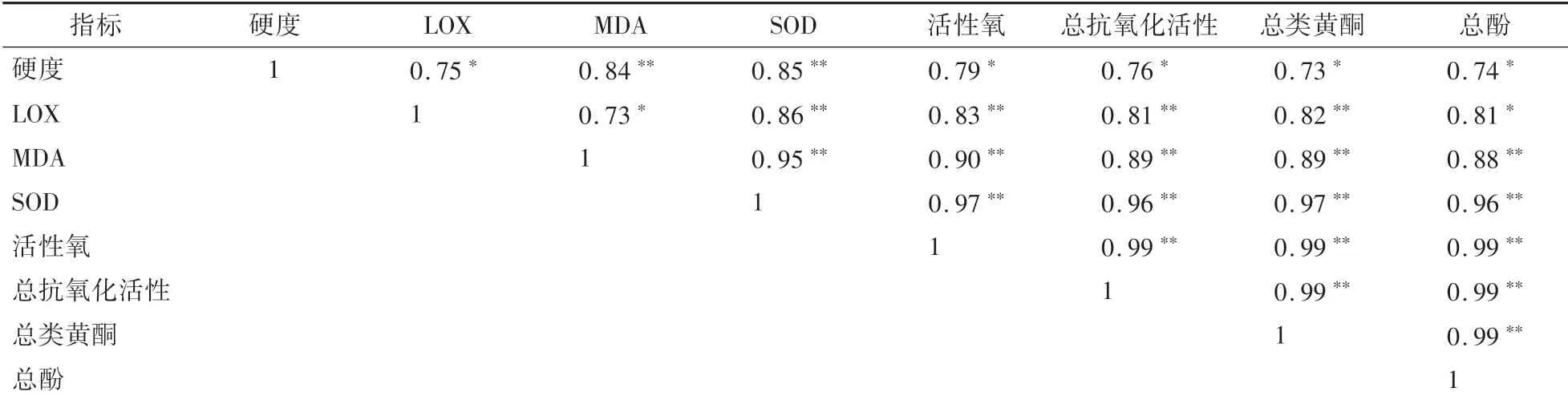
表4 成熟期间果肉硬度、LOX、MDA、SOD、活性氧、总抗氧化活性、总类黄酮和总酚之间的线性相关关系Table 4 Correlation coefficients of linear relationships between flesh firmness,LOX,MDA,SOD,superoxide,total antioxidant activity,total flavonoid and total phenolics during fruit maturation
3 结论与讨论
3.1 成熟期间果实硬度呈下降趋势,果皮L∗值和A∗值呈上升趋势
本研究表明,‘伏蜜’桃果实成熟期间,硬度呈显著下降趋势,与前人在桃发育方面的研究结果基本一致[3,24-25]。果皮色泽是判别桃果实成熟度的重要方式[9,26]。L∗值反应了亮度值,A∗值反应了红绿色差[15-27]。本研究表明,果实发育过程中,果皮L∗值和A∗值呈显著上升趋势,与‘锦香’黄桃和‘沪蟠1号’蟠桃的变化趋势基本一致[7]。果皮L∗和A∗值与果肉硬度呈显著负相关,进一步证实果皮色泽和硬度可作为判别桃果实采收成熟度的参考指标。
3.2 成熟期间果实果肉叶绿素和类胡萝卜素含量呈下降趋势
本研究表明,‘伏蜜’桃果实成熟期间,果肉叶绿素和类胡萝卜素含量逐渐减少,与‘超红’‘白沙’桃果实发育过程的变化基本一致[28]。叶绿素指数是反应桃果实成熟度的一个指标[13]。‘伏蜜’桃果实成熟期间,果肉硬度和叶绿素含量与A∗值显著负相关,与B∗值显著正相关。表明桃果实成熟期间,果肉A∗值、B∗值与叶绿素含量具有一定协同关系。
3.3 成熟期间果实果皮L∗值、A∗值和B∗值分别与果肉L∗值、A∗值和B∗值正相关
果皮与果肉色泽的相关性,使通过光学无损测定果皮色泽估算果肉色泽成为可能,具有实现果实非破坏分级的潜力[2]。但本研究表明,‘伏蜜’桃果实成熟期间,果皮L∗值、A∗值和B∗值分别与果肉L∗值、A∗值和B∗值相关性不显著,根据采收期果皮色泽推测果肉色泽具有一定难度。
3.4 成熟期间果实活性氧、MDA含量与SOD、LOX活性呈下降趋势
活性氧是有可能造成组织伤害的自由基前体[29],SOD酶是清除活性氧的关键酶[30]。MDA含量是衡量膜脂过氧化水平的指标,LOX是膜脂过氧化的关键酶[31]。本研究中,‘伏蜜’桃果实成熟期间,活性氧、MDA含量与SOD、LOX活性呈下降趋势,并且各指标相互之间呈显著正相关关系,表明成熟期间这些指标具有显著的协同关系。
3.5 成熟期间果实总酚和总类黄酮含量及总抗氧化活性呈下降趋势
本研究中,‘伏蜜’桃果实成熟期间,总酚和总类黄酮含量、总抗氧化活性呈下降趋势,与Liu等[32]的研究结果基本一致,抗氧化剂含量(总酚,总类黄酮)和总抗氧化活性显著正相关,与Drogoudi等[13]研究结果类似。PPO是合成酚类化合物(多酚、类黄酮等)的重要酶[13],本研究中,‘伏蜜’桃果实成熟期间,PPO与总抗氧化活性、总类黄酮和总酚含量呈不显著的正相关关系。
