上海地区小麦赤霉病菌群体分析
2021-08-28张建周吴楠楠杨宪立张静雅宫安东王建华
张建周,郜 振,吴楠楠,杨宪立,张静雅,宫安东,王建华∗∗
(1河南省农业科学院小麦研究所,郑州450002;2信阳师范学院,信阳464000;3上海市农业科学院农产品质量标准与检测技术研究所,上海201403)
禾谷镰刀菌复合群(Fusarium graminearumspecies complex,FGSC)引起的小麦赤霉病(Fusarium head blight)是小麦的重要真菌病害,严重影响小麦生产[1],我国的长江流域、黄淮流域等重要冬麦区是小麦赤霉病的常发区,受害尤为严重[1-2]。统计表明:2000—2018年,我国小麦赤霉病每年发生面积均超过450万hm2,约占当年全国小麦种植面积的20%—25%,每年造成的产量损失超过341万t,累计造成直接经济损失超100亿元人民币[3-4]。值得注意的是,2010年以来,我国小麦赤霉病常发区域持续呈重发态势,流行频率显著高于20世纪[5]。国际玉米小麦改良中心(CIMMYT)已将赤霉病列为影响全球谷物生产的主要因素之一[6]。
FGSC产生的多种真菌毒素是影响粮食生产和食品安全的重大隐患[4]。单端孢霉烯毒素(Trichothecenes)是最常见的镰刀菌毒素,包括A、B、C、D四类,其中以B类污染最为严重。脱氧雪腐镰刀菌烯醇(Deoxynivalenol,DON)及其乙酰化衍生物(3-Acetyldeoxynivalenol,3-ADON和15-Acetyldeoxynivalenol,15-ADON)、雪腐镰刀菌烯醇(Nivalenol,NIV)及其乙酰化衍生物(4-Acetylnivalenol,4-ANIV)都是较为常见的B类单端孢霉烯毒素[3-4]。这些毒素化学结构非常相似,具有相同的骨架结构,主要区别在于侧链基团的修饰不同(图1)。另外,单端孢霉烯毒素性质非常稳定,常规的高温高压处理无法使之降解,很容易随食品、饲料加工过程进入食物链,严重威胁人畜健康。在中国,危害流行的FGSC主要是亚洲镰刀菌(Fusarium asiaticum)和禾谷镰刀菌(Fusarium graminearumsensu stricto)两个种群,其中F.asiaticum主要分布在较温暖的长江流域及以南地区,F.graminearumsensu stricto则主要分布在年平均气温较低的黄河流域及以北地区。Zhang等[7]研究表明,长江中下游麦区的F.asiaticum以3-ADON型为主,而F.graminearumsensu stricto群体以15-ADON型为主。
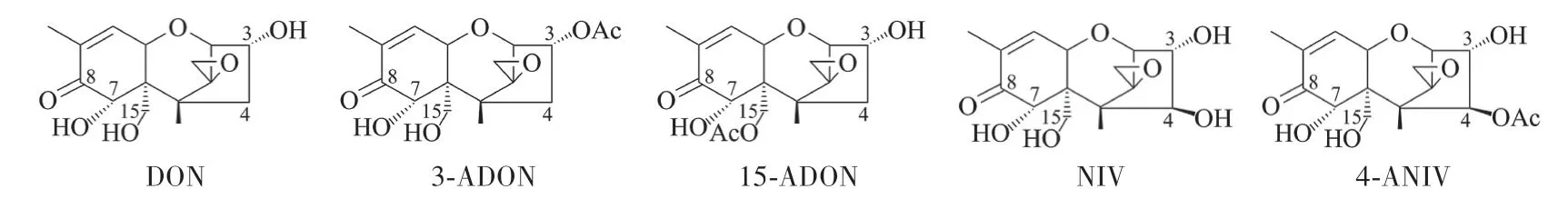
图1 常见的B类单端孢霉烯毒素结构式Fig.1 Chemical structures of type B trichothecenes
长三角地区是我国小麦赤霉病发生程度最为严重、暴发频率最高的地区。一直以来,江苏和安徽小麦赤霉病不仅发病面积大,毒素污染也最严重。有调查表明,其重病田块中小麦DON毒素浓度是国家限量标准的40多倍(41 157μg∕kg)[8]。2010—2015年,江苏省21个市、县1 530份小麦样品DON毒素的检出率高达89.1%[4]。全国农技中心发布的农作物重大病虫害发生趋势预报显示,我国2020年小麦赤霉病偏重流行风险高[9]。其中,长江中下游和江淮麦区预计大流行,黄淮南部麦区偏重流行,其他麦区流行风险较低[9]。因此,开展长三角地区相关的病害流行学调查,如菌群结构分布、菌株产毒化学型分析、病原菌适应性、抗药性等研究,对小麦赤霉病及镰刀菌毒素污染防控及治理具有重要意义。本研究于2019年从上海地区采集小麦赤霉病样本,对病原菌进行分离鉴定和产毒基因型研究,旨在明确上海地区引起小麦赤霉病的FGSC的种群结构及潜在的毒素污染风险,为有针对性地开展病害防控及农产品安全监测提供依据。
1 材料与方法
1.1 仪器与试剂
霉菌培养箱(MJP-250F-1)、高压灭菌锅(SX-500,Tomy,日本)、超净工作台、Milli-Q纯水系统(Millipore,美国)、Tissuelyser II高通量组织研磨仪(Qiagen,德国)。
PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂粉15 g。
2×CTAB溶液:质量分数为2%CTAB溶液,100 mmol∕L Tris-HCl(pH 8.0)溶液,20 mmol∕L EDTA(pH 8.0)溶液,1.4 mol∕L NaCl溶液。
1.2 试验方法
1.2.1 小麦赤霉病菌分离纯化
2019年,从上海市奉贤区、金山区、浦东新区、青浦区和嘉定区的冬小麦田中采集感染小麦赤霉病的病穗,通过组织分离法进行病原菌分离和纯化,利用单孢分离技术获得单孢菌株[10],经初步形态学鉴定,共获得FGSC菌株65株。将菌株接种至含有PDA培养基的2 mL离心管中,待菌丝长满后置于4℃保存。
1.2.2 DNA提取
分离的单孢菌株在PDA平板培养3—5 d后,用无菌牙签收集菌丝至含有沙子和CTAB缓冲液的离心管中,组织研磨仪破碎菌丝体后提取基因组DNA[11]。利用NanoDrop 2000测定所提取的DNA浓度后,-20℃冷冻保存备用。
1.2.3 菌株鉴定
利用引物Fg16F(5’-CTCCGGATATGTTGCGTCAA-3’)和Fg16R(5’-GGTAGGTATCCGACATGGCAA-3’)对菌株的SCAR类型进行鉴定[12]。PCR反应体系为20μL,扩增程序参照Carter等[12]的方法。扩增结束后,取2μL产物用1.2%的琼脂糖凝胶进行电泳检测。
1.2.4 菌株TEF基因测序分析
利用引物EF-1[5’-ATGGGTAAGGA(A∕G)GACAAGAC-3’]和EF-2[5’-GGA(G∕A)GTACCAGT(G∕C)ATCATGTT-3’]对部分代表性菌株TEF基因(Translation elongation factor 1-α)进行扩增[13],PCR扩增所用的酶为高保真DNA聚合酶。PCR反应体系为50μL,反应程序参照O’Donnell等[13]的方法。扩增结束后,取2μL产物进行琼脂糖凝胶电泳,扩增产物条带单一且较亮的样品送生工生物工程(上海)股份有限公司进行测序。
1.2.5 菌株化学型分析
利用引物Tri13P1[5’-CTC(C∕G)ACCGCATCGAAGA(C∕G)TCTC-3’]和Tri13P2[5’-GAA(C∕G)GTCGCA(A∕G)GACCTTGTTTC-3’]对菌株产毒化学型进行分析[14]。PCR反应体系为20μL,反应程序参照Wang等[14]的方法。扩增产物用2%的琼脂糖凝胶进行电泳检测。3-ADON型菌株预期扩增片段大小为644 bp,15-ADON型为583 bp,NIV型为859 bp[14]。
2 结果与分析
2.1 菌株鉴定结果
引物Fg16F∕R的扩增结果表明,有64株赤霉菌扩增出约500 bp大小的片段,属于SCAR类型V,1株的扩增片段为410 bp,属于SCAR类型I。这说明64株赤霉菌属于F.asiaticum,只有1株属于F.graminearumsensu stricto(图2,表1)。从奉贤区小麦中分离得到23株赤霉菌,包括22株F.asiaticum和1株F.graminearumsensu stricto。其余42株均为F.asiaticum,其中,金山区分离得到10株,浦东新区12株,青浦区15株,嘉定区5株。因此,F.asiaticum是引起上海地区小麦赤霉病的优势病原菌。
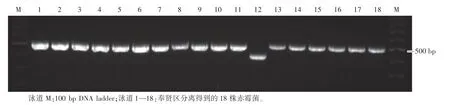
图2 部分菌株Fg16F∕R扩增产物电泳图Fig.2 Partial results amplified by primer pair Fg16F∕R
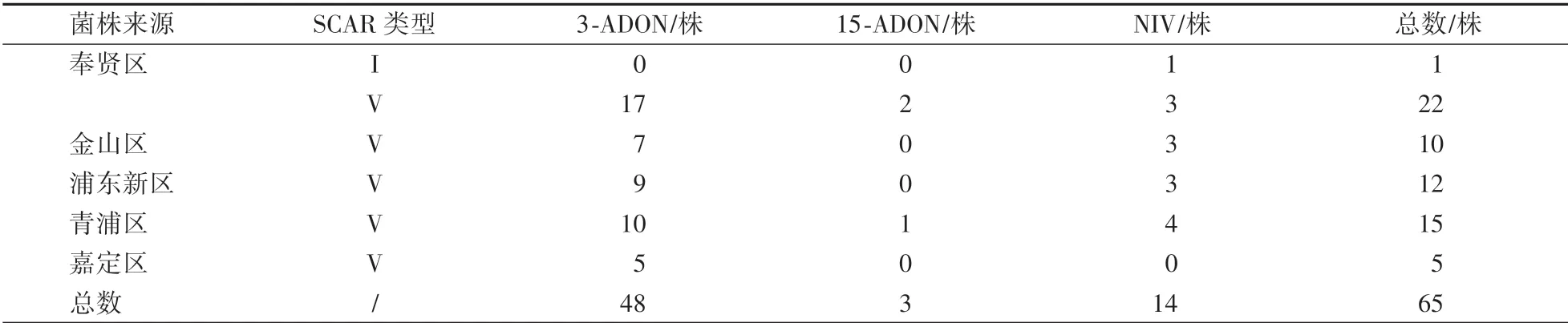
表1 供试菌株的来源及产毒化学型鉴定结果Table 1 The origins and chemotypes of strains used in this study
为了对引物Fg16F∕R的鉴定结果进行验证,选取5株菌株进行TEF基因测序。测序结果在Fusarium ID(http:∕∕isolate.fusariumdb.org∕blast.php)网站进行比对分析。结果表明:1株菌株TEF基因序列与F.graminearumsensu stricto菌株的相似度最高,4株菌株TEF基因序列与F.asiaticum菌株的相似度最高,相似度均大于99%,5株菌株TEF基因序列的比对结果与Fg16F∕R的鉴定结果完全一致。
2.2 菌株产毒化学型分析结果
利用引物Tri13P1∕2对65株赤霉菌进行PCR扩增,发现有48株扩增出644 bp的单一条带,14株的扩增片段大小为859 bp,其余3株扩增条带的大小为583 bp(图3)。表明48株赤霉菌的毒素化学型为3-ADON型,14株为NIV型,3株为15-ADON型。其中,仅有的1株F.graminearumsensu stricto产NIV毒素(表1)。因此,上海地区3-ADON型菌株的比例最高。

图3 部分菌株Tri13P1∕2扩增产物电泳图Fig.3 Partial results amplified by primer pair Tri13P1∕2
按地理来源分,奉贤区分离得到的23株赤霉菌有17株3-ADON化学型、2株15-ADON型和4株NIV型;金山区的10株菌株包括7株3-ADON化学型和3株NIV型;浦东新区的12株菌株包括9株3-ADON型和3株NIV型;青浦区的15株赤霉菌有10株3-ADON化学型、4株NIV型和1株15-ADON型;嘉定区的5株菌株则均为3-ADON化学型(表1)。
3 结论与讨论
本研究对上海地区小麦赤霉病菌的种群和产毒类型进行了调查,结果表明:上海地区优势病原菌群体为F.asiaticum,该研究结果与江苏、安徽、浙江等长江中下游地区已报道的FGSC的分析结果一致。Qiu等[15]对长三角地区江苏省和安徽省分离的891株赤霉病菌进行了分析,其中F.asiaticum有808株,占90.7%,而F.graminearumsensu stricto只有83株。从安徽、江苏地区的水稻、玉米和小麦3种作物中分离的FGSC菌株也是以F.asiaticum为主,占75.3%,其中水稻种子中分离的菌株均为F.asiaticum[16]。本研究从上海地区分离到的FGSC菌株中F.asiaticum群体占98.5%,而F.graminearumsensu stricto仅占1.5%(只有1株)。奉贤、金山、浦东、青浦、嘉定5个区只有奉贤区分离到F.graminearumsensu stricto,而其他4个区只分离到F.asiaticum,这可能与样本大小有关。
温度、寄主、耕作制度等因素都会影响FGSC的种群分布。已有研究表明,引起中国小麦赤霉病的FGSC群体中,F.graminearumsensu stricto菌株主要分布在年平均气温较低的北方寒冷地区,而F.asiaticum菌株则主要分布在南方温暖区域[7,17]。寄主适应性也是影响菌群分布的原因之一,Lee等[18]对从韩国水稻上分离获得的356株赤霉菌进行了遗传多样性分析,发现F.asiaticum更适宜在水稻生态系统中生存。Gale等[19]的研究也表明,在美国路易斯安纳州南部地区的水稻种植区,F.asiaticum群体的比例较高。在中国,F.asiaticum群体主要分布在种植水稻的长江流域[7,15-17,20-22]。
就菌株毒素化学型而言,上海地区FGSC群体中3-ADON、NIV和15-ADON 3种化学型均有分布,所占的比例差异显著,分别为74%、21%和5%,其中以3-ADON化学型比例最高,这与长三角其他省市的分布趋势是一致的。依据行政区域进行统计分析,5个区不同化学型菌株的比例分别为:奉贤区3-ADON型占73.91%、15-ADON型占8.70%、NIV型占17.39%;金山区3-ADON型占70%、NIV型占30%;浦东新区3-ADON型占75%、NIV型占25%;青浦区3-ADON型占66.6%、15-ADON型占6.7%、NIV型占26.7%;嘉定区均为3-ADON型。不同区域菌株化学型差异可能与样本量大小有关。Karugia等[23]对来自浙江的208株F.asiaticum进行了分析,发现3-ADON和NIV型菌株分别占57.7%、42.3%,未检测到15-ADON化学型。对江苏和安徽的808株F.asiaticum分析的结果显示,3-ADON型菌株比例最高,占86.14%,15-ADON和NIV型分别为5.69%和8.17%[15]。从安徽、江苏地区水稻、玉米和小麦3种作物中分离的F.asiaticum群体3-ADON型菌株占64.4%[16]。因此,长三角地区F.asiaticum3-ADON型菌株占主导地位,属于优势菌群。
通常小麦赤霉病以麦穗的单一小穗(中间部位小穗)发病最为常见。本研究在采样时发现了单一麦穗上2—3个小穗同时发病的现象,即分布在不同部位的物理距离较远的小穗均表现赤霉病症状,以中间小穗和顶部小穗同时发病较为普遍,出现比例约占15%。毒素化学型分析发现,同一麦穗存在不同化学型菌株同时侵染的现象。如在奉贤区采集的同一个麦穗上分离得到了3-ADON型和15-ADON型菌株。多个部位同时侵染不仅加重了病害发生程度,也使得不同毒素交叉污染成为可能,加剧了食品安全风险。
总体来看,无论是长三角地区还是整个长江流域,3-ADON型菌株比例较高(>60%),明显处于主导地位,这可能与气温、轮作方式、致病力、产毒量等因素有关[22]。生物学表型分析结果表明,3-ADON型菌株在致病力、生长速率、生殖能力、产毒量等方面显著强于NIV型菌株[21]。Liu等[24]研究表明,不同化学型菌株的分布可能与菌株致病力、生长速率、产子囊壳的数量、产毒量等生物学特征有关,并且3-ADON型菌株产DON毒素的能力强于15-ADON和NIV型菌株。Nicolli等[25]研究发现,通常情况下产DON及其乙酰化衍生物3-ADON或15-ADON毒素菌株的致病力高于NIV型菌株,这一结论与DON毒素在病原菌侵染小麦时具有毒力因子作用[26],可以促进病害扩展的结论是一致的。此外,3-ADON型菌株群体在美国的迅速扩张也说明该群体具有一定的竞争优势。2000年以前,危害美国和加拿大小麦的赤霉菌几乎均为15-ADON型,15-ADON型F.graminearumsensu stricto占绝对主导地位[6,27]。但是,近年研究发现,加拿大西部地区15-ADON菌株正逐渐被3-ADON菌株所代替,该地区3-ADON菌株在1998—2004年增加了14倍,已经成为优势菌群[27]。此外,不同化学型菌株群体之间的同源重组、基因水平转移等可能也是影响菌群分布的因素之一[21,28-29]。因此,本研究发现的3-ADON和15-ADON菌株同时侵染的现象,应引起重视。最近,在美国北部和加拿大南部地区发现了一个新的产A类单端孢霉烯毒素(NX毒素)的FGSC群体,虽然这一群体的比例较小(1.8%),但值得引起重视[30-31]。目前,我国未发现有产NX毒素的赤霉菌存在,应加强进口小麦等谷物的检验检疫,谨防这一病原菌群体传入我国。
一直以来,亚洲地区NIV型菌株的比例较其他地区偏高,局部地区NIV型菌株的比例甚至比DON型菌株还高。史文琦等[32]对我国小麦赤霉病流行区域FGSC群体的产毒类型进行了分析,结果表明,产NIV毒素的菌株是长江上游麦区的优势菌群。对我国19个省份59个地区玉米中FGSC的分析结果表明,NIV型菌株的比例为56.1%[33]。据报道,韩国NIV型菌株的比例高达93.5%[18]。Gale等[19]首次报道了美国存在NIV型菌株,对美国路易斯安纳州237株赤霉菌的鉴定结果表明,NIV型菌株占79%,其中路易斯安纳南部地区群体NIV化学型高达93.6%。Goswami等[6]研究发现,北美地区NIV型群体有明显的扩张蔓延趋势。NIV型菌株的比例呈上升趋势,这也是赤霉病菌群体结构变化的一个显著特征,因此,应该加强对田间NIV型菌株的跟踪调查和监测工作,防止高毒菌株的扩张蔓延。
镰刀菌毒素膳食暴露评估结果表明,我国小麦粉和玉米制品中NIV毒素的污染水平偏高,存在较高的健康风险。马玉彤等[34]对我国不同产区214份小麦样品进行真菌毒素污染分析的结果表明,所有测试小麦样品均检测到镰刀菌毒素,其中以NIV毒素污染最重,含量最高,最大值为393.70μg∕kg,平均值为273.44μg∕kg,即使在含量较低的地区评价含量也高达182.56μg∕kg。研究表明,NIV毒性较强,其对人体细胞的毒性是DON的4倍[35]。体外研究证实,NIV毒素能强烈抑制哺乳动物细胞蛋白、RNA和DNA合成,造成增殖细胞坏死[36]。此外,NIV毒素还可以诱导细胞凋亡、引起免疫抑制等毒害作用。欧洲食品科学委员会建议人和动物每天对DON毒素的摄入量严格限制在1.0μg∕(kg bw),对NIV毒素的允许摄入量严格限制在0.70μg∕(kg bw)[37]。我国现行食品安全国家标准GB 2761—2017规定,小麦、玉米等谷物及其制品中DON的最大允许量不得超过1 000μg∕kg,但目前还未对NIV毒素做出限量标准。鉴于NIV毒性强、污染比例较高,非常有必要将其列入谷物等农产品限量标准,加强日常食品安全监测。
近年来,长江中下游冬麦区小麦赤霉病持续呈高发态势,尤其是给长三角地区造成了严重的损失,究其原因主要与气候有关。小麦赤霉病是一种典型的“气象型”病害,其侵染循环过程与气象因子息息相关[38]。如果小麦盛花期遇到连续两天或以上的阴雨天气就很容易引起赤霉病的大暴发。此外,近几年实施的秸秆还田制度易使大量菌源积累,而密植栽培、高温高湿等环境则为病菌侵染和病害流行成灾创造了有利的条件。FGSC引起的小麦赤霉病及真菌毒素污染兼具粮食安全和食品安全双层风险,是国家“藏粮于地、藏粮于技”、“粮食稳产优质”战略面临的严峻挑战,开展FGSC菌株致病及产毒机理研究对粮食丰产和品质安全意义重大。
