瓜类果斑病菌荧光免疫层析试纸条的研制
2021-08-28曾海娟翟绪昭孙静娟王金斌
曾海娟,翟绪昭,孙静娟,王金斌,刘 箐∗
(1上海市农业科学院生物技术研究所,上海201106;2上海理工大学医疗器械与食品学院,上海200093)
瓜类细菌性果斑病(Bacterial fruit blotch,BFB)是一种由革兰氏染色呈阴性的燕麦食酸菌西瓜种(Acidovorax citrulli,Ac)引起的具有毁灭性的细菌性病害。瓜类果斑病菌是典型的种传病菌,可通过带菌种子实现远距离传播,因此,带菌种子是果斑病爆发的重要来源[1]。果斑病菌抗干旱能力非常强,可在干燥的种子表面存活35年[2],并且可侵染西瓜、甜瓜、南瓜等多种葫芦科植物的果实、植株及种子,使带菌果实表面出现水渍状斑点,最终导致整个果实腐烂,严重影响瓜类产量,造成巨大的经济损失。目前,尚未培育出可以完全抵抗该病菌的商业化瓜类品种[3]。
聚合酶链式反应(PCR)是用于病原菌检测的标准方法,如常规PCR、多重PCR[4]、实时荧光定量PCR[5]、锁式探针扩增[6]及环介导等温扩增[7]等。基于PCR的检测方法灵敏度较高,与传统的以培养为基础的检测方法相比,检测时间较短,只需3—4 h即可获得可靠的结果。但该方法需要精密的热循环仪,对操作人员也有一定的技术要求。免疫层析试纸技术是基于免疫学建立的检测方法,其操作简单,检测时间短,结果易辨认,样品不需要前处理,且不需要复杂的设备。试纸条中最常见的标记材料是应用胶体金作为示踪物,标记抗体后使得检测结果肉眼可见。目前,已广泛用于大肠杆菌、副溶血性弧菌、肠炎沙门氏菌等食源性致病菌的快速检测[8-10],黄瓜角斑菌、玉米条斑病菌等植物病原菌的田间快速检测[11-12],玉米赤霉烯酮、黄曲霉素等真菌毒素的检测[13-14]。近年来,一些新型的标记材料获得越来越多的关注,其中包括上转化发光纳米粒子[15]、稀土纳米材料[16]、量子点[17]、荧光微球[18]等。
异硫氰酸荧光素(Fluorescein isothiocyanate,FITC)是一种荧光染料,可以吸收蓝光或紫外光并发出黄绿色荧光。作为一种荧光探针,FITC被广泛用于活细胞染色以及细菌染色后的示踪[19-20]等。本研究在前期制备得到高特异性单克隆抗体的基础上,采用FITC标记抗体,利用“双抗体夹心”模式制备新型的荧光免疫层析试纸条,并对试纸条的性能(特异性、灵敏度、稳定性)及对实际样品的检测结果进行分析,旨在建立一种新型的简便、快速、成本低的检测果斑病菌的免疫学新方法。
1 材料与方法
1.1 材料
果斑病菌SD01的单克隆抗体6D及4F由本试验室制备并保存;用于测定试纸条特异性的菌株见表1,其中7种野生型果斑菌株(编号1—7)由中国检验检疫科学研究院从国内外瓜类产品中分离所得,已进行了分离鉴定及柯赫氏法则验证;其余菌株(编号8—14)均为标准菌株。硝酸纤维素膜(NC膜)、样品垫(20 cm×30 cm)、结合垫(20 cm×30 cm)、吸水纸(20 cm×30 cm)购自美国Millipore公司。

表1 试验所用菌株Table 1 Bacterial strains used in the test
1.2 试剂
脑心浸液培养基(BHI)购自北京陆桥技术股份有限公司;羊抗鼠IgG抗体和FITC(≥90%)购自美国Sigma公司;其余试剂均为分析纯。
1.3 主要仪器
SpectraMax M2多功能酶标仪购自美国Molecular Devices公司;点样仪购自美国BioDot公司。
1.4 细菌抗原制备
使用脑心浸出液培养基(BHI)进行果斑病菌培养[21]。将冷冻保存的果斑病菌及其近源菌株划线接种于BHI平板,37℃过夜培养后挑取单菌落接种于液体BHI培养基中,37℃摇床培养12 h后,菌液采取0.3%甲醛灭活用作检测抗原。纯培养的各种菌株在甲醛灭活前均用无菌生理盐水梯度稀释并涂布于BHI平板进行菌落计数。
1.5 果斑病菌单抗的荧光标记
将待交联的单克隆抗体4F在交联反应液中透析过夜,交联反应液的配方为:7.56 g NaHCO3,1.06 g Na2CO3,7.36 g NaCl,加水定容到1 L。按单抗4F∶FITC=1 mg∶150μg的比例将新鲜配制的FITC缓慢加入抗体溶液中,边加边轻轻晃动使其与抗体混合均匀,置于室温反应2 h。将交联物在PBS中透析,至透析液清亮。FITC交联的抗体置于pH 7.4的磷酸盐缓冲液中4℃避光保存。交联效果判定方法为FITC∶抗体=2.77×OD495∕[OD280-0.35×OD495],该值应为5—10[22]。
1.6 检测线浓度及荧光抗体使用量的优化
为确定最适的检测线浓度,将不同质量浓度的单克隆抗体6D(2.5 mg∕mL、2 mg∕mL、1.5 mg∕mL)与1 mg∕mL羊抗鼠IgG抗体喷涂于NC膜上分别形成检测线与质控线,再将NC膜(2.5 cm×30 cm)、结合垫(0.5 cm×30 cm)、样品垫(2.5 cm×30 cm)、吸水纸(3 cm×30 cm)依次贴在PVC底板(8 cm×30 cm)上,并互相重叠1—2 mm,如图1A所示,切成3 mm左右的条带。空白BHI培养基75μL逐滴滴加至样品垫,作为阴性对照。判定最适的检测线(T线)浓度:只出现一条质控线(C线)的抗体6D最高浓度。

图1 试纸条的模拟结构(A)及阳性结果(B)和阴性结果(C)Fig.1 The simulated structure(A),positive result(B)and negative result(C)of the test strip
优化后的单克隆抗体6D与1 mg∕mL羊抗鼠二抗喷涂于NC膜上,并进行试纸组装。将不同质量(2μg、3μg、4μg、5μg、6μg、7μg)的荧光抗体4F喷涂于试纸条的结合垫,空白培养基滴加至样品垫作为阴性对照,最适荧光抗体(FITC-4F)的质量为仅出现一条质控线(C线)时的最高荧光抗体量。
检测原理为:当样品中含有待检靶标时,样品中的抗原首先与结合垫上的荧光抗体结合,形成荧光抗体4F-抗原复合物,当复合物流经NC膜上的检测线时,与检测线上的6D结合,形成荧光抗体4F-抗原-抗体6D“双抗体夹心”模式,由于FITC在T线和C线上的堆积,在检测线及质控线区域产生肉眼可见的黄绿色荧光(图1B);当样品中无待测靶标时,FITC不会在T线上堆积,仅可见一条C线(图1C)。
1.7 试纸条特异性测定
采用无菌生理盐水将8种果斑病菌(SD01、ATCC 29625、99-5、xj112、PLSB1、00-1、plsb91、tw31),及6种同属近源的植物病原菌(ATCC33996、NCPPB961、ATCC19307、NCPPB2597、NCPPB540、ATCC2975)的菌悬液稀释至108CFU∕mL,并滴加75μL至相应试纸条的样品垫。静置10 min后在紫外灯下观察结果,用装有荧光滤光片(525 nm,Semrock,USA)的相机拍照记录检测结果。当试纸条出现两条线时,判定为阳性;若试纸条只有一条C线,则判定为阴性;若无线或者只有一条T线则判定为无效结果。若8种果斑病菌均能检出,而6种近源的植物病原菌不能检出,则表明该试纸条在检测果斑菌时具有较高的特异性。
1.8 试纸条灵敏度和稳定性测定
用无菌生理盐水将果斑病菌SD01悬液按10倍梯度稀释为3.1×105—3.1×108CFU∕mL,以空白BHI培养基作为阴性对照,每个样品在试纸条的样品垫逐滴滴加75μL,10 min后观察结果。可以观察到出现两条线的最小细菌悬液浓度,即为该试纸条的检出限。
将制备好的试纸条室温放置3月后,通过测定试纸条的灵敏度来评估试纸条的稳定性。试验方法同上,若检出限未发生变化,则表明试纸条在室温存放3个月后仍具有稳定检出果斑病菌的能力。
1.9 实际样品的检测
将经PCR验证无果斑病菌污染的葫芦科植物西瓜、甜瓜、哈密瓜、南瓜、黄瓜、冬瓜、丝瓜、西葫芦的茎叶捣碎,收集汁液5 mL分别添加到45 mL BHI中,并接种果斑病菌SD01单菌落,37℃过夜培养后,菌浓度调至3.1×106CFU∕mL,每个样品在试纸条的样品垫上逐滴滴加75μL,10 min后在紫外灯下观察结果。若上述样品均可以检出,则说明试纸条在检测样品时,最小检出浓度不受瓜类茎叶中未知杂质的影响,该试纸条适用于实际样品的现场快速检测。
2 结果与分析
2.1 细菌计数结果
使用BHI液体培养基37℃培养12 h,14种细菌浓度均在2×109—4×109CFU∕mL,其中用于测定灵敏度的野生型菌株SD01平板计数结果为3.1×109CFU∕mL。
2.2 单抗的荧光标记效果测定
采用酶标仪测定单抗4F与FITC的交联比例,计算得到2.77×OD495∕[OD280-0.35×OD495]值为9.45,nanodrop测定标记后单抗质量浓度并调整为2 mg∕mL。由图2可见,在280 nm处有蛋白的最大吸收峰,在495 nm处有FITC的最大吸收峰,表明FITC标记抗体成功。
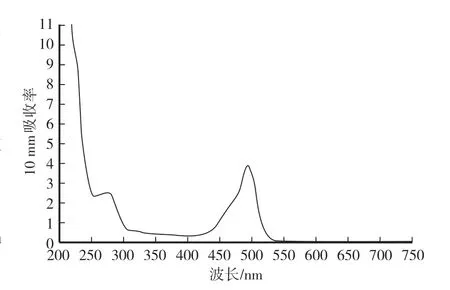
图2 荧光抗体全波长扫描Fig.2 Full wavelength scanning of fluorescent antibody
2.3 检测线浓度的确定
空白BHI培养基用来确定试纸条的最适检测线浓度,选取检测结果不出现假阳性的最高检测线浓度为最适浓度。将75μL空白BHI培养基滴加至不同检测线浓度的试纸条的样品垫,当检测线质量浓度为2.5 mg∕mL时,试纸条测定空白BHI培养基时出现假阳性结果,检测线6D质量浓度低于2 mg∕mL时,只有一条质控线质量,因此本试验选取最适检测线质量浓度为2 mg∕mL。
2.4 荧光抗体最适量的确定
空白BHI培养基用来确定荧光抗体的最适量,先在试纸条的结合垫上喷涂不同质量的荧光抗体,再将空白培养基滴加至试纸条的样品垫,如图3所示,当荧光抗体的量达到6μg时,试纸条检测空白培养基出现假阳性结果,因而最适荧光抗体的喷涂量为5μg。

图3 最适荧光抗体量的确定Fig.3 Determination of the optimal amount of fluorescent antibody
2.5 试纸条的特异性测定
由图4所示,试纸条1—8检测8种果斑菌,有两条线,为阳性结果;9—14检测与果斑病毒近源的植物病原菌,只有一条质控线,为阴性结果;0为阴性对照,表明试纸条可以检出该8株果斑病菌,并且与其他近源的植物病原菌无交叉反应,具有良好的特异性。

图4 试纸条的特异性测定Fig.4 Determination of specificity of test strip
2.6 试纸条的灵敏度测定
试纸条对野生型菌株SD01的检测灵敏度结果如图5所示,菌液浓度在3.1×106—3.1×108CFU∕mL时可见两条线,为阳性结果;浓度为3.1×105CFU∕mL时只有一条质控线,为阴性结果,因而试纸条的检测灵敏度为3.1×106CFU∕mL。

图5 试纸条的灵敏度测定Fig.5 Sensitivity determination of test strip
2.7 试纸条的稳定性
将研制的荧光试纸条室温放置3个月后,检测灵敏度仍能达到3.1×106CFU∕mL,表明试纸条最少可以在室温存放3个月,仍具有检测果斑病菌的能力。
2.8 试纸条检测实际样品
试纸条对含有3.1×106CFU∕mL果斑病菌SD01的8种葫芦科植物的检测结果如图6所示,试纸条1—8均有两条线,为阳性结果;试纸条0仅有一条质控线,为阴性结果,表明汁液中的未知杂质不会对试纸条的检测结果产生影响,试纸条可用于田间实际样品的快速检测。

图6 试纸条的实际样品检测Fig.6 Actual sample detection of test strip
3 讨论
试纸条的特性与抗体的特性直接相关,试验中所用单克隆抗体6D、4F为前期试验所得[21],6D效价为1∶6 400,可识别并结合8种果斑病菌,与6种近源植物病原菌无交叉反应;4F效价为1∶6 400,可识别并结合8种果斑菌,但与ATCC19307、ATCC33996有交叉反应。试纸条的研制是建立在“双抗体夹心”技术基础上的,ATCC19307、ATCC33996虽然与单克隆抗体4F存在交叉反应,但与固定在检测线区域的单克隆抗体6D不能结合,因而制备出的荧光试纸条与这两株菌并无交叉反应。
目前报道的果斑病菌的检测方法主要有PCR法、酶联免疫吸附测定法[23]、胶体金免疫层析试纸条[24]等。荧光免疫层析法是目前一种新型的免疫学检测技术,可用于病原菌的快速检测。荧光免疫层析法的荧光标记物质常见的有荧光素、量子点及一些荧光乳胶微粒等,FITC作为一种荧光染料,价格低廉,可降低试纸条的成本。本试验以FITC为标记物,利用荧光免疫层析试纸条选出可以配对的抗体,成功研制出果斑病菌的荧光免疫层析试纸条,并对荧光试纸条的检测灵敏度、特异性、稳定性及实际样品检测结果进行了分析,结果表明试纸条的灵敏度、特异性及稳定性良好,可用于实际样品的快速检测,特别适用于无复杂仪器设备的田间、仓储等场所的大批量样品的快速筛查,具有方便、快速、操作简单、检测结果肉眼可见等优势。
