L-亮氨酸发酵培养基的优化
2021-08-27奚逢源胡倩薛长艳季芳琴
奚逢源 胡倩 薛长艳 季芳琴
摘 要:试验用黄色短杆菌FY-18作为菌种,用摇瓶进行发酵来生产L-亮氨酸;通过正交试验来对培养基的主要成分进行优化,筛选出最优的组合;通过单因素试验对培养条件进行优化。分析试验数据,筛选出最适合黄色短杆菌FY-18生长的培养基主要成分,即葡萄糖∶硫酸铵=24.00∶6.00、玉米浆干粉12.00 g/L、磷酸二氢钾0.60 g/L、二次谷氨酸母液10 mL/L。最佳的培养条件是:培养温度36 ℃、pH为7.2、溶氧量20%、接种量15%。在最佳条件下,产量最高达到24.68 g/L。
关键词:黄色短杆菌FY-18;L-亮氨酸发酵培养基;培养条件;正交单因素试验
亮氨酸是最有效的一种支链氨基酸,能够快速分解转化为葡萄糖。增加葡萄糖可以防止肌肉组织受损,因此特别适合健美运动员[1]。亮氨酸还能提高生长激素的产量,并帮助燃烧内脏脂肪,促进骨骼、皮肤以及受损肌肉组织的愈合。由于亮氨酸很容易转化为葡萄糖,有助于调节血糖水 平[2]。亮氨酸的食物来源包括糙米、豆类、肉类、坚果、大豆粉和全麦,是一种必不可少的氨基酸,且只能通过饮食获得。因此,选择混合型补充剂更方便。但是,摄入过量的亮氨酸也会产生副作用,已知大量摄入会引起皮炎、腹泻、精神失常等问题。饮食中含有过多亮氨酸还会增加体内的氨,并破坏肝、肾功能[3]。因此,除非咨询过医生,肝或肾功能受损患者不应该摄入大剂量的亮氨酸,否则会导致病情恶化。
鉴于L-亮氨酸代谢生产难度大,在我国应用行之有效的生产方式具有非常重要的意义[4]。目前,发酵法生产L-亮氨酸的菌种产酸偏低、价格高、发酵周期长、产量较低,主要用于配制复方氨基酸输液。为了提高L-亮氨酸发酵水平,进行L-亮氨酸菌种选育和发酵工艺条件优化具有重大研究意义。近年来,我国对亮氨酸的需求日益增长,必须改进亮氨酸生物合成的工艺,优化亮氨酸的培养基,使其达到较高的产率和经济效益。改进亮氨酸的制作工艺可以从黄色短杆菌FY-18的培养基成分和培养条件两个方向进行[5]。微生物发酵培养基的最佳组成是保证高产菌株的高产性能得以充分表达的物质基础,在培养过程中筛选出5种重要成分,采用正交试验和单因素试验筛选出最佳组合。
1 材料与方法
1.1 试验材料
1.1.1 供试菌种
采用黄色短杆菌FY-18为出发菌株,由台州职业技术学院菌种保藏室保藏。
1.1.2 仪器设备
生物传感分析仪(SBA-40C)、锥形瓶、10 mL试管、振荡器(培英DZ-900)、高效液相色谱仪、20 mL培养皿、可见分光光度计(7230G)、烧杯、滴管。
1.1.3 培养基
100 mL液体摇瓶培养基:100 mg二次谷氨酸母液,3.00 g葡萄糖,0.50 g硫酸镁,0.50 g磷酸氢二钾,0.02 g硫酸亚铁,0.50 g玉米浆干粉,0.05 g硫酸铵,40 mg蛋氨酸,4.00 g谷氨酸,1.00 g硫酸镁,1.50 g琼脂粉。
100 mL发酵液体摇瓶培养基:0.02 g硫酸亚铁,15.00 g葡萄糖,2.00 g二次谷氨酸母液,7.00 g硫酸铵,0.05 g磷酸氢二钾,1.50 g毛发粉,60 mg蛋氨酸,2.00 g玉米浆干粉。
1.2 试验方法
1.2.1 种子试管斜面培养菌的培养方法
在摇瓶培养基中加入2%的琼脂粉制作试管斜面培养基,加热融化后,用NaOH调节pH至7.2,冷却至80 ℃,再倒入试管封装,试管的液面不得超过1/3。装好后用牛皮纸包扎,放入蒸汽灭菌锅121 ℃灭菌20 min。灭菌后,倾斜放至凝固,斜面不得超过2/3。再用接种针划线接种,在恒温培养箱中32 ℃培养24 h,待用。
1.2.2 种子摇瓶液体培养菌的培养方法
将培养基的成分分别溶解后加入,用NaOH调节pH至7.2,封装在250 mL摇瓶中,用牛皮纸包扎好,在高压蒸汽灭菌锅中121 ℃灭菌20 min。等待冷却至50 ℃,每瓶放入4~5颗玻璃珠,在超净台上用接种环选取斜面的菌种接种到摇瓶中,装液量为200 mL。再放到摇床上进行培养,温度设置为32 ℃,转速设置为200 r/min,种子的合格条件为培养时间约24 h、菌体OD值(620 nm)为1.2。
1.2.3 发酵液体摇瓶培养菌的培养方法
將培养基的成分分别溶解后加入,用NaOH调节pH至7.2,封装在500 mL摇瓶中,用牛皮纸包扎好,在高压蒸汽灭菌锅中121 ℃灭菌20 min。等待冷却至50 ℃,每瓶放入4~5颗玻璃珠,在超净台上用移液管移取种子液体摇瓶菌种2 mL到摇瓶中,装液量为400 mL。再放到摇床上进行培养,温度设置为36 ℃,转速设置为150 r/min。
1.2.4 条件优化
利用单因素试验法和正交试验法,以黄色短杆菌FY-18发酵产生的L-亮氨酸质量浓度为优化指标,筛选最优的培养基组合和发酵条件。
1.2.5 分析和测定方法
(1)测定发酵液菌体浓度。取发酵液0.5 mL,加入9.5 mL 0.1 mol/L稀盐酸中和碳酸钙,混匀,在分光光度计620 nm波长下用蒸馏水作空白进行比色,比色结果记为A620 nm。发酵液中菌体浓度采用菌体溶液吸光度 A620 nm表示。(2)测定L-亮氨酸液相。处理发酵液后,用高效液相色谱法定量测定发酵液中游离的L-亮氨酸质量浓度。(3)用生物传感分析仪测定发酵液的残糖。
2 结果与分析
2.1 单因素和正交试验优化对发酵的主要影响
2.1.1 单因素试验优化对发酵的主要影响
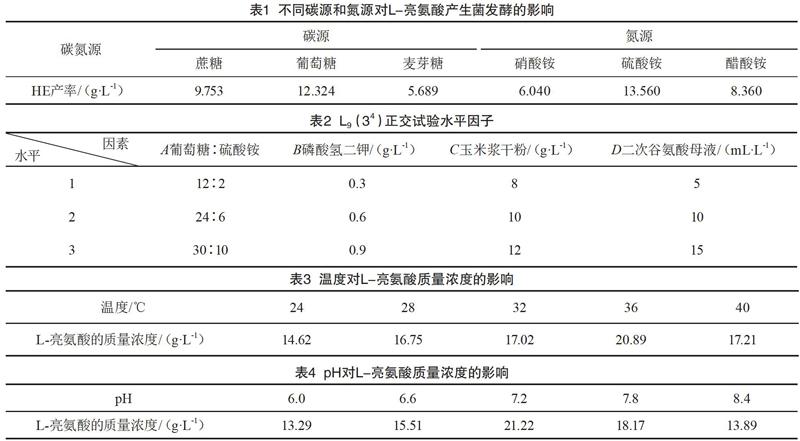
不同碳源和氮源对L-亮氨酸产生菌发酵的影响如表1所示。
由表1可知,葡萄糖和硫酸铵是最合适的碳源和氮源。
2.1.2 正交试验优化对发酵的主要影响
对于通过生物发酵产生L-亮氨酸而言,种子培养基的主要功能是培養出更多的菌株,发酵培养基的组成和含量对产物的合成速度和产量都有很重要的影响,所以有必要对发酵培养基进行更多的研究,通过生物制药小试获得试验数据,对试验结果进行综合理解与分析,选出最佳的发酵培养基配方。L-亮氨酸发酵种子培养基的主要成分有磷酸氢二钾、葡萄糖、二次谷氨酸母液、硫酸铵、玉米浆干粉等。通过3个因素、4个水平进行正交试验(见表2)。
根据试验指标,对种子液中的菌体吸光度和发酵液中的L-亮氨酸质量浓度分别进行分析及计算,得到两个优选方案。对种子液中菌体吸光度的最优方案是A2B2C3D3:对发酵液中L-亮氨酸质量浓度的最优方案是A2B2C3D2。以上两个方案的数据基本一致,只有二次谷氨酸母液质量分数不一样[10]。根据表2分析极差不难看出,以菌体吸光度为参考指标时,虽然二次谷氨酸母液的极差排在第二,但是D2和D3的菌体量相差很少。因为最终目的是得到更多的L-亮氨酸,所以最后选择的最优方案是A2B2C3D2。
2.2 运用单因素试验对发酵培养基发酵条件进行优化
利用单因素试验法,以黄色短杆菌FY-18发酵产生的L-亮氨酸质量浓度为优化指标,筛选最优的发酵条件。影响黄色短杆菌FY-18发酵产生的L-亮氨酸质量浓度的因素为:温度、pH、发酵液接种量、发酵液溶氧量,结果如表3~6所示。
温度主要通过影响酶的活性来影响黄色短杆菌的产酸量,由表3可知,36 ℃时产生的L-亮氨酸最多。
pH主要通过影响酶的活性来影响黄色短杆菌的产酸量,由表4可知,pH为7.2时产生的L-亮氨酸最多。
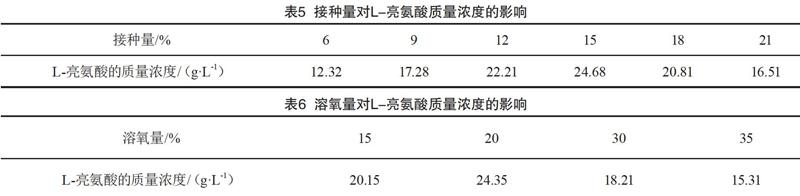
接种量主要通过改变菌群的数量来影响产酸率,由表5可知,接种量为15%时产生的L-亮氨酸最多。
溶氧量主要通过改变菌群的数量来影响产酸率,由表6可知,溶氧量为20%时产生的L-亮氨酸最多。
3 结语
通过对正交和单因素试验数据的分析,筛选出最适合黄色短杆菌FY-18生长的培养基主要成分。最适合的成分为:葡萄糖∶硫酸铵=24.00∶6.00、玉米浆干粉12.00 g/L、磷酸氢二钾0.60 g/L、二次谷氨酸母液10 mL/L。最佳培养条件是:培养温度36 ℃、pH为7.2、溶氧量为20%、接种量为15%。在最佳条件下,L-亮氨酸产量最高达到24.68 g/L。
[参考文献]
[1]常珠侠.L-亮氨酸发酵培养基及基本发酵条件的优化[J].甘肃农业科技,2015(4):7-10.
[2]马春玲.黄色短杆菌发酵生产L-亮氨酸的研究[D].济南:山东轻工业学院,2004.
[3]伍时华,路敏,张健,等.L-亮氨酸发酵种子培养试验[J].广西工学院学报,2006,17(1):38-42.
[4]宋超先.L-亮氨酸产生菌的选育及其发酵条件的研究[D].天津:天津科技大学,2004.
[5]伍时华,徐雅飞,张健,等.L-亮氨酸发酵培养基优化试验[J].广西植物,2006,26(6):692-696,701.
