基于无花果蛋白酶快速检测维生素C含量的方法研究
2021-08-27关桦楠吴巧艳龚德状刘晓飞
彭 勃,关桦楠,薛 悦,吴巧艳,龚德状,张 娜,刘晓飞
(哈尔滨商业大学 食品工程学院,黑龙江 哈尔滨 150076)
无花果(FicuscaricaLinn.)是木兰纲(Magnoliopsida)荨麻目(Urticales)桑科(Moraceae)榕属(Ficus)落叶灌木,高3~10 m,原产地中海沿岸,分布于土耳其至阿富汗,在我国唐代时从波斯传入,现南北均有栽培,新疆南部尤多。无花果蛋白酶(ficin)是一种从无花果树的乳胶和不成熟的果实乳汁中分离出的植物蛋白酶,其酶学性质与木瓜蛋白酶、菠萝蛋白酶类似,属于巯基蛋白酶[1-2]。无花果蛋白酶具有较强的蛋白水解能力、凝乳、解脂和溶菌活力[3],与动物蛋白酶或微生物蛋白酶相比,无花果蛋白酶是可以从无花果树乳胶中直接分离出的植物蛋白酶,其具有来源丰富、成本低、安全可靠、无毒副作用的优点,被广泛用于食品、医药、畜牧业及生命科学研究等领域[4]。近年来,国内对无花果蛋白酶的研究取得了可喜的进展,研究人员发现无花果蛋白酶除了具有上述特征和功能外,还具有与辣根过氧化物酶(horseradish peroxidase,HRP)催化性质相似的过氧化物模拟酶性质,能够催化H2O2产生羟自由基(·OH),氧化一系列过氧化物酶底物,如3,3′,5,5′-四甲基联苯胺(3,3′,5,5′-tetramethylbenzidine,TMB)、2,2′-联氮-双(3-乙基苯并噻唑啉-6-磺酸)二铵盐[2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonate),ABTS]、邻苯二胺(o-phenylenediamine,OPD),发生显色反应[5-8]。无花果蛋白酶作为天然植物蛋白酶,兼顾了生物催化剂和模拟酶的优点,具有更加广泛的应用前景。
维生素C又称抗坏血酸,在人体各种氧化还原代谢反应中起调节作用[9]。作为有效的抗氧化剂,维生素C可以去除体内的活性氧和一些自由基,保护细胞免受氧化损伤,具有增强免疫功能,预防维生素C缺乏病、感冒、癌症等功效[10-14]。维生素C不能在人体内直接合成,必须从食物中摄入,而水果蔬菜的食用是人体维生素C的重要来源[15]。维生素C在果蔬贮存和加工中所具有的变化情况对人们的健康具有重要的影响,因此维生素C的检测分析逐渐在食品营养分析中占据着重要地位[16]。目前常规的维生素 C 的测定方法包括液相色谱法[17-18]、电化学法[19]、荧光法[20]和分光光度法[21-22]等,其中大多数方法都有昂贵精密设备和高昂成本的限制,而比色分析由于可通过肉眼识别,灵敏度高、成本低、简单、快速、实用性强等特点越来越受到人们的青睐,更适于实现现场分析和快速检测[23]。
本研究首先验证无花果蛋白酶的过氧化物酶模拟酶特性,再利用其模拟过氧化物酶活性构建维生素C的检测方法。如图1,无花果蛋白酶具有良好的模拟过氧化物酶活性,能催化H2O2产生·OH,从而氧化底物ABTS,产生典型的绿色反应。而维生素C具有的抗氧化性可清除自由基,从而诱导绿色ABTS+·还原为无色的ABTS,随着维生素C含量的增加,绿色体系逐渐趋近于无色,依此原理建立了一种灵敏快速比色检测维生素C的方法,为维生素C的检测提供了一种新思路,拓宽了其在食品安全和食品分析中的应用范围。

图1 无花果蛋白酶模拟过氧化物酶反应原理Fig.1 Reaction mechanism of ficin mimetic peroxidase
1 材料与方法
1.1 试剂与仪器
无花果蛋白酶(50万U/g),分析纯,安徽酷尔生物工程有限公司;过氧化氢溶液,分析纯,苏州达江精细化工有限公司;2,2′-联氮-双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS),分析纯,上海阿拉丁生化科技股份有限公司;醋酸,分析纯,苏州达江精细化工有限公司;醋酸钠,分析纯,苏州达江精细化工有限公司;抗坏血酸,分析纯,国药集团化学试剂有限公司;维生素C泡腾片,购自哈尔滨人民同泰医药连锁。
UV2250型紫外-可见光分光光度计,上海圣科仪器设备有限公司;HWS26型电热恒温水浴锅,上海向帆仪器有限公司;FA1204T型电子天平,厦门雄发仪器仪表有限公司。
1.2 实验方法
1.2.1单因素优化检测方法
将500 μL不同浓度的H2O2溶液(1.5、1.0、0.5、0.1、0.05 mol/L),100 μL不同浓度的无花果蛋白酶溶液(0.05、0.1、0.5、5、10 μg/mL),200 μL ABTS(5 mmol/L)溶液和3 mL HAc-NaAc缓冲溶液(pH=4.4)依次加入具盖离心管中,充分混匀后,将反应体系放置于不同温度的水浴锅中(30、40、50、60、70 ℃),水浴30 min后(水浴过程中每过1 min温和倒转1次)取出,静置1 min,吸取上清液3 mL,以蒸馏水为空白,测定420 nm处吸光度。在反应体系分别加入100 μL 维生素C溶液(0.5 mmol/L),孵育不同时间间隔(10、20、30、60、120 s)再测定420 nm处吸光度。
体系指标ΔA见式(1)。
ΔA=A0-A。
(1)
式(1)中,A0为不加入维生素C时420 nm处的吸光度值,A为加入维生素C后420 nm处的吸光度值,ΔA越大表示检测效果越明显,结果越好,重复实验3次。
1.2.2正交实验优化检测方法
选择L9(34)正交设计表进行实验,确定影响因素的主次顺序及优选方案。依次将500 μL H2O2(浓度为单因素优化结果),100 μL无花果蛋白酶溶液(质量浓度为单因素优化结果),200 μL ABTS溶液(5 mmol/L)和3 mL的HAc-NaAc缓冲溶液加入具盖离心管中,混匀后,将反应体系放置于水浴锅中(温度为单因素优化结果),水浴30 min后(水浴过程中每过1 min温和倒转1次)取出,静置1 min,吸取上清液3 mL,以蒸馏水为空白,测定420 nm处吸光度。在反应体系中分别加入100 μL维生素C溶液(0.5 mmol/L),孵育一段时间(孵育时间为单因素优化结果)后再测定420 nm处吸光度,重复实验3次。
1.2.3检测方法工作曲线、检出限、回收率和选择性的测定方法
在较优条件下,将500 μL H2O2溶液,100 μL的无花果蛋白酶溶液,200 μL的ABTS(5 mmol/L)溶液和3 mL的HAc-NaAc缓冲溶液依次加入具盖离心管中,充分混匀,水浴30 min后(水浴过程中每过1 min温和倒转1次),静置1 min,吸取上清液3 mL,以蒸馏水为空白,测定420 nm处吸光度。依次在体系中加入100 μL不同浓度的维生素C溶液(0.080、0.060、0.040、0.020、0.010、0.008、0.005、0.001 mmol/L),孵育30 s后再测定420 nm处吸光度,根据不同浓度维生素C与吸光度差值绘制工作曲线,计算最低检出限,并与天然酶催化方法进行比较[24]。选择浓度为0.005、0.010、0.050 mmol/L的维生素C标准液加入上述检测体系,测定其吸光度值,重复实验3次,结果取平均值带入工作曲线方程,测定其回收率。
比色检测方法的一个重要指标就是检测其选择性,评估模拟酶检测抗坏血酸体系的特异性。研究其他可能与维生素C共存物质对检测系统的影响,在体系中添加食品中常见的盐类、糖类和氨基酸代表物质作为干扰物质,包括氯化钠、氯化钙、氯化汞、甘氨酸、葡萄糖和蔗糖,干扰物质工作浓度为维生素C浓度的20倍(维生素C浓度为0.05 mmol/L,干扰物质浓度为1.00 mmol/L),ΔA作为评价标准。
1.2.4实际样品检测
将一片市售维生素C泡腾片溶于去离子水中,定容至100 mL,然后用去离子水将溶液稀释10倍,检测步骤与上述溶液检测实验相同。加入不同浓度的维生素C标准液,重复测定3次,考察检测方法的加标回收率,并评价检测方法的精确度和重复性。
2 结果与分析
2.1 无花果蛋白酶的模拟过氧化物酶活性分析
研究表明,过氧化物酶可以利用H2O2为电子受体催化底物氧化,引起体系颜色发生变化。反应体系中,模拟酶能够催化H2O2与底物ABTS反应产生绿色产物[7-8]。为了证明无花果蛋白酶具有模拟过氧化物酶的活性,本实验设置了不同组分的催化反应体系,并进行对比分析,结果见图2。

图2 无花果蛋白酶模拟过氧化物酶催化活性Fig.2 Catalytic activity of ficin mimetic peroxidase
结果表明,ficin+ABTS体系(曲线a)、ficin+H2O2体系(曲线b)、H2O2+ABTS体系(曲线c)溶液体系均没有出现特征吸收峰,所对应的溶液体系颜色也均为无色,说明当体系中只有H2O2和ABTS存在时,ABTS不会被氧化,彼此之间没有发生任何还原反应,而当无花果蛋白酶分别与H2O2和ABTS存在时,也不发生任何反应;与此同时,ficin+H2O2+ABTS体系(曲线d)溶液体系却呈现出绿色,且ficin+H2O2+ABTS体系在波长420 nm处具有明显的特征吸收峰,该峰是由于无花果蛋白酶催化H2O2产生·OH从而将ABTS氧化成ABTS+·所形成的。综上所述,只有在无花果蛋白酶、H2O2和ABTS共同存在的条件下,无花果蛋白酶可以发生模拟过氧化物酶的催化反应。说明无花果蛋白酶有过氧化物模拟酶的催化活性,可以专一的催化H2O2与底物ABTS产生显色反应。
2.2 不同因素对检测方法的影响
无花果蛋白酶模拟过氧化物酶的催化活性受H2O2浓度、无花果蛋白酶质量浓度、温度和孵育时间影响,依据1.2.1节实验方案,进行条件优化,结果如图3。由图3(a)可知,H2O2浓度在0.05~0.5 mol/L范围内时,随H2O2浓度的增加吸光度差值呈快速增加趋势;添加量在0.5~1.5 mol/L范围内时,随H2O2浓度的增加,吸光度差值逐渐下降。溶液中过量的H2O2会与维生素C发生反应,影响自由基清除体系的响应效果,考虑到检测的灵敏度和精确度,在后续实验中选择0.5 moL/L H2O2进行维生素C检测,且在正交试验中选择H2O2浓度为0.1、0.5、1.0 mol/L。
由图3(b)可知,考察无花果蛋白酶质量浓度对催化活性的影响。无花果蛋白酶质量浓度在0.05~0.5 μg/mL范围内时,随浓度的增加吸光度差值呈快速增加趋势;在0.5~10 μg/mL范围内时,随质量浓度增加吸光度差值变化缓慢平稳上升。因此选择0.5、5、10 μg/mL参与之后的优化实验。
由图3(c)可知,当温度在30~60 ℃范围内时,随着催化的温度不断升高,吸光度差值呈上升趋势,说明在较宽的温度范围内,模拟酶具有较好的催化效果;当温度在60~70 ℃范围内,出现下降趋势,表明温度过高会使活性减弱。在接下来的正交优化实验中,温度取50、60、70 ℃较为适合。
由图3(d)可知,孵育时间在10~30 s范围内反应速度很快,说明该方法具有快速的维生素C检测响应能力。孵育时间在30~120 s时,催化活性呈下降趋势。结果表明,孵育时间为30 s时催化体系反应效果基本达到最优,且过长的反应时间不利于模拟酶催化体系应用于快检研究。故在正交优化设计实验时选择孵育时间为20、30、60 s。

图3 不同因素对无花果蛋白酶模拟酶催化活性的影响Fig.3 Effect of different factors on mimetic enzyme catalytic activity of ficin
2.3 正交试验优化影响因素分析
设计正交实验,各因素取3个合适的水平,分别以H2O2浓度为A因素,无花果蛋白酶质量浓度为B因素,温度为C因素,孵育时间为D因素,考察它们对反应体系的影响。进行正交试验,将波长420 nm处的吸光度差值ΔA设为参考指标,选择L9(34)正交试验表,利用极差分析,获得无花果蛋白酶模拟酶检测维生素C体系的因素优选方案,结果见表1。由表1可知,极差分析表明影响因素由大到小依次为孵育时间、H2O2浓度、无花果蛋白酶质量浓度、温度。通过极差分析确定的较优方案组合为A2B1C2D3,即H2O2浓度0.5 mol/L,无花果蛋白酶质量浓度0.5 μg/mL,温度50 ℃,孵育时间30 s。以正交结果较优方案进行维生素C检测,重复实验3次,吸光度差值平均值为0.636,相对标准偏差为3.17%。

表1 正交试验结果分析Tab.1 Analysis of orthogonal experiment results
2.4 检测方法工作曲线的构建与检出限分析
配置不同浓度的维生素C溶液,在最优反应条件下进行实验,结果见图4。由图4可知,吸光度差值与体系中维生素C浓度成正比。维生素C浓度在0.001~0.080 mmol/L范围内呈现良好的线性关系,线性回归方程为y=7.381x+0.109 1,相关系数R2值为0.992 3,检出限为0.43 μmol/L,说明此基于无花果蛋白酶模拟酶性质检测维生素C的检测方法灵敏度高。

插图中反应瓶由左至右是建立标准曲线选取的8个由低到高维生素C样品浓度的测试结果。图4 维生素C检测方法工作曲线Fig.4 Working curve of vitamin C detection method
2.5 维生素C检测方法抗干扰性研究
比色检测方法的一个重要指标就是检测其抗干扰性,评估模拟酶检测维生素C体系的特异性和选择性。研究其他可能与维生素C共存物质对检测系统的影响,体系中添加干扰物质包括葡萄糖、蔗糖、甘氨酸、氯化钠、氯化钙和氯化汞,ΔA作为评价标准,结果见图5。由图5可知,当维生素C存在时,吸光度强度有显著变化,而其他干扰物质工作浓度为维生素C浓度的20倍,却不能产生任何明显的吸光度变化,这是因为维生素C能将绿色ABTS+·还原为无色的ABTS。因此,基于比色系统检测维生素C的方法具有极好的选择性。
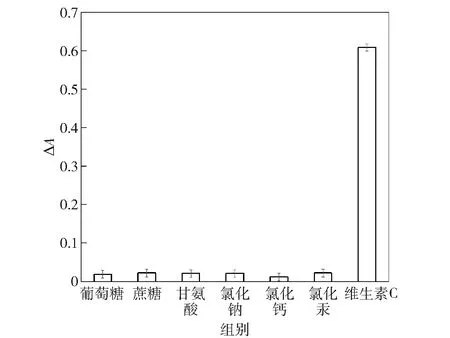
图5 维生素C检测方法的选择性Fig.5 Selectiveness of vitamin C detection method
2.6 检测方法回收率与实际样品检测结果
以最优工艺条件,选择浓度为0.005、0.010、0.050 mmol/L的维生素C溶液进行回收率实验,得出回收率分别为95.59%、104.88%和90.05%,反映出所创建的方法对维生素C检测精确度高、重现性和稳定性好。虽然该检测系统在测定维生素C标准溶液时具有较高的精确度,为验证其对较复杂的真实样品中维生素C的准确测量,探究其对样品中不同浓度维生素C的加标回收率和精密度,通过测定维生素C泡腾片浓度,进一步评价了该方法的可靠性。通过在维生素C泡腾片溶液中加入标准维生素C溶液,进行了维生素C的回收实验。结果表明,平均回收率在95%~105%,相对标准偏差低于2.57%,表明此法可以快速、可靠地应用于大量样品的分析。构建的检测方法操作简单、检测成本低,为维生素C检测提供了一种新思路,具有很大的发展潜力。
3 结 论
无花果蛋白酶作为过氧化物模拟酶,能够催化ABTS+H2O2的显色反应,而维生素C的强抗氧化性能清除自由基,使溶液由绿色变回无色。基于无花果蛋白酶的过氧化物模拟酶性质建立维生素C的比色法检测方法,反应过程不需要复杂的合成和修饰过程,不用引入有机溶剂或重金属,绿色环保,可视化分析结果。该方法灵敏度高,选择性好,且适用于实际样品中维生素C的测定,表明无花果蛋白酶在检测维生素C含量方面潜在的应用价值,有利于促进无花果蛋白酶模拟酶性质在食品分析、医药诊断和生物化学方面的应用。
