油橄榄提取物复配左旋肉碱酒石酸盐抗疲劳功能及安全性评价
2021-08-27侯兴琳吴晓霞刘皓淼车佳行
侯兴琳,吴晓霞,兰 莹,*,刘皓淼,车佳行
(1.西北农林科技大学 食品科学与工程学院,陕西 杨凌 712100;2.陕西师范大学 食品工程与营养科学学院,陕西 西安 710062;3.西安交通大学 生命科学与技术学院,陕西 西安 710062)
机体在长时间持续运动或者高强度运动的情况下会产生疲劳现象。疲劳不仅会造成工作能力下降,同时也会导致机体产生一系列继发性问题,比如抑郁、焦虑、睡眠质量差、能量失衡等。长期处于疲劳状态会导致内分泌紊乱和免疫力下降,从而引发疾病、危害健康[1]。随着人们生活节奏的加快,疲劳引发的健康问题也越来越显著,研究具有抗疲劳功能的保健产品可以帮助预防和改善由于疲劳而引发的一系列健康问题。
油橄榄(Oleaeuropaea)为木犀科木犀榄属乔木,是世界著名的优质油料植物[2]。研究发现:油橄榄提取物中富含橄榄苦苷、黄酮类物质和羟基酪醇等多酚类物质[3],具有多种药理活性,如抗氧化、降血糖、抗菌抗炎、保护器官和骨骼等;油橄榄还具有促进血液循环、促进消化吸收、加快内分泌、清除自由基等功能[4-5]。自由基增多造成的氧化应激是引发疲劳的主要原因之一[6]。研究表明,清除自由基、抗氧化是某些天然物质发挥其抗疲劳功能的有效机制[7-8]。油橄榄中的羟基酪醇等多酚类物质具有很好的抗氧化效果,可以增强机体清除自由基的能力[9],说明油橄榄具有延缓疲劳的潜力。近年来,与油橄榄功能有关的研究主要集中在抗氧化、抗菌抗炎等方面,与抗疲劳功能相关的研究鲜有报道。左旋肉碱又称维生素BT,是一种类维生素样营养素,具有减肥、延缓衰老、消除脂肪肝、促进婴儿生长发育等多种生理功能[10],除此之外,研究表明,左旋肉碱也具有一定的抗疲劳作用[11]。左旋肉碱酒石酸盐是左旋肉碱的稳定形式和理想应用形式,尤其适用于胶囊剂和片剂。本研究拟将油橄榄提取物和左旋肉碱酒石酸盐复配,并根据我国《保健食品检验与评价技术规范》(卫生部2003年版)[12]的规定进行动物实验,通过小鼠负重游泳实验及小鼠血尿素氮、肝糖原、血乳酸含量的测定实验,考察复配物的抗疲劳功能;对油橄榄复配物进行毒理学实验,研究油橄榄复配物的安全性,希望为开发抗疲劳功能相关产品提供理论参考。
1 材料与方法
1.1 材料与试剂
油橄榄提取物(羟基酪醇质量分数为5.2%,总多酚质量分数为7.1%,总黄酮质量分数为11.5%,水分及挥发物质量分数为4.3%,灰分质量分数为2.3%)、左旋肉碱酒石酸盐,江苏奥福生物科技有限公司;玉米淀粉,河南省新乡市新良食品公司。鼠伤寒沙门氏菌组氨酸缺陷型菌株TA97、TA98、TA100和TA102及大鼠肝S9代谢活化系统,美国Moltox公司;敌克松、2-氨基芴、叠氮化钠、1,8-二羟基蒽醌,美国Sigma公司;柔毛霉素、丝裂霉素C,上海源叶生物科技有限公司;环磷酰胺,山西普德药业有限公司。肝糖原检测试剂盒、血乳酸检测试剂盒,南京建成赛浩科技有限公司;血液生化学指标检测试剂盒,深圳迈瑞生物医疗电子股份有限公司。实验采用的试剂均为分析纯。
1.2 实验动物
SPF级昆明种小鼠和SD大鼠,由西安交通大学医学院实验动物中心提供,实验动物许可证号:SCXK(陕)2012-003。实验动物房为屏障系统,使用许可证号:SYXK(陕)2012-006,温度20~25℃,相对湿度45%~65%。动物饲料使用标准饲料(LAD3001M),购于南通特洛菲饲料科技有限公司。
1.3 主要仪器及设备
自制游泳箱(50 cm×50 cm×50 cm);JD500-2型电子天平,赛多利斯科学仪器有限公司;UV-7504型紫外可见分光光度计,日本岛津公司;BC-2800vet型血细胞分析仪、BS-420型全自动生化分析仪,深圳迈瑞生物医疗电子股份有限公司;LW200LT型显微镜,德国Leica公司;HH-4型数显恒温水浴锅,金坛市城西春兰实验仪器厂;BF240型恒温培养箱,德国Binder公司;TGL-16C型离心机,上海安亭科学仪器厂;MS-3型旋涡振荡混合器,德国IKA公司。
1.4 油橄榄复配物的制备
为了便于在实验过程中定量给小鼠灌胃受试物,先将受试物制作成固定质量的胶囊。每粒胶囊的质量为0.35 g,其中油橄榄提取物质量占36%,左旋肉碱酒石酸盐质量占20%,玉米淀粉质量占44%。
1.5 抗疲劳功能实验
1.5.1实验设计
选取游泳姿势正确的雄性小鼠160只,分为4个实验组,每个实验组40只小鼠,并随机分为4小组。油橄榄复配物灌胃剂量(以体重计)设计为高(1.05 g/kg)、中(0.70 g/kg)、低(0.35 g/kg)3个剂量组[13](低剂量组相当于人体摄入28 mg/kg[14]),另设阴性对照组(蒸馏水)。每小组实验动物数为10只。4个实验组分别进行负重游泳实验、血尿素氮实验、肝糖原实验、血乳酸实验。将油橄榄复配物与蒸馏水混合制成混悬液,按设定的剂量每天灌胃一次,灌胃体积(以体重计)为20 mL/kg;阴性对照组给予等体积蒸馏水,连续灌胃30 d后,分别进行各项指标的测定。
1.5.2小鼠负重游泳实验
对小鼠连续灌胃30 d,于末次灌胃30 min后,在小鼠尾根部负荷相当于其5%体重的铅皮。将小鼠置于水温25 ℃、水深35 cm的游泳箱中游泳,小鼠负重游泳时间为小鼠入水至力竭而沉入水中并持续8 s不能浮出水面的时间。
1.5.3小鼠血尿素氮含量测定
对小鼠连续灌胃30 d,于末次灌胃30 min后,让小鼠在温度为30 ℃的水中不负重游泳90 min。让小鼠休息60 min后,拔眼球采全血约0.5 mL(不加抗凝剂),2 000 r/min离心15 min,取血清,用全自动生化分析仪进行血尿素氮测定。
1.5.4小鼠肝糖原含量测定
对小鼠连续灌胃30 d,于末次灌胃30 min后,颈椎脱臼处死动物,解剖取出肝脏,生理盐水清洗,滤纸吸干后,严格按照试剂盒操作说明书测定肝糖原含量。
1.5.5小鼠血乳酸含量测定
对小鼠连续灌胃30 d,于末次灌胃30 min后,小鼠不负重在温度30 ℃的水中游泳10 min后停止。分别于游泳前、游泳后0 min和游泳后20 min,眼眶静脉丛采全血20 μL。采用试剂盒测定血乳酸含量,计算3个时间点血乳酸曲线下面积。
1.6 油橄榄复配物的安全性评价方法
1.6.1大鼠急性毒性实验
选用SD大鼠20只,雌雄各半,体重为180~220 g。根据最大耐受剂量法[12]确定灌胃剂量为16.0 g/kg(相当于人体摄入2.6 g/kg[14]),灌胃体积为20 mL/kg。对大鼠按一次经口灌胃给予样品,灌胃前16 h禁食,不限饮水。观察14 d内大鼠的中毒症状及死亡情况,实验第1天、第7天、第14天称量质量,最后处死动物作大体解剖。
1.6.2遗传毒性实验
1.6.2.1 Ames实验
采用鼠伤寒沙门氏菌组氨酸缺陷型菌株TA97、TA98、TA100和TA102,进行加与不加S9的标准平皿渗入法实验。实验设5个油橄榄复配物剂量组:5 000、1 000、200、40、8 μg/皿,同时设自发对照、溶剂对照(蒸馏水)和阳性对照组。不加S9实验的阳性对照物为50.0 μg/皿的敌克松(TA97)、6.0 μg/皿的柔毛霉素(TA98)、1.5 μg/皿的叠氮化钠(TA100)、0.5 μg/皿的丝裂霉素C(TA102);加S9实验阳性对照物为50 μg/皿的1,8-二羟基蒽醌(TA102)和10 μg/皿的2-氨基芴(TA97、TA98、TA100)。每皿加入阳性对照物的体积为0.1 mL,每个实验剂量做3个平行皿,重复实验1次。
1.6.2.2 小鼠骨髓细胞微核率的计算
选取雌雄各半、体重为25~30 g的昆明种小鼠50只,将小鼠随机分为5组,每组10只,雌雄各半。实验设高(10.0 g/kg)、中(5.0 g/kg)、低(2.5 g/kg)3个油橄榄复配物剂量组,另设溶剂对照组(蒸馏水)和环磷酰胺阳性对照组(CP,40 mg/kg)。采用30 h给受试物法对小鼠经口灌胃,首次灌胃后间隔24 h进行第2次灌胃,6 h后处死动物,取股骨骨髓进行制片,Giemsa染色后镜检。每只动物计数1 000个嗜多染红细胞(PCE),观察含有微核的嗜多染红细胞数,计算微核率;同时观察200个红细胞中PCE和成熟红细胞(NCE)所占数目,并计算PCE/NCE值。
1.6.2.3 小鼠精子畸形率的计算
选取体重为25~35 g雄性昆明种小鼠50只,分组及剂量设计同小鼠骨髓细胞微核实验。各组均按灌胃体积为20 mL/kg经口灌胃,每日1次,连续5 d。首次灌胃后第35天颈椎脱臼法处死小鼠,制备精子标本,1%伊红染色。高倍镜下观察,每只动物计数1 000个精子,记录精子畸形数、畸形类型,并计算精子畸形率。
1.6.3大鼠中毒情况监测和组织病理学检查
选用雌雄各半、体重为65~92 g的SD大鼠80只,随机分为4组,每组20只,雌雄各半。实验设高(3.50 g/kg)、中(1.75 g/kg)、低(0.88 g/kg)3个油橄榄复配物剂量组,另设溶剂对照组(蒸馏水)。灌胃体积为10 mL/kg,每日1次,连续灌胃30 d。观察动物的一般表现、行为、中毒症状及死亡情况。每周称量1次大鼠体重和2次进食量,计算食物利用率。实验结束时,摘眼球取血,用血细胞分析仪测定血液学指标,用全自动生化分析仪测定血液生化学指标。将实验动物脱颈椎处死,进行大体解剖,观察内脏改变,称量肝、肾、脾、睾丸湿重,计算其脏体比,取肝、肾、脾、胃肠、睾丸(卵巢)作组织病理学检查。实验期间动物自由进食、饮水。
1.7 数据处理
实验结果以平均值±标准差表示,采用SPSS 19.0统计软件对实验数据进行单因素方差分析和两两比较。
2 结果与分析
2.1 油橄榄复配物抗疲劳功能分析
2.1.1油橄榄复配物对小鼠负重游泳时间的影响
运动耐力的高低是机体抗疲劳能力最直接且客观的表现,小鼠负重游泳时间越长表明小鼠的运动耐力越强[15]。小鼠负重游泳实验结果见图1,由图1可知,与阴性对照组相比,油橄榄复配物各剂量组小鼠的平均负重游泳时间均延长,且高剂量组小鼠负重游泳时间显著延长(P<0.05),表明了油橄榄复配物能够显著延长小鼠的负重游泳时间,具有抗疲劳功效,并且抗疲劳作用会随着油橄榄复配物剂量增加呈现上升趋势。
2.1.2油橄榄复配物对小鼠血尿素氮含量的影响
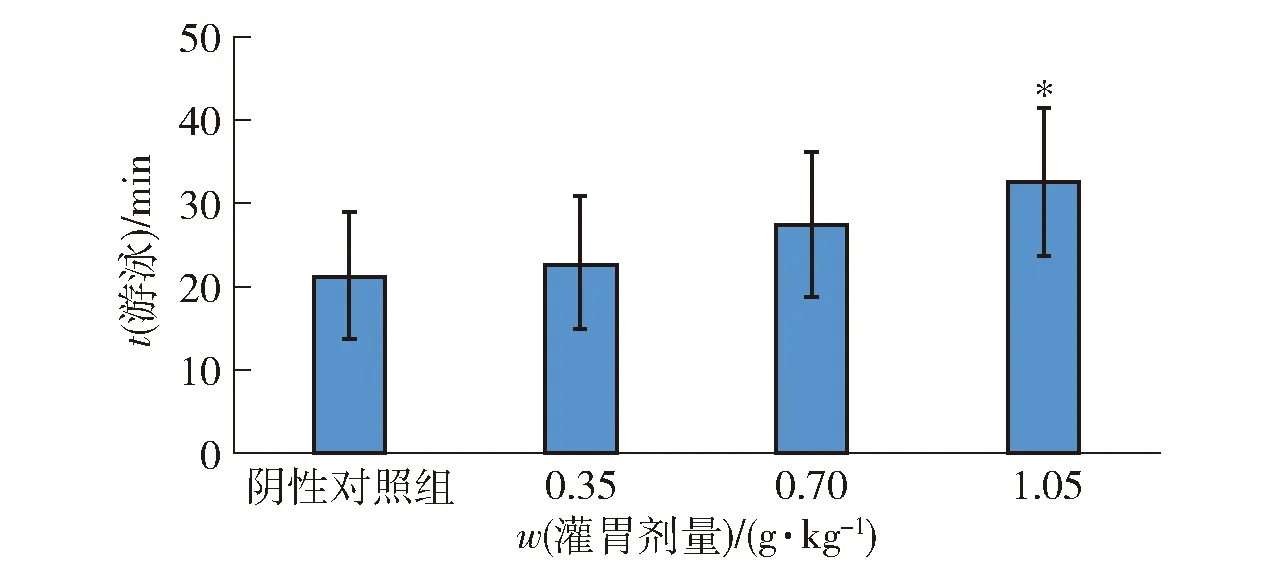
*表示与阴性对照组相比有显著性差异(P<0.05)。图1 油橄榄复配物对小鼠负重游泳时间的影响Fig.1 Effect of Olea europaea compounds on weight loading swimming time of mice
小鼠血尿素氮含量测定结果见图2,图2显示,小鼠无负重游泳90 min后,与阴性对照组相比,油橄榄复配物各剂量组小鼠血尿素氮含量均降低,其中高剂量组血尿素氮含量显著降低(P<0.05),中剂量组血尿素氮含量极显著降低(P<0.01)。机体剧烈运动会导致肌糖原和脂肪供应不足,从而增强蛋白质和氨基酸的代谢,产生血尿素氮,血尿素氮含量与疲劳程度呈现正相关[16],图2说明油橄榄复配物可以通过降低血尿素氮含量发挥抗疲劳作用。

*表示与阴性对照组相比有显著性差异(P<0.05);**表示与阴性对照组相比有极显著性差异(P<0.01)。图2 油橄榄复配物对小鼠血尿素氮含量的影响Fig.2 Effect of Olea europaea compounds on blood urea nitrogen content in mice
2.1.3油橄榄复配物对小鼠肝糖原含量的影响
运动强度和持续时间影响着机体中肝糖原的分解速度,当机体长时间剧烈运动时,血糖会大量消耗,中枢神经供能不足,从而引起疲劳;而同时机体为了平衡血糖,会加快肝糖原的分解,所以肝糖原的储备量可以间接反映机体的疲劳程度[17]。小鼠肝糖原含量测定结果见图3,图3显示,与阴性对照组相比,油橄榄复配物各剂量组小鼠肝糖原的储备量均增加,说明油橄榄复配物有通过增加肝糖原储备量发挥抗疲劳作用的趋势,但差异未达到显著(P>0.05)。

图3 油橄榄复配物对小鼠肝糖原含量的影响Fig.3 Effect of Olea europaea compounds on hepatic glycogen content in mice
2.1.4油橄榄复配物对小鼠血乳酸含量的影响
机体过度运动时,缺氧会引起无氧酵解,乳酸含量增加,使机体产生疲劳感,因此血乳酸含量是反映机体疲劳程度的重要指标之一[18]。小鼠血乳酸含量测定结果见表1,表1显示,小鼠无负重游泳10 min后,与阴性对照组相比,油橄榄复配物各剂量组小鼠血乳酸含量均降低,且高剂量组血乳酸含量显著降低(P<0.05),说明油橄榄复配物可以通过降低血乳酸含量来延缓疲劳的产生。
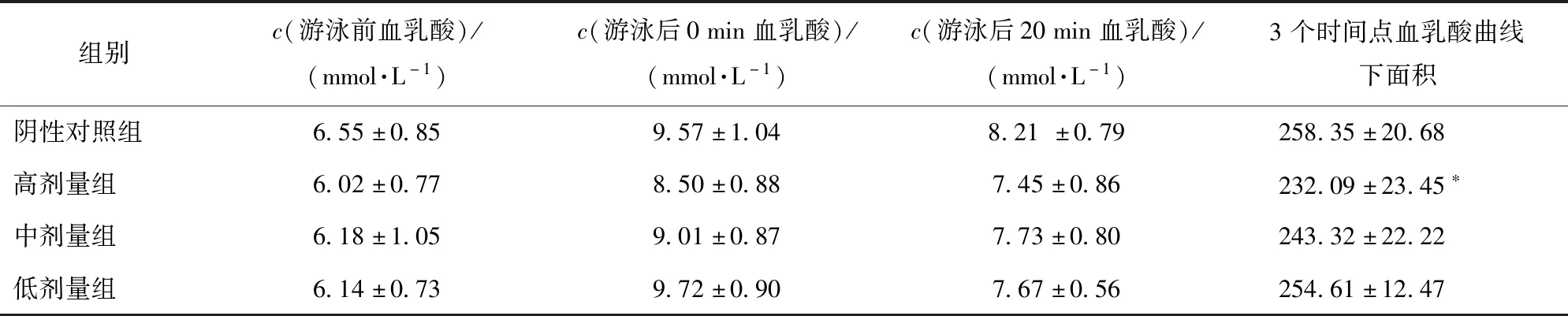
表1 油橄榄复配物对小鼠血乳酸含量的影响Tab.1 Effect of Olea europaea compounds on blood lactic acid content in mice
2.2 油橄榄复配物毒理学安全性分析
2.2.1油橄榄复配物急性毒性分析
急性毒性实验过程中大鼠体重变化见图4,由图4可见,以16.0 g/kg剂量的油橄榄复配物灌胃后,大鼠体重未受到影响,生长状况良好。实验中未见动物有明显中毒症状,观察14 d动物无死亡。实验结束对动物进行大体解剖,观察心、肝、肺、肾、脾、胃等主要脏器均未见明显异常改变。结果表明,油橄榄复配物对大鼠无急性毒性。

图4 大鼠急性毒性实验结果Fig.4 Results of acute toxicity test in rat
2.2.2油橄榄复配物遗传毒性分析
2.2.2.1 油橄榄复配物对Ames实验的影响
油橄榄复配物Ames实验结果见表2、表3。由表2、表3可知,对鼠伤寒沙门氏菌组氨酸缺陷型菌株TA97、TA98、TA100和TA102,无论S9是否加入,油橄榄复配物各剂量组的平均回变菌落数均未超过自发回变菌落数的2倍,也未呈现剂量相关性,表明油橄榄复配物对鼠伤寒沙门氏菌组氨酸缺陷型菌株TA97、TA98、TA100、TA102不具有致突变作用。

表2 第1次Ames实验结果Tab.2 Results of the first Ames test
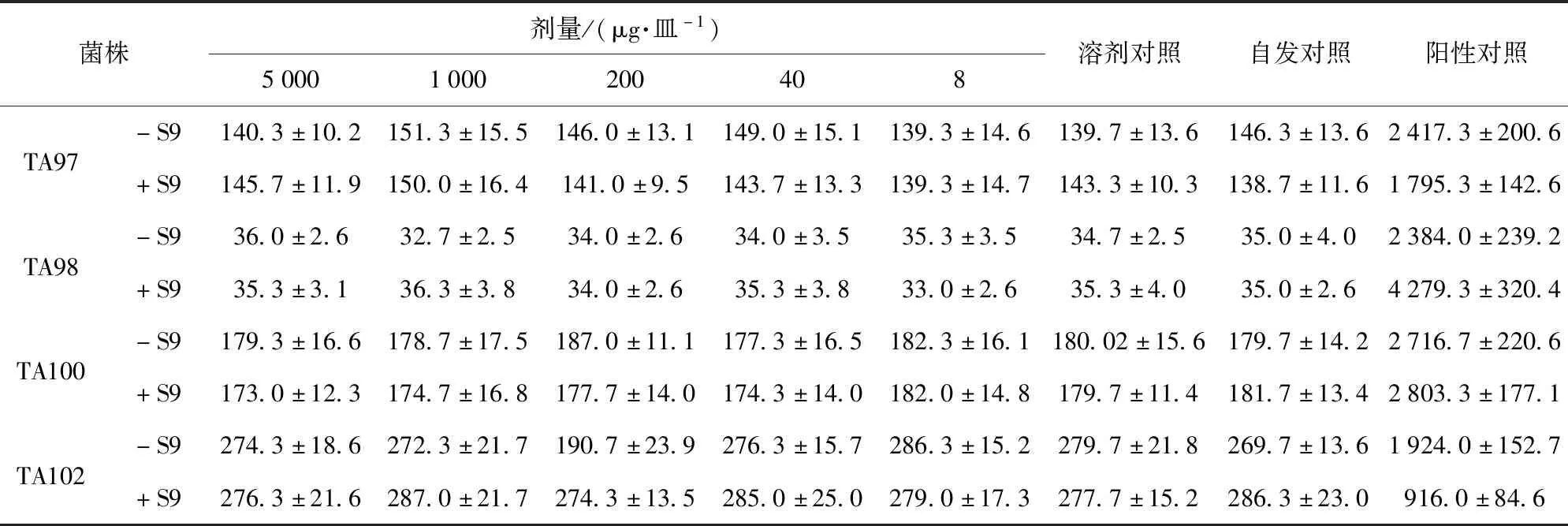
表3 第2次Ames实验结果Tab.3 Results of the second Ames test
2.2.2.2 油橄榄复配物对小鼠骨髓细胞微核的影响
小鼠骨髓细胞微核实验结果见表4,由表4可见,油橄榄复配物各剂量组的PCE/NCE值与溶剂对照组相比均没有显著差异(P>0.05),而且PCE占红细胞总数的比例均不少于溶剂对照组的20%,表明油橄榄复配物未对小鼠骨髓细胞分裂产生抑制。与溶剂对照组相比,阳性对照组的微核率有极显著差异(P<0.01),表明阳性对照物具有明显的致突变作用;而油橄榄复配物各剂量组小鼠的骨髓细胞微核率均没有显著变化(P>0.05),且无剂量相关性。结果表明,油橄榄复配物对两性小鼠的骨髓细胞微核发生率无明显影响,未见致突变作用。

表4 油橄榄复配物对小鼠骨髓细胞微核的影响Tab.4 Effect of Olea europaea compounds on micronucleus of bone marrow cells in mice
2.2.2.3 油橄榄复配物对小鼠精子畸形的影响
小鼠精子畸形实验结果见表5,由表5可见,油橄榄复配物未改变小鼠精子畸形发生率,与溶剂对照组相比,油橄榄复配物各剂量组小鼠的精子畸形率均无显著差异(P>0.05),而阳性对照组与溶剂对照组的差异极显著(P<0.01)。实验结果表明,油橄榄复配物对雄性小鼠的精子没有致畸作用。
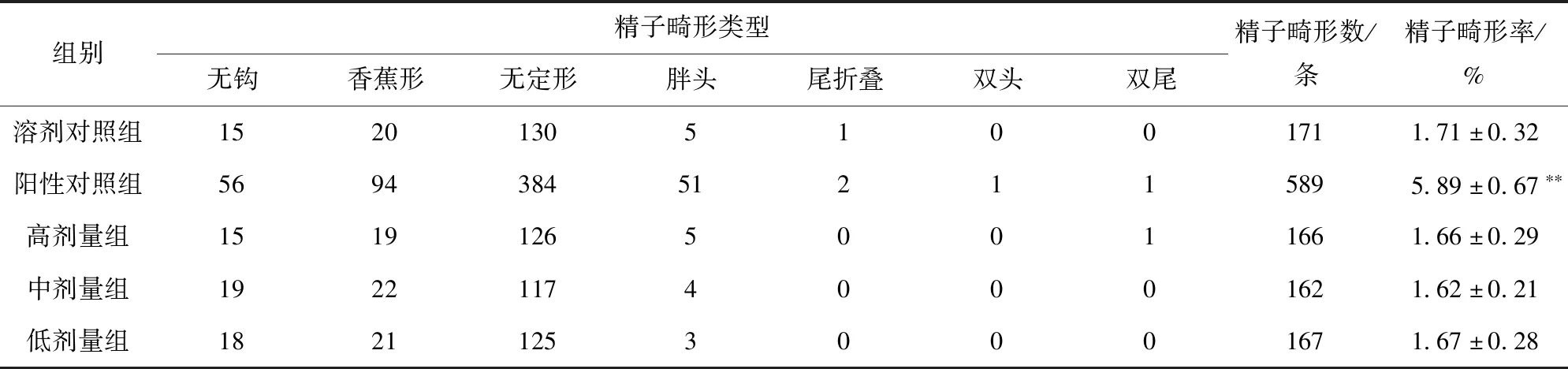
表5 油橄榄复配物对小鼠精子畸形的影响Tab.5 Effect of Olea europaea compounds on sperm abnormality in mice
2.2.3油橄榄复配物30 d喂养安全性分析
实验期间动物健康状况良好,体重持续增长,油橄榄复配物各剂量组动物未出现中毒症状,均未发生死亡。根据《保健食品检验与评价技术规范》(卫生部2003年版)[12]中的实验方法,对30 d喂养过程中大鼠体重、进食量、食物利用率以及30 d喂养结束后大鼠血液学、血液生化学、脏器质量及脏器/体重比值、组织病理学等指标进行测定。
2.2.3.1 油橄榄复配物对大鼠体重、进食量及食物利用率的影响
30 d喂养期间大鼠体重、进食量及食物利用率见表6至表8。由表6至表8可见,以高(3.50 g/kg)、中(1.75 g/kg)、低(0.88 g/kg)剂量的油橄榄复配物连续灌胃30 d,油橄榄复配物各剂量组与溶剂对照组比较,雌雄大鼠每周的体重、进食量、食物利用率,总进食量、总食物利用率均无显著差异(P>0.05),表明油橄榄复配物对大鼠的体重增长、进食量和食物利用率无明显影响。
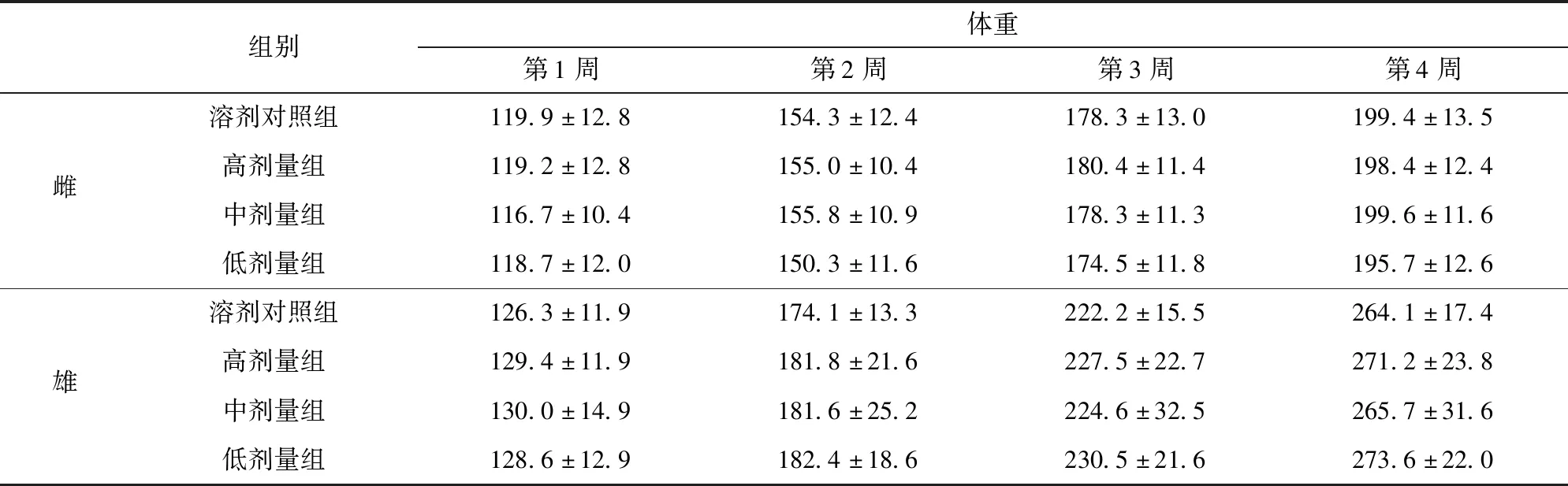
表6 油橄榄复配物对大鼠1~4周体重的影响Tab.6 Effect of Olea europaea compounds on weight of rat at 1-4 weeks g
2.2.3.2 油橄榄复配物对大鼠血液学指标的影响
大鼠血液学指标测定结果见表9。由表9可见,以高(3.50 g/kg)、中(1.75 g/kg)、低(0.88 g/kg)剂量的油橄榄复配物连续灌胃30 d,油橄榄复配物各剂量组雌雄大鼠的白细胞总数、红细胞总数、血红蛋白含量、粒细胞百分比、淋巴细胞百分比、单核细胞百分比等指标与溶剂对照组比较,均无显著性差异(P>0.05),表明油橄榄复配物对大鼠的血液学指标无明显影响。

表9 油橄榄复配物对大鼠血液学指标的影响Tab.9 Effect of Olea europaea compounds on hematology indexes in rat
2.2.3.3 油橄榄复配物对大鼠血液生化学指标的影响
大鼠血液生化学指标测定结果见表10、表11。由表10、表11可见,以高(3.50 g/kg)、中(1.75 g/kg)、低(0.88 g/kg)剂量的油橄榄复配物连续灌胃30 d,油橄榄复配物各剂量组雌雄大鼠的谷丙转氨酶、谷草转氨酶、总蛋白、白蛋白、肌酐、尿素氮、胆固醇、血糖、甘油三酯等指标与溶剂对照组比较,均无显著性差异(P>0.05),表明油橄榄复配物对大鼠的血液生化指标无明显影响。

表10 油橄榄复配物对大鼠血液中转氨酶和蛋白含量的影响Tab.10 Effect of Olea europaea compounds on transaminase and protein content in blood of rat
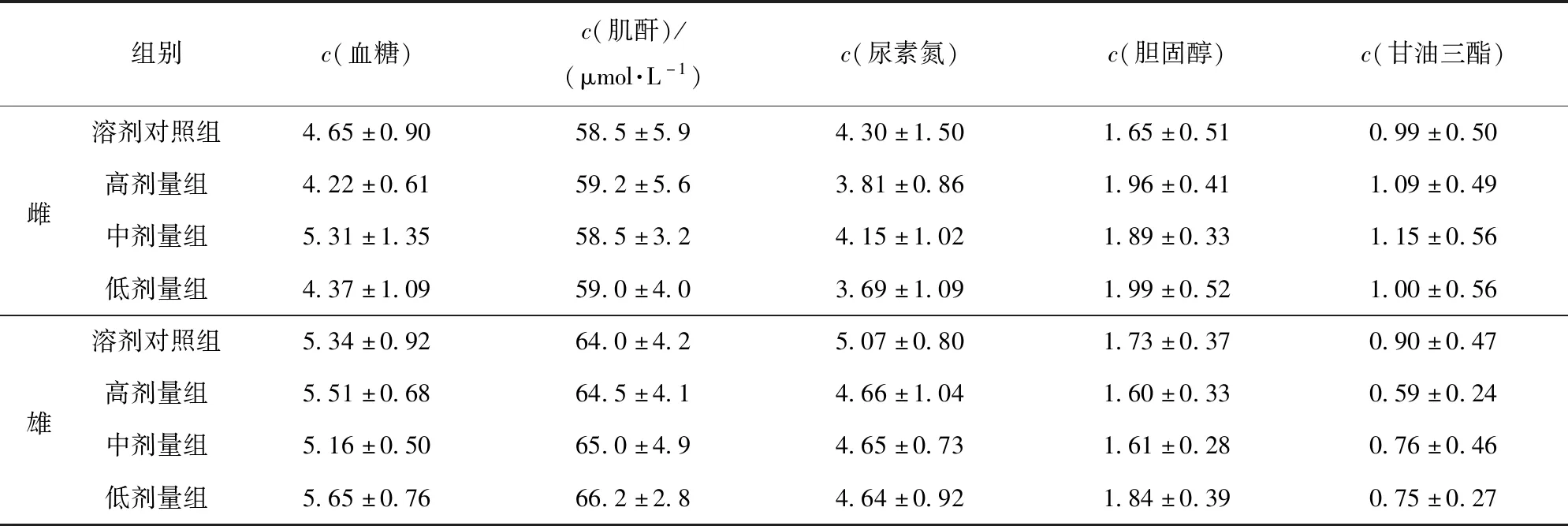
表11 油橄榄复配物对大鼠血液中糖、肌酐、尿素氮、胆固醇、甘油三酯含量的影响Tab.11 Effect of Olea europaea compounds on sugar,creatinine,urea nitrogen,cholesterol and triglyceride content in blood of rat mmol/L
2.2.3.4 油橄榄复配物对大鼠脏器质量及脏器/体重比值的影响
大鼠脏器质量及脏器/体重比值测定结果见表12、表13。由表12、表13可见,以高(3.50 g/kg)、中(1.75 g/kg)、低(0.88 g/kg)剂量的油橄榄复配物连续灌胃30 d,油橄榄复配物各剂量组大鼠的肝、肾、脾质量、雄鼠睾丸质量和肝/体重比值、肾/体重比值、脾/体重比值、雄鼠睾丸/体重比值与溶剂对照组比较,均无显著差异(P>0.05),表明油橄榄复配物对大鼠的脏器质量及脏器/体重比值无明显影响。

表12 油橄榄复配物对大鼠脏器质量的影响Tab.12 Effect of Olea europaea compounds on viscera weight in rat g
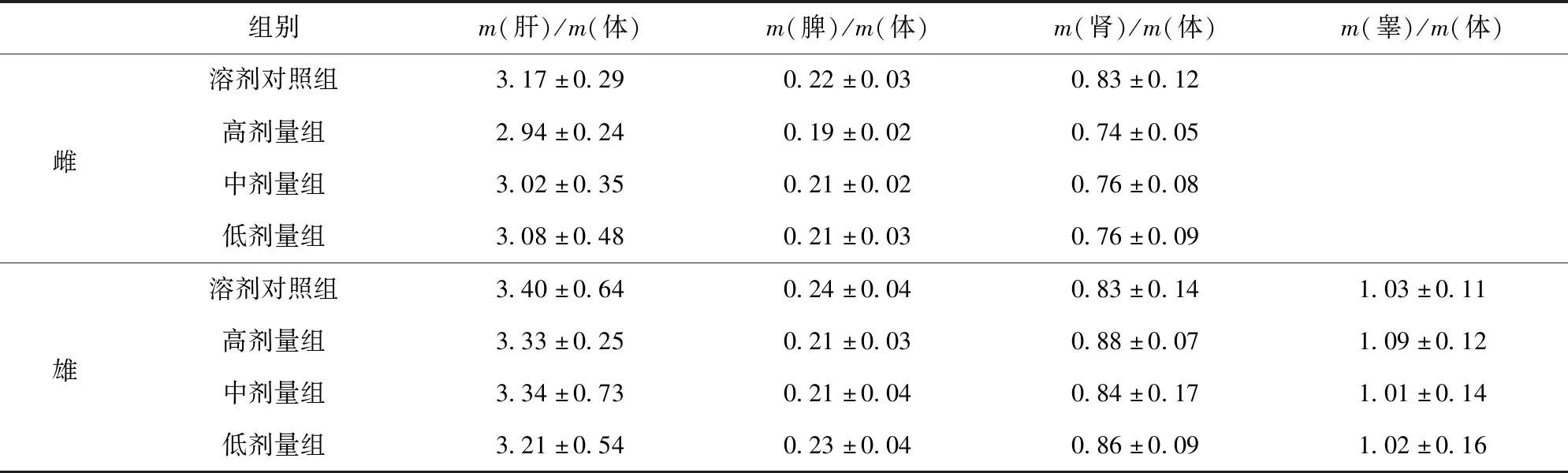
表13 油橄榄复配物对大鼠脏器/体重比值的影响Tab.13 Effect of Olea europaea compounds on ratio of viscera to body weight in rat %
2.2.3.5 油橄榄复配物对大鼠组织病理状态的影响
实验结束后处死动物,进行大体解剖,观察结果显示,大鼠组织器官发育良好,外观颜色和脏器大小正常,无渗出、增生、水肿、萎缩等病变。对高剂量组和溶剂对照组主要脏器肝、脾、肾、胃、肠、睾丸、卵巢等取材做组织病理检查,结果见图5。图5(c)、(d)显示,溶剂对照组雌鼠共有2例轻度肝小叶空泡变;图5(e)、(f)显示,溶剂对照组雄鼠共有2例轻度肝小叶空泡变;图5(g)、(h)显示,高剂量组雌鼠共有2例轻度肝小叶空泡变;图5(i)显示,高剂量组雄鼠共有1例轻度肝小叶空泡变;其余组织均未见异常,变化均在正常形态学范围内。
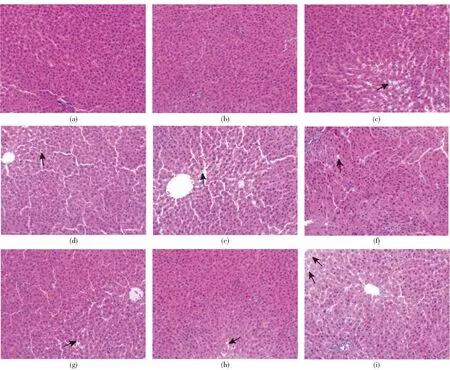
(a)、(b)为正常大鼠肝脏切片;(c)、(d)为溶剂对照组雌鼠2例轻度空泡变;(e)、(f)为溶剂对照组雄鼠2例轻度空泡变;(g)、(h)为高剂量组雌鼠2例轻度空泡变;(i)为高剂量组雄鼠1例轻度空泡变。图片中箭头指向的是轻度肝小叶空泡变。图5 油橄榄复配物对大鼠肝脏组织病理状态的影响Fig.5 Effect of Olea europaea compounds on histology of liver in rat
3 结 论
本研究连续30 d采用油橄榄复配物样品对小鼠灌胃,并进行小鼠负重游泳实验,对小鼠的血尿素氮、肝糖原、血乳酸含量进行测定,实验结果表明:油橄榄复配物可以显著延长高剂量组小鼠负重游泳时间(P<0.05),显著降低其血乳酸含量和血尿素氮含量(高剂量组P<0.05,中剂量组P<0.01)。根据《保健食品检验与评价技术规范》(卫生部2003年版)[12]可以判定,油橄榄复配物具有明显的抗疲劳功能。本研究与已有研究(左旋肉碱灌胃剂量为600 mg/kg)[19]相比,无论是在动物行为学(负重游泳实验)还是血液生化学(血尿素氮含量)方面,油橄榄提取物与左旋肉碱酒石酸盐复配之后的抗疲劳效果都要优于左旋肉碱的单独作用,说明油橄榄提取物可以取代部分左旋肉碱发挥抗疲劳作用并且效果更佳。通过急性毒性实验、遗传毒性实验、大鼠30 d喂养实验对油橄榄复配物进行安全性评价,结果显示:油橄榄复配物无急性毒性和遗传毒性;30 d喂养实验期间油橄榄复配物各剂量组动物的体重、进食量、食物利用率、血液学指标、血液生化学指标、脏器质量及脏器/体重比值等均无显著改变(P>0.05);大体解剖观察和组织病理学检查均未见异常改变,并且在受试范围内未观察到其他毒副作用。由此可见,油橄榄复配物无不良影响,具有较高的安全性。希望本实验结果可以为科学高效地利用油橄榄,开发具有抗疲劳功能的产品提供实验基础和科学依据。
除了氧化应激之外,能量耗竭和代谢产物积累也是疲劳产生的可能机制[20-21]。本实验虽然验证了油橄榄复配物具有抗疲劳作用,但无法确定油橄榄提取物中抗疲劳成分是否为羟基酪醇,并且其分子机制尚不明确,这也为我们提供了更多的研究思路,比如提取油橄榄中的羟基酪醇,开展油橄榄抗疲劳的分子机制相关研究。
