低分子肝素对颈动脉球囊损伤模型大鼠AngⅡ、HB-EGF表达及内膜增生的影响
2021-08-26赵治涛肖珂青
赵治涛 肖珂青
近年来,随着社会压力增大和老龄化加重,心血管疾病已成为威胁人类生命健康的主要原因之一[1,2]。由冠状动脉硬化(coronary atherosclerosis,CAS)引起的冠心病是心血管疾病的主要类型,也是导致心血管病患者死亡的主要原因之一[3]。目前,临床上治疗冠心病的主要方法是经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI),但PCI术后可引起血管平滑肌细胞(vascular smooth muscle cell,VSMC)过度增殖、内膜异常增生、迁移,导致冠状动脉再狭窄、硬化等[4]。而颈动脉球囊损伤术所导致的血管内皮剥落和VSMC增生,与人类 PCI 术所引起的冠脉狭窄及CAS病理变化过程相似,因此复制动物颈动脉球囊损伤模型,可模拟人类PCI 术血管内膜增生病变过程[5]。目前,抑制PCI 术后VSMC增生、迁移是心血管临床研究的难点和热点之一[6]。研究发现在病理因素刺激下,血管紧张素Ⅱ(Angiotensin,AngⅡ)和肝素结合性表皮生长因子(Heparin-binding epidermal growth factor,HB-EGF)异常表达,可诱导并促进VSMC的异常增殖、迁移及表型转化[7,8],因此调控AngⅡ和HB-EGF的表达,可能对抑制人类PCI 术血管内膜增生病变有潜在的临床价值。低分子肝素(low molecular weight heparin,LMWH)具有抗炎、抗凝血作用[9],研究发现,LMWH可被用于预防PCI 术后血栓形成[10],但LMWH对PCI 术血管内膜增生病变及AngⅡ和HB-EGF的调控作用,笔者发现报道较少。本研究建立大鼠颈动脉球囊损伤术复制人类PCI 术病理血管内膜增生病变过程,探究LMWH给药期间,血管内膜增生变化及AngⅡ和HB-EGF蛋白的调控作用LMWH治疗人类PCI术并发症的可能机制。
1 材料与方法
1.1 实验动物 取清洁级健康雌性SD大鼠52 只,体重 200~220 g,由广东省医学实验动物中心提供,生产许可证号为SCXK(粤)2018-0002,动物质量合格证号为省科委2000A027。所有大鼠于本院动物房中饲养,饲养条件:自然光照,自由饮食、饮水,温度25℃,相对湿度50%,噪音<80分贝,保持动物房环境及鼠笼清洁、透气。本研究经本院动物伦理委员会批准同意。试验符合3R原则。
1.2 试剂及仪器 LMWH(货号:140646-201002,购自上海雅吉生物科技有限公司);白细胞介素-6(Interleukin-6,IL-6)酶联免疫吸附(Enzyme-linked immunosorbent assay,ELISA)试剂盒(货号:K-F5988,购自上海科顺生物科技有限公司);肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)ELISA试剂盒(货号:F12999,购自上海研谨生物科技有限公司);AngⅡ抗体、HB-EGF抗体、缝隙连接蛋白43(Connexin 43,Cx43)抗体(货号分别为:ab236317、ab175555、ab230523,均购自美国abcam公司);苏木精-伊红染色(Hematoxylin-Eosin,HE)染色试剂盒(货号:LMO105,购自上海联迈生物工程有限公司);总RNA提取(Trizol)试剂盒、反转录试剂盒(货号分别为:T6126、T1597,均购自日本TAKARA);BCA 蛋白定量试剂盒和胰蛋白酶(货号分别为P0768,P0231,均购自美国Pierce 公司);实时荧光定量 PCR 仪(型号:Mastercycler nexus X2,购自德国Eppendorf艾本德);蛋白电泳仪、半干转膜仪(型号分别为1659001、Trans-Blot SD,均购自美国Bio-Rad公司)等。
1.3 大鼠颈动脉球囊损伤模型建立及分组给药 参照文献[11]制备大鼠颈动脉球囊损伤模型,具体操作方法为:取42只健康SD雄性大鼠,用3%戊巴比妥钠麻醉后,于颈部正中切口,分离出左侧颈总动脉、颈外动脉,并将颈外动脉远端结扎,临时阻断颈左、颈总动脉血流,将2.0 mm×12.0 mm的球囊导管由颈外动脉插入至颈总动脉后,将球囊充盈,并缓慢反复来回抽动球囊3次,确保血管内膜损伤后,退出球囊,然后将颈外动脉结扎。术后给予30万单位青霉素肌内注射,3 d,1次/d以预防感染。术后第4天,随机取2只,处死取颈动脉组织,HE染色,若血管组织内膜有增厚现象,表明造模成功,共造模成功40只,随机分为模型组、LMWH低(50 U/kg)、中(100 U/kg)、高(200 U/kg)剂量组,每组10只;另取10只雄性SD大鼠,只暴露并分离左侧颈外、颈总动脉,不结扎、不进行球囊损伤,其余操作同模型组,作为假手术组。5组均于造模成功后开始给药,LMWH药物参照文献[12]以0.9%氯化钠溶液配置为5.00、10.00、20.00 U/kg的混悬液,以10 ml/kg的剂量经尾静脉注射给药;假手术组与模型组经尾静脉给予等剂量0.9%氯化钠溶液,5组连续给药14 d,1次/d。
1.4 观察指标
1.4.1 5组颈动脉血管组织HE染色:5组大鼠,于末次给药24 h后,随机取5只,处死,取颈动脉血管组织,置于-80℃冰箱保存,剩余5只,处死后取颈动脉血管组织,置于4%多聚甲醛溶液中固定24 h后,进行常规透明、浸蜡、包埋后、切成厚度为5 μm的切片,按HE染色试剂盒说明书进行染色、脱水、透明后封片,置于光学显微镜下观察组织病理变化,并使用(Image-ProPlus,IPP)图像分析软件对损伤血管的管腔面积、内膜面积、中膜面积进行测量,并计算内膜/中膜的面积(IA/MA)比。
1.4.2 5组大鼠血管组织炎性因子IL-6、TNF-α含量检测:取1.4.1中-80℃冰箱保存的血管组织约0.5 g,于4℃冰箱中解冻后,用组织匀浆器匀浆、离心分离后,取上清液,按 ELISA试剂盒说明书方法检测IL-6、TNF-α含量。
1.4.3 qRT-PCR检测5组大鼠血管组织HB-EGF mRNA、AngⅡ mRNA相对表达水平:取-80℃冰箱保存颈动脉血管组织约0.5 g,于4℃冰箱中解冻后,用Trizol试剂盒抽提总RNA,按逆转录试剂盒说明书以总RNA为模板,逆转录cDNA,按RT-qPCR试剂盒(SYBR Green)和PCR仪进行扩增,36个循环,以β-actin为内参,严格按试剂盒说明建立反应体系及参数,检测5组大鼠血管组织中HB-EGF mRNA、AngⅡ mRNA相对表达量,qRT-PCR引物由生工生物工程(上海)股份有限公司合成。采用2-ΔΔCt算法计算HB-EGF mRNA、AngⅡ mRNA相对表达量。见表1。

表1 q-RT-PCR引物序列
1.4.4 Western Blot检测血管组织中HB-EGF、AngⅡ、Cx43蛋白相对表达水平:取-20℃冰箱保存的上清液,于4℃冰箱中解冻后,用蛋白提取试剂盒提取蛋白BCA 试剂盒说明书测定蛋白浓度后,取50 μg蛋白进行电泳、转膜反应后,置于5%的脱脂奶粉溶液中,于摇床上37℃封闭2 h,将目的蛋白条带,置于孵育盒中,加入抗体(HB-EGF、AngⅡ、Cx43、β-actin,1∶1 000、1∶1 000、1∶1 000、1∶2 000)于4℃冰箱中孵育过夜,经TBST漂洗3次,加入1∶1 000的羊抗兔二抗溶液,于摇床上室温孵育2 h,经TBST再次漂洗3次,采用增强化学发光法显色,以凝胶成像仪观察条带并拍照,并以Image-J软件分析5组蛋白相对表达。
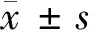
2 结果
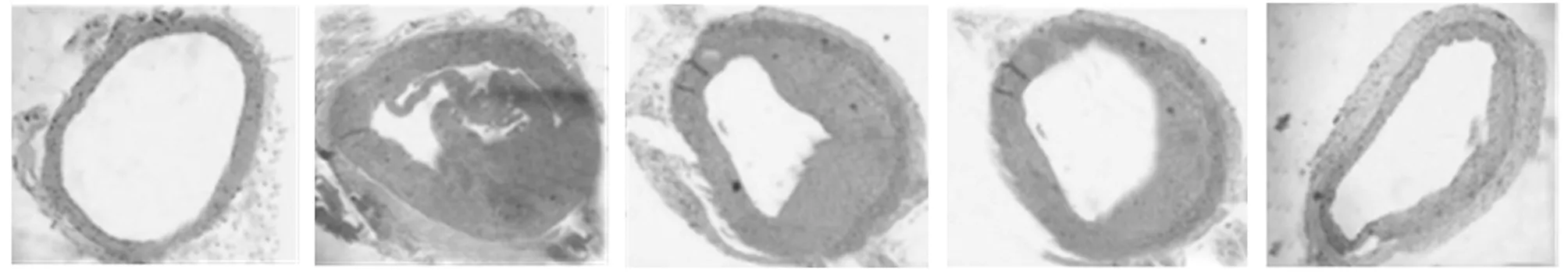
2.1 5组大鼠血管组织HE染色结果 假手术组大鼠颈动脉结构正常。与假手术组比较,模型组大鼠可见颈动脉内皮剥脱、部分内弹力板变平坦、失去弹性,血管内有新生内膜形成并增厚,且内膜血管平滑肌细胞增多,中膜血管平滑肌细胞排列紊乱,血管管腔呈向心或偏心性狭窄。与假手术组相比,LMWH低、中、高剂量组上述颈动脉内皮剥落、内膜增生及管腔狭窄等病理现象均有不同程度的改善。见图1、2。

2.2 5组大鼠颈动脉血管组织管腔面积、内膜面积、IA/MA比值检测结果 与假手术组比较,模型组大鼠血管内膜面积、IA/MA比值均显著升高(P<0.05),管腔面积显著降低(P<0.05);与模型组比较,LMWH低、中、高剂量组大鼠内膜面积、IA/MA比值均显著降低(P<0.05),血管管腔面积显著升高(P<0.05),且LMWH 3个剂量组上述指标呈剂量依赖性。见表1。

表1 5组大鼠管腔面积、内膜面积、IA/MA比较
2.3 大鼠血管组织炎性因子IL-6、TNF-α检测结果 与假手术组比较,模型组大鼠血管组织炎性因子IL-6、TNF-α均显著升高(P<0.05);与模型组比较,LMWH低、中、高剂量组大鼠血管组织炎性因子IL-6、TNF-α均显著降低(P<0.05),且LMWH各剂量组上述指标呈剂量依赖性。见表2。

表2 5组大鼠血管组织炎性因子IL-6、TNF-α比较
2.4 5组大鼠血管组织中HB-EGF mRNA、AngⅡ mRNA相对表达水平检测结果 与假手术组比较,模型组大鼠血管组织HB-EGF mRNA、AngⅡ mRNA表达均显著升高(P<0.05);与模型组比较,LMWH低、中、高剂量组大鼠血管组织血管组织HB-EGF mRNA、AngⅡ mRNA表达均显著降低(P<0.05),且LMWH各剂量组上述指标呈剂量依赖性。见表3。

表3 5组大鼠HB-EGF mRNA、AngⅡ mRNA比较
2.5 5组大鼠血管组织中HB-EGF、AngⅡ、Cx43蛋白相对表达水平检测结果 与假手术组比较,模型组大鼠血管组织HB-EGF、AngⅡ、Cx43蛋白表达均显著升高(P<0.05);与模型组比较,LMWH低、中、高剂量组大鼠血管组织血管组织HB-EGF、AngⅡ、Cx43均显著降低(P<0.05),且LMWH 3个剂量组上述指标呈剂量依赖性。见图3,表4。

图3 5组大鼠血管组织HB-EGF、AngⅡ、Cx43蛋白表达免疫印记图;A 假手术组;B 模型组;C LMWH低剂量组;D LMWH中剂量组;E:LMWH高剂量组

表4 5组大鼠血管组织中织HB-EGF、AngⅡ、Cx43蛋白表达水平
3 讨论
PCI术的是治疗冠心病的主要有效手段之一,而PCI术后支架内再狭窄病变的发生率相对较高,是导致不良心血管事件发生率较高的主要原因之一[13]。血管内膜炎性细胞浸润、内皮细胞增生、VSMC从中膜迁移至内膜而导致内膜增厚,是管腔狭窄的主要原因,而抑制血管内膜增厚、防止血管再狭窄是心血管病的研究热点之一[14]。大鼠颈动脉球囊损伤术可造成血管管腔狭窄、内膜增厚,陈文明等[11]研究发现,大鼠颈动脉球囊损伤术后14 d可造成大鼠血管管腔狭窄、血管新生内膜面积增大;尉希清等[15]发现大鼠球囊损伤后24 h可引起VSMC增殖、迁移,14 d后内膜增生达到最高峰。本研究建立大鼠颈动脉球囊损伤术模型后发现,与假手术组相比,模型组大鼠颈动脉内皮剥落、有新生内膜形成,血管管腔呈向心、偏心性狭窄,且血管内膜面积、内膜/中膜面积(IA/MA)、血管组织中炎性因子IL-6、TNF-α均增高,管腔面积减小,提示Model 组大鼠血管组织出现血管内膜增厚和炎性反应,表明造模成功。
目前临床上用于PCI 术的药物如雷帕霉素、紫杉醇等,可阻止损伤部位 VSMC增殖。但由于上述药物在阻止VSMC 增殖迁移的同时,也会干预损伤动脉血管再内皮化的进程,引起迟发性再狭窄、迟发性血栓形成,增加PCI术后心血管不良事件的发生[16]。因此寻找有效、安全的防治血管再狭窄药物,具有重要的研究意义。LMWH对血管内膜增生具有抑制作用,孙夫强等[17]发现LMWH可抑制急性肺栓塞大鼠肺动脉内膜增殖。高志伟等[18]发现LMWH可抑制兔VSMC增殖。本研究发现,与模型组比较,LMWH低、中、高剂量组大鼠颈动脉内皮剥落、内膜增生、狭窄等病理损伤现象减小,且血管内膜面积、内膜/中膜面积(IA/MA)、血管组织中炎性因子IL-6、TNF-α均降低,管腔面积增大,表明LMWH可抑制颈动脉球囊损伤模型大鼠血管内膜增厚,但具体分子机制还不甚明确。
正常生理状态下,位于动脉中层的VSMC,可收缩血管、维持血管弹性,AngⅡ可诱导VSMC增殖和迁移。Zhang等[19]发现在病理诱导下,VSMC会异常增殖、迁移,并推测AngⅡ可能通过调节细胞周期因子,促进Cx43表达,而促进VSMC异常增殖、迁移。张坤等[20]发现杜鹃素可抑制Cx43表达,抑制AngⅡ诱导的VSMC增殖。本研究发现,与假手术组相比,模型组大鼠血管内膜组织中AngⅡ mRNA及蛋白、Cx43蛋白表达增高,提示VSMC增殖、迁移可能与血管内膜组织中AngⅡ、Cx43高表达有关。HB-EGF可促进细胞增殖、侵袭和迁移,与动脉粥样硬化形成有关,Jiang等[21]发现在PCI术后冠脉再狭窄患者血清和血管组织中,HB-EGF基因及蛋白表达水平均高于正常患者,并推测HB-EGF 可能促进支架内的内膜增殖及血管重构,促进血管狭窄,是PCI冠脉再狭窄的危险因素之一;然而Rattik等[22]对384例发生急性冠状动脉事件的患者血浆和组织中HB-EGF 水平进行检测,发现其表达低于正常对照组,并推测HB-EGF 可能通过促进斑块稳固来减少急性冠状动脉事件的发生,HB-EGF可能是心血管疾病发生的一个保护因素。而本研究发现,模型组大鼠颈动脉血管组织中HB-EGF蛋白表达均高于假手术组,与Jiang等[21]研究一致,表明HB-EGF异常高表达可能促进内膜增殖、血管狭窄的发展。与模型组比较,LMWH低、中、高剂量组大鼠颈动脉血管组织中AngⅡ mRNA及蛋白、HB-EGF mRNA及蛋白、Cx43蛋白表达均降低,且各剂量组呈剂量依赖性。表明LMWH抑制颈动脉球囊损伤模型大鼠血管内膜增厚作用,可能与抑制AngⅡ、Cx43、HB-EGF 表达有关。
综上所述,LMWH可抑制颈动脉球囊损伤模型大鼠颈动脉血管组织AngⅡ、HB-EGF基因及蛋白表达,抑制血管内膜增生。为临床治疗颈动脉球囊损伤及PCI术后冠脉再狭窄,阐明LMWH可能存在的新的分子药理机制,提供一定的参考。但本研究也存在一定的不足,血管内膜增生及狭窄分子机制水分复杂,AngⅡ、HB-EGF参与血管内膜增生的靶标分子还不明确,这有待后续继续研究。
