柚皮苷中药单体调节miR-216a基因对结直肠癌细胞增殖和凋亡的影响研究
2021-08-26李永慧王倩林贾笑强刘明成李永芳
李永慧 王倩林 贾笑强 刘明成 李永芳
结直肠癌是常见的恶性肿瘤之一,近年我国结直肠癌发病率和死亡率呈上升趋势,严重危害人们生命健康[1]。目前结直肠癌的治疗方法是手术、放化疗及靶向治疗的综合治疗,患者预后有显著改善,但对于存在局部复发或远处转移的晚期结直肠癌患者,预后仍然很差[2]。因此,寻找有效的结直肠癌治疗方法尤为重要。微小RNA(microRNA,miRNA)是一种单链小分子RNA,长度约19~22nt,在生物体基因组广泛存在,通常在转录后水平调控基因表达,在细胞增殖、凋亡、肿瘤发生等过程中发挥重要作用[3,4]。miR-216a是miRNA家族成员,有研究显示,结直肠癌中miR-216a表达降低,miR-216a-3p可直接靶向COX-2和ALOX5抑制结直肠癌细胞增殖[5]。柚皮苷是一种主要存在于葡萄柚、柚子、酸橙等果皮和果肉中的天然黄酮类化合物,有抗氧化应激、降血糖、抗炎、抗肿瘤等广泛的生物学活性[6-8]。有研究显示,柚皮苷对前列腺癌、卵巢癌等多种肿瘤细胞生长有抑制作用[9,10]。结直肠癌中柚皮苷的研究较少,有研究显示,在化疗模型小鼠中,柚皮苷可降低结直肠癌癌前病变及结直肠癌重构[11];柚皮苷可防治偶氮甲烷/葡聚糖硫酸钠诱发的小鼠慢性结直肠炎及癌变[12]。柚皮苷对人结直肠癌细胞生长影响及机制尚未明确。有研究显示,柚皮苷可调控miR126/VCAM1抑制非小细胞肺癌生长[13]。因此,本研究旨在柚皮苷是否可调节miR-216a影响结直肠癌细胞增殖和凋亡,以期为结直肠癌治疗提供理论依据。
1 材料与方法
1.1 主要试剂与仪器 柚皮苷购自中国药品生物制品检定所;RPMI 1640培养基和青链霉素均购自美国Gibao公司;胎牛血清购自杭州四季青公司;总RNA提取试剂盒、BCA蛋白浓度测定试剂盒、细胞裂解液、ECL发光液及细胞凋亡试剂盒均购自中国碧云天;KIAA1199抗体购自美国Abcam公司;脂质体2000试剂均购自美国Invitrogen公司;MTT、DMSO均购自美国Sigma公司;双荧光素酶报告基因检测试剂盒购自美国Promega公司;酶标仪购自美国Bio-Rad公司;流式细胞仪购自美国BD公司。
1.2 细胞培养 结直肠癌细胞系SW620、LOVO和HCT116及正常结肠上皮细胞NCM460均购自美国ATCC。使用含10%胎牛血清的RPMI 1640培养基,置于5%体积分数CO2、37℃培养箱培养细胞。每天换液1次。细胞达80%~90%生长密度时进行传代。实验为生长至对数期的细胞。
1.3 qRT-PCR检测结直肠癌细胞miR-216a和KIAA1199基因表达 按照总RNA提取试剂盒说明提取细胞总RNA,紫外分光光度计检测RNA在260/280吸光度值(OD),将OD值在1.8~2.0的RNA逆转录为cDNA。依据引物设计原则设计miR-216a和KIAA1199引物,由上海吉玛制药技术有限公司合成,所有引物序列如下:miR-216a F 5’-ACACTCCAGCTGGGCATTATTACTTTTGG-3’,R 5’-TGGTGTCGTGGAGTJP2CG-3’;U6 F 5’-ATTGGAACGATACAGAGAAGATT-3’,R 5’-TGGTGAAGACGCCAGTGGA-3’;KIAA1199 F 5’-TGCCACGGTCTATTCCATC-3’,5’-TCCTTTACCAACCCCAATG-3’;GAPDH F 5’-GAAGGTGAAGGTCGGAGTC-3’,R 5’-GAAGATGGTGATGGGATTTC-3’;以cDNA产物为模板,参照qRT`-PCR试剂盒说明配置20 μl PCR反应体系及设置反应条件,设置5个复孔。反应结束后,根据所得Ct均值,以U6或GAPDH作为内参基因,采用2-ΔΔCt法计算miR-216a基因和KIAA1199基因的相对表达水平。实验重复3次。
1.4 Western blotting检测KIAA1199表达 细胞中加适量裂解液,4℃反应30 min后,离心,移液器吸取管内上清液,上清即为提取总蛋白。BCA法定量蛋白。按照1∶4比例将总蛋白及上样缓冲液混匀,100℃沸水变性5 min。每孔40 μg变性蛋白,经SDS-PAGE电泳、电转PVDF膜后,将转移完成的膜置于TBST中漂洗1次,然后使用5 %的BSA封闭液在室温条件下封闭膜2 h,TBST洗膜。加1∶1 000稀释的KIAA1199抗体,4℃孵育过夜,TBST洗膜。加1∶2 000稀释的辣根过氧化酶标记的二抗,37℃孵育2 h。膜含蛋白一侧滴加ECL显色液,放入成像仪内进行曝光处理,成像并保存图片。Image J软件分析灰度值,以GAPDH作为内参,得出KIAA1199的相关表达水平。
1.5 细胞转染 以1×106个/孔接种SW620细胞于6孔板,每孔2 ml,24 h后细胞达60%~70%生长密度时即可进行转染。转染前2 h换液,在1.5 ml无菌管中配置A液:脂质体2 000与无血清及无双抗的混合液,体积为250 μl;B液:miR-216a mimics及mimics对照(miR-NC)、miR-216a inhibitor及对照(anti-miR-NC)、KIAA1199过表达载体(KIAA1199组)及空载体(pcDNA3.1组)与脂质体2000混合液,体积为250 μl。将A液和B液在室温条件下放置5 min,轻柔混匀,室温放置20 min。将复合物加入6孔板中,继续培养4~6 h,换成含血清的完全培养基,继续培养,用于后续实验研究。
1.6 MTT检测细胞增殖 以5 000个/孔接种对数生长期的SW620细胞于96孔板,常规培养24 h后,使用0.4 mmol/L、0.8 mmol/L和1.6 mmol/L柚皮苷处理细胞,miR-216a mimics及miR-NC转染细胞,每组设置5个平行孔。分别在处理的24 h、48 h和72 h收集细胞,每孔加5 mg/ml的MTT试剂20 μl,常规孵育4 h,吸去细胞培养液,每孔加150 μl DMSO,将细胞培养板放置于振荡器上震荡5 min。结晶溶解充分后,酶标仪测定490 nm波长下各组细胞光密度值(OD值)。实验重复3次。
1.7 Annexin V-FITC/PI双染法检测细胞凋亡率 收集使用0.4 mmol/L、0.8 mmol/L和1.6 mmol/L的柚皮苷及miR-216a mimics处理48 h的SW620细胞,胰酶消化细胞,制备成单细胞悬液。预冷PBS洗涤细胞2次,加250 μl的binding buffer重悬细胞,并将细胞浓度调整为1×106/ml。取100 μl细胞悬液于流式管中,加入5 μl Annexin V-FITC溶液,室温避光静置15 min,然后加10 μl PI溶液,室温避光静置5 min。细胞充分染色后,再加入300 μl的binding buffer溶液,1 h内通过流式细胞仪检测。实验重复3次。
1.8 双荧光素酶报告基因实验 在线生物信息学预测工具显示,miR-216a的5’UTR与KIAA1199 的3’UTR有连续的结合位点。依据结合位点信息构建野生型KIAA1199 3’UTR报告载体(KIAA1199-WT),其后以KIAA1199-WT为模板对其结合位点进行突变,得到突变型KIAA1199 3’UTR报告载体(KIAA1199-MUT)。将KIAA1199-WT及KIAA1199-MUT分别与miR-216a mimics共转染至SW620细胞,转染48 h,使用双荧光素酶报告基因测定试剂盒检测各组细胞的荧光素酶活力。实验重复3次。
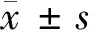
2 结果
2.1 不同结直肠癌细胞miR-216a基因和KIAA1199基因表达 以正常结肠上皮细胞NCM460为对照,qRT-PCR检测三株结直肠癌细胞(SW620、LOVO和HCT116)miR-216a和KIAA1199基因mRNA表达,Western blotting检测KIAA1199蛋白表达,与NCM460细胞miR-216a和KIAA1199表达比较,三株结直肠癌细胞miR-216a基因表达明显降低,KIAA1199基因mRNA及蛋白表达均明显升高(P<0.05)。选择SW620细胞作为研究对象。见图1,表1。
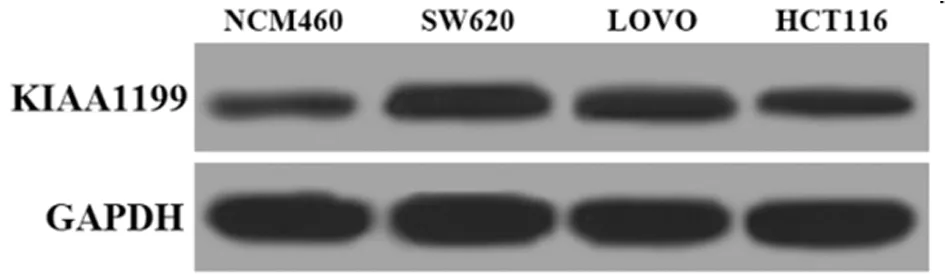
图1 Western blotting检测结直肠癌细胞KIAA1199蛋白表达
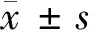
表1 miR-216a和KIAA1199在结直肠癌细胞中的表达
2.2 miR-216a和KIAA1199靶向关系验证 生物信息学软件显示miR-216a序列与KIAA1199 3’UTR区存在连续的结合位点。将构建的KIAA1199-WT质粒和KIAA1199-MUT质粒与miR-216a mimics共转染至SW620细胞,进行双荧光素酶报告基因实验,miR-216a mimics与KIAA1199-WT共转染较其余3组(miR-NC与KIAA1199-WT组、miR-NC与KIAA1199-MUT组、miR-216a mimics与KIAA1199-MUT组)荧光素酶活性明显降低(P<0.05),其余3组荧光素酶活性差异无统计学意义(P>0.05)。提示miR-216a与KIAA1199存在靶向关系。进一步证实miR-216a对KIAA1199表达的影响,通过qRT-PCR将miR-216a mimics/inhibittor转染SW620细胞后KIAA1199基因表达,转染miR-216a mimics的SW620细胞KIAA1199基因mRNA及蛋白表达均明显降低,转染miR-216a inhibittor的SW620细胞KIAA1199基因mRNA及蛋白表达均明显升高(P<0.05)。说明miR-216a与KIAA1199存在靶向关系,miR-216a可负向调控KIAA1199的表达。见图2,表2、3。
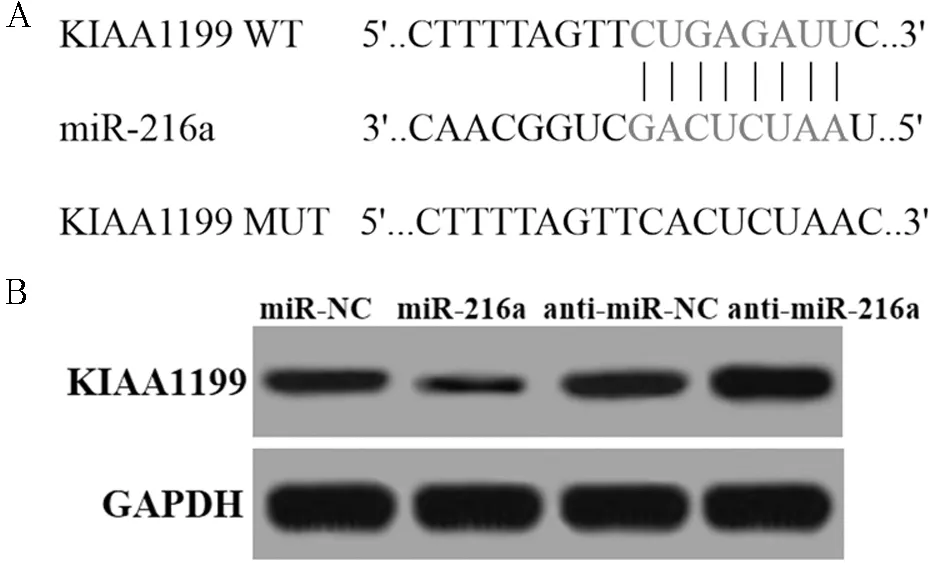
图2 miR-216a与KIAA1199 3’UTR结合位点及转染miR-216a mimics/inhibittor的SW620细胞KIAA1199蛋白表达
表2 双荧光素酶报告基因检测miR-216a和KIAA1199的靶向关系
表3 SW620细胞转染miR-216a mimics/inhibittor后KIAA1199 mRNA及蛋白表达
2.3 miR-216a靶向KIAA1199基因对SW620细胞增殖凋亡的影响 将miR-216a mimics及miR-216a mimics和KIAA1199过表达载体转染SW620细胞,细胞增殖及凋亡检测结果,与miR-NC组比较,miR-216a组和miR-216a+pcDNA3.1组细胞活力明显降低,细胞凋亡率明显升高(P<0.05)。miR-216a组和miR-216a+pcDNA3.1组细胞活力及凋亡率差异无统计学意义(P>0.05)。与miR-216a+pcDNA3.1组比较,miR-216a+KIAA1199组细胞活力明显升高,细胞凋亡率明显降低(P<0.05)。见图3,表4。

图3 miR-216a 靶向KIAA1199对SW620细胞凋亡的影响
表4 miR-216a 靶向KIAA1199对SW620细胞增殖、凋亡的影响
2.4 柚皮苷对SW620细胞增殖凋亡的影响 MTT结果显示,0.4 mmol/L、0.8 mmol/L和1.6 mmol/L的柚皮苷处理SW620细胞后,细胞活力明显降低,呈现剂量和时间依赖性(P<0.05)。流式细胞术检测结果显示,0.4 mmol/L、0.8 mmol/L和1.6 mmol/L的柚皮苷处理SW620细胞48 h,细胞凋亡率明显升高,呈剂量依赖性(P<0.05)。见图4,表5。
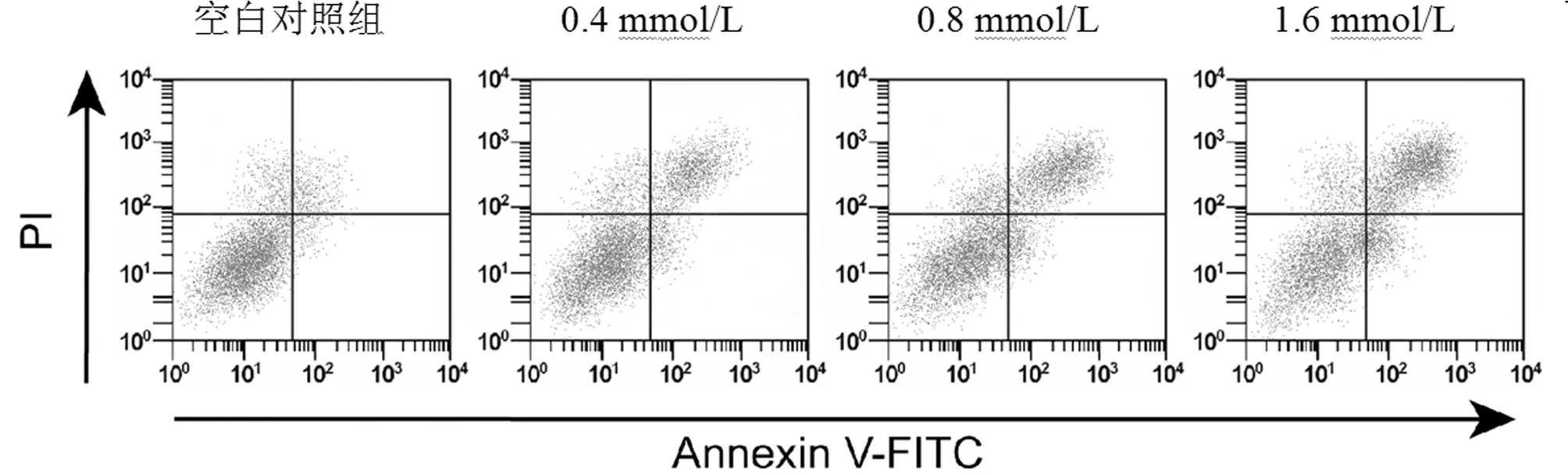
图4 不同浓度柚皮苷对SW620细胞凋亡的影响
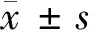
表5 不同浓度柚皮苷对SW620细胞增殖凋亡的影响
2.5 柚皮苷对miR-216a和KIAA1199基因表达的影响 qRT-PCR结果显示,0.4 mmol/L、0.8 mmol/L和1.6 mmol/L的柚皮苷处理SW620细胞48 h,miR-216a 基因mRNA表达明显升高,KIAA1199基因mRNA表达及蛋白表达均明显降低,呈剂量依赖性(P<0.05)。见表6,图5。
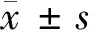
表6 不同浓度柚皮苷对SW620细胞miR-216a和KIAA1199基因mRNA表达的影响
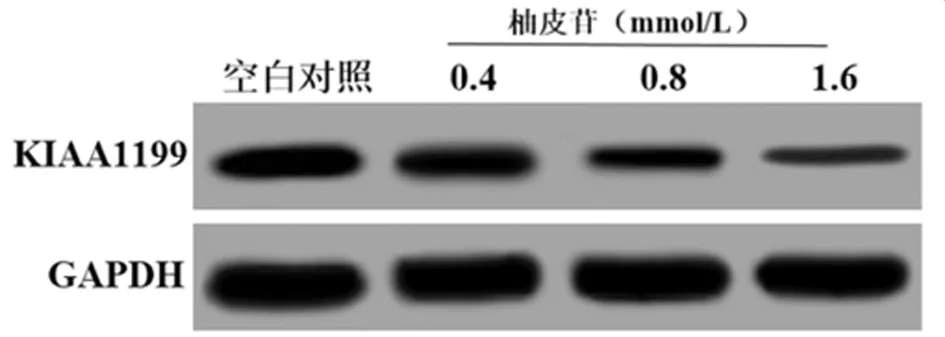
图5 Western blotting检测柚皮苷对SW620细胞KIAA1199蛋白表达的影响
3 讨论
miRNA是一种小分子非编码RNA,可通过与靶mRNA特异性结合,降解靶基因mRNA或抑制其靶蛋白合成,从而影响细胞增殖、凋亡、肿瘤发生等过程[14]。结直肠癌变、侵袭转移、耐药等多个方面,均与miRNA异常表达有关,miRNA参与了结直肠癌发生发展的全过程[15]。寻找影响结直肠癌发生发展的miRNA及相应的致癌或抑癌靶基因对于其诊疗具有重要意义。既往研究发现,miR-216a在胰腺癌、胃癌、肾癌等多种肿瘤细胞中异常表达,其异常表达可促进肿瘤进展[16-18]。本研究检测了三株结直肠癌细胞(SW620、LOVO和HCT116)中miR-216a基因表达,发现SW620细胞中miR-216a表达最低,因此作为研究对象。过表达miR-216a可明显抑制SW620细胞增殖,促进细胞凋亡。提示miR-216a与结直肠癌生长抑制有关。有研究显示,miR-216a可通过调节KIAA1199/CEMIP抑制结直肠癌细胞侵袭和转移[19]。KIAA1199是HUGA蛋白质数据库中KIAA家族成员之一,近年来大量研究表明,KIAA1199可影响多种肿瘤细胞增殖、侵袭迁移、粘附等过程,与肿瘤发生发展密切相关。Xu等[20]研究显示,KIAA1199高表达与结直肠癌侵袭、TNM分期及预后不良有关;Zhao等[21]研究显示,KIAA1199可通过PP2A/stathmin促进结直肠癌细胞转移。本研究使用靶基因预测软件及双荧光素酶报告基因实验证实KIAA1199是miR-216a的靶基因,进一步通过miR-216a mimics/inhibitor证实KIAA1199受miR-216a的调控。将miR-216a mimics与KIAA1199过表达载体共转染至SW620细胞,发现过表达KIAA1199可明显减弱miR-216a mimics对SW620细胞增殖、凋亡的影响。提示miR-216a可靶向抑制KIAA1199降低结直肠癌细胞增殖,促进细胞凋亡。
多项研究指出,柚皮苷有较强的抗癌作用,如Aroui等[22]研究显示,柚皮苷可通过下调MMP-2、MMP-9的表达及p38信号通路抑制胶质母细胞瘤细胞的侵袭和迁移;Raha等[23]研究显示,柚皮苷通过激活MAPK途径及下调PI3K/Akt/mTOR途径诱导自噬介导的胃癌 AGS细胞生长抑制。本研究首先检测不同浓度柚皮苷对SW620细胞活力及凋亡的影响,发现柚皮苷可明显抑制结直肠癌细胞增殖,促进细胞凋亡,这与在其他肿瘤中研究结果一致。通过qRT-PCR检测柚皮苷对miR-216a和KIAA1199表达的影响,发现不同浓度柚皮苷均可上调miR-216a表达,下调KIAA1199表达。有研究显示,柚皮苷可通过调节miR-19b促进肝癌细胞凋亡[24]。本研究结果提示柚皮苷可能通过调节miR-216a/KIAA1199影响结直肠癌细胞增殖和凋亡。
综上所述,结直肠癌细胞miR-216a低表达,KIAA1199高表达,miR-216a可通过靶向抑制KIAA1199降低结直肠癌细胞增殖和促进细胞凋亡。柚皮苷可抑制结直肠癌细胞增殖,促进细胞凋亡,且可上调miR-216a表达和下调KIAA1199表达。提示柚皮苷可能通过引起miR-216a表达水平改变进而调控KIAA1199表达,从而影响结直肠癌细胞增殖和凋亡。本研究可能为柚皮苷在结直肠癌治疗及研究中提供了理论基础。
