通过组织培养快速繁殖金钱木的研究*
2021-08-26刘雅鑫葛富月李婧璐刘柏玲
刘雅鑫,葛富月,李婧璐,刘柏玲
(曲阜师范大学生命科学学院,273165,山东省曲阜市)
0 引 言
金钱木(Portulacamolokiniensis),别称圆贝马齿苋、云叶、金铖木,为马齿苋科(Portulacaceae)马齿苋属(Portulaca)的多年生常绿草本,因肥厚的叶片排列整齐形似铜钱而得名,是近年来流行的室内观叶植物.金钱木高12~35 cm,主茎直立,呈圆柱形,具分支.叶交互对生,无柄或近无柄,肉质,长圆形或倒卵形,沿茎的顶端部分簇生排列成4个覆瓦状,下部叶随着植株的生长逐渐凋落,上部叶常聚生成总苞状.头状花序,黄色,清晨开放,夜晚即闭合[1].金钱木具有较高的观赏价值和经济效益,目前金钱木的生产繁殖方式主要是分株和扦插,有较大的局限性,限制了其产业的发展.植物组织培养技术不受季节和环境的限制,可以克服传统技术繁殖的缺点,是快速繁殖植物的简便可靠方法[2-4].据我们所知,目前尚未发现有关金钱木快速繁殖方法的报道.因此我们根据同属植物马齿苋(portulacaoleracea)组织培养的研究,开展金钱木的组织培养快速繁殖试验.本研究以金钱木的叶片为外植体,在MS培养基中添加不同浓度和不同种类的植物激素研究其对金钱木叶片诱导和增殖效果的影响,探索出最佳培养基配方,建立了金钱木快速繁殖的组织培养体系,为其工厂化生产提供了技术参考,有利于金钱木的便捷高效生产.
1 材料与方法
1.1 试验材料
供试材料购自杭州丹诺园艺有限公司,种植于曲阜师范大学生命科学学院温室,以健康金钱木叶片为外植体,MS(Murashige and Skoog)为基本培养基进行试验.
1.2 试验方法
1.2.1 选材与消毒
从金钱木植株上选取生长状态良好、肉质化程度高的叶片为外植体.为除去叶片表面灰尘,加洗洁精清洗之后在缓水下冲洗30 min后放入已灭菌的空瓶中.在超净工作台中用70%酒精消毒30 s后用无菌水冲洗2~3次.之后再用0.1%升汞(HgCl2)溶液消毒5 min(加入1~2滴吐温使消毒更充分),期间不停地摇晃,最后用无菌水冲洗3~5次,每次1 min.将消毒后的叶片置于无菌滤纸上吸去多余的水分,之后用解剖刀切成约1 cm2大小,备用.
1.2.2 不定芽诱导培养
将切好的外植体接种至添加不同细胞分裂素6-BA(6-benzylaminopurine,苄胺基嘌呤)、KT(kinetin,激动素)和TDZ(thidiazuron,苯基噻二唑基脲)的MS基本培养基中诱导不定芽的产生(表1).28 d后统计诱导的不定芽数量和不定芽诱导率.
不定芽诱导率=(产生不定芽的外植体数/接种外植体数)×100%.
1.2.3 不定芽增殖培养
选取初代培养生长状态良好的不定芽,切下后接种到含有不同浓度的6-BA和NAA(naphthaleneacetic acid,萘乙酸)组合的MS培养基中(表2),探究不同激素浓度组合对金钱木不定芽增殖的影响.第7 d统计不定芽的数目、增殖系数(倍)和玻璃化率.
不定芽增殖系数=产生的不定芽数目/接种的不定芽数目.
玻璃化率=(不定芽发生玻璃化数目/产生的不定芽数目)×100%.
1.2.4 不定芽生根培养
选取增殖培养中生长状态一致的不定芽置于不同的生根培养基中(表3),探究不同浓度的NAA、IBA(indole-butyric acid吲哚丁酸)、IAA(indole-3-acetic acid 吲哚乙酸)对金钱木不定芽生根的影响.第21 d统计生根的数目、根长、生根率以及植株高度.
试管苗生根率=(生根试管苗数/接种试管苗数)×100%.
1.2.5 炼苗与移栽
选择根系良好、生长健壮的金钱木幼苗,打开瓶盖炼苗.第4天,取出瓶里的无菌苗,用清水洗净根部粘附的培养基,于通风处晾干.将幼苗移入混有蛭石(营养土∶蛭石=1∶1)的土壤中.一个月后统计成活率.
成活率=(成活的植株数/移栽的植株数)×100%.
1.2.6 培养条件
选用MS为基本培养基,每升培养基中添加30 g蔗糖,6.5 g琼脂,加入不同种类和不同浓度的激素,将pH调至5.8~6.0,分装后,高压灭菌(1.1 Mpa,121 ℃)15 min.外植体接种后均置于培养温度为251±1 ℃,光照12 h/d,光照强度为1 500~2 000 lx的培养室中培养.
1.2.7 数据分析
每瓶培养基中接种3个外植体,每处理5瓶,重复3次.利用SPSS 17.0进行方差分析和Duncan检验.
2 结果与分析
2.1 不同细胞分裂素对金钱木诱导不定芽的影响
为诱导金钱木的叶片形成愈伤组织进而诱导不定芽,在MS培养基中分别添加不同浓度的6-BA、KT和TDZ(表1).结果表明,外植体切口处在第7 d开始出现愈伤组织,体积变大并增厚(图1A).第14 d左右,愈伤组织上长出不定芽,极少数的不定芽直接在外植体上诱导出来,不定芽刚开始为嫩黄色,此后迅速生长增大转变为绿色(图1B).在不添加任何细胞分裂素时,不能诱导出愈伤组织和不定芽,而细胞分裂素6-BA在诱导金钱木愈伤组织形成的过程中起关键作用.在含有6-BA的MS培养基中,产生了较多的愈伤组织且诱导出不定芽,各个处理的愈伤组织较大,诱导出的不定芽数量较多,叶片较大.在含有0.5 mg/L 6-BA的MS培养基中,诱导的不定芽数量最多,为5.8个;6-BA为0.5 mg/L和 1 mg/L的MS培养基中,不定芽诱导率分别达到了93.3%和95.6%.因此,诱导金钱木不定芽产生的最适培养基为MS + 6-BA 1.0 mg/L. KT和TDZ不利于愈伤组织的形成,不能或只能少量诱导出不定芽.

表1 不同细胞分裂素对金钱木不定芽诱导的影响
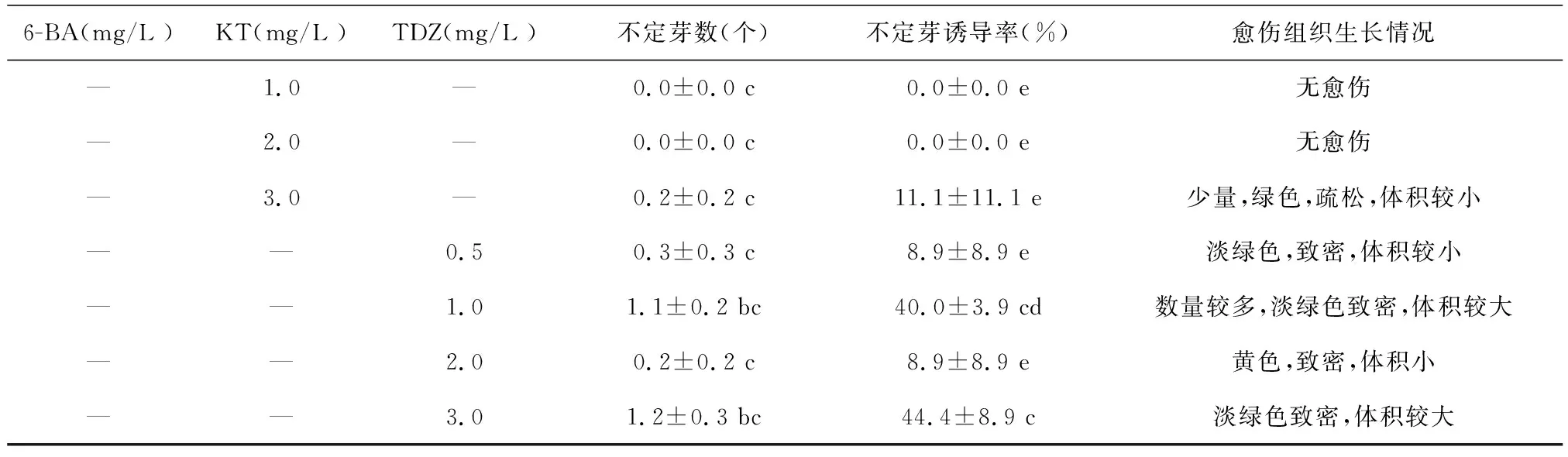
续表
2.2 不同浓度组合的6-BA和NAA对金钱木不定芽增殖的影响
将生长状况良好的不定芽分别接种在不同浓度的6-BA和NAA培养基中对不定芽进行增殖培养(表2).结果表明,细胞分裂素6-BA浓度为0.5 mg/L时,组培苗的玻璃化现象较严重,随着NAA浓度的增加,不定芽增殖系数逐渐降低.当6-BA浓度较高(1 mg/L)时,不定芽生长情况随时间的延长出现明显分化,由1个芽分化形成多个不定芽(图1C).当6-BA浓度为1.0 mg/L,NAA浓度为0.1 mg/L和0.3 mg/L时不定芽增殖率基本相同,而 NAA浓度为0.1 mg/L时,不定芽的叶片较大,不定芽玻璃化程度较低.综上所述,金钱木不定芽增殖最适培养基为MS+1.0 mg/L 6-BA+0.1 mg/L NAA.
2.3 不同浓度的生长素对金钱木不定芽生根的影响
将生长状况一致的不定芽接种至含有不同浓度的NAA、IBA以及IAA的生根培养基中,观察并分析其对金钱木不定芽生根的影响(表3).结果表明,第7 d开始出现不定根,第14 d时,大部分不定芽已长出根,第21 d时,大部分植株的根出现了缠绕,根的数量明显增加(图1D,E).当IBA浓度为0.1 mg/L时,不定芽生根率最高,根最长,植株高度最高.NAA浓度为0.5 mg/L时,植株的根数最多,但很细.综上所述,诱导金钱木不定芽生根的最佳培养基为 1/2MS+0.1 mg/L IBA.

续表
2.4 炼苗与移栽
选取生根状态良好的植株炼苗3 d,然后取出植株,根部培养基冲洗干净后移入混合蛭石的土壤中.每天光照12 h,温度维持在25 ℃左右,罩上透明盖子保湿,一个月后统计植株存活率达90.0%以上(图1F).

图1 金钱木组织培养过程
3 讨 论
3.1 植物生长调节剂对金钱木不定芽诱导、增殖和生根的影响
植物生长调节剂是组织培养中调控植物生长分化的关键因素,培养基中不同的生长调节剂种类和浓度影响器官分化的过程[2-5].金钱木的叶片外植体在不添加任何细胞分裂素时不能形成愈伤组织和不定芽,而不同的细胞分裂素对金钱木不定芽的诱导和增殖效果不同,在含有6-BA的MS培养基中产生了较多的愈伤组织并诱导出不定芽,每个处理的愈伤组织均较大,诱导出的不定芽数量均较多,说明6-BA的诱导效果最好,这与李焘[6]、黄红梅[7]等在马齿苋(Portulacaoleracea)组织培养的研究结果一致,也与Liu等人在丹参(salviamiltiorrhiza)愈伤组织诱导的研究结果一致,即与TDZ和KT相比6-BA(1.0 mg/L)的诱导效果最好[8].本研究结果表明,高浓度的6-BA对愈伤组织的形成有抑制作用,与Liu等利用6-BA诱导丹参愈伤组织的影响一致[8],这可能是6-BA的代谢活动诱导了植物组织中其他内源激素的反应[9].在培养基中添加细胞分裂素TDZ时,外植体的不定芽诱导率和不定芽数均较低,而添加低浓度的KT时,不能形成愈伤组织和不定芽,表明KT对金钱木外植体诱导不定芽的产生没有效果.在金钱木不定芽增殖培养中,在含有6-BA的培养基中添加生长素NAA,结果表明在细胞分裂素和生长素的相对浓度较高的情况下,不定芽的增殖率较高,这与Sivanesan等在瓜叶菊(Seneciocruentus)中的研究结果一致[10],即在含有细胞分裂素的培养基中添加一定量的生长素可以促进不定芽的形成.健壮生长的不定芽在MS基本培养基中时,增殖率很低,并且出现玻璃化现象,表明植物生长调节剂是金钱木不定芽增殖所必需的.
一般情况下只用生长素处理就能诱导生根[11].在人参(Panaxginseng)组织培养的生根诱导阶段,Kim等人证明IBA的效果比NAA更有效[12].本试验在1/2MS培养基中添加NAA、IBA和IAA三种生长素,其中IBA更有利于金钱木的不定芽诱导出不定根(图1E),不定芽生根率最高达88.9%,这与黄策群[7]、黄红梅[13]等在马齿苋组织培养的研究结果一致,说明生长素IBA是诱导金钱木不定芽生根的有效植物生长调节剂.
3.2 金钱木组织培养过程中玻璃化和褐化对其生长的影响
在金钱木的不定芽增殖培养中,不定芽发生玻璃化较普遍.玻璃化导致组培苗形态异常,使叶片呈透明化状态[14,15].玻璃化的发生受多种因素的影响,比如外植体的类型;组培环境的通风条件、光照、温度;培养基的成分;组培苗自身发育的影响等[16-18].金钱木不定芽玻璃化可能是由于培养基的水分含量较高、培养基的成分以及不定芽的内部激素含量不均匀等因素造成的.因此,适当提高培养基中琼脂的浓度、增加自然光照、控制光照时间、改善培养基的成分可减少玻璃化苗的产生.在后续的研究中可进行不同温度对金钱木组织培养过程中玻璃化的试验,探索出最适宜的培养温度从而提高生产效率.
在金钱木的继代培养过程中会有褐化现象的产生,第14 d就能观察到部分不定芽的顶部变黄,第30 d时,不定芽由最初的鲜绿色变为暗黄色,最后变黑枯死.褐变主要是由于组培苗酚类物质含量的不同和多酚氧化酶活性的差异造成的[19,20].褐化也与外植体类型、培养基成分和培养条件等因素有关[15].刘淑兰等对核桃(Juglansregia)的试验证明,不同季节、不同树龄的外植体,褐化发生的情况不同,通常幼龄外植体比老龄外植体褐化轻、褐化率低[21].在金钱木的组织培养试验时尽量选择幼嫩的叶片,以降低组培苗的褐化程度.在金钱木不定芽诱导第14 d左右即进行不定芽增殖试验,防止不定芽褐化影响不定芽增殖培养.另外,也可以通过在培养基中添加褐变抑制剂和吸附剂,多次转移等方式降低褐化现象的发生[20].如何减少金钱木组织培养过程中玻璃化和褐化的产生还有待进一步的研究.
总之,在金钱木苗木繁殖中采用组培快繁技术,可以避免地理环境、季节和母本数量的限制,并且在较短时间内快速繁殖这种经济价值较高的植物.本研究结果为利用组培方法大量繁殖金钱木的工厂化生产具有一定的指导意义.
