高密度脂蛋白对腹膜透析患者临床转归的影响
2021-08-25莫曼秋潘玲杨桢华覃康娜张霁亮廖蕴华霍冬梅
莫曼秋 潘玲 杨桢华 覃康娜 张霁亮 廖蕴华 霍冬梅
广西医科大学第一附属医院肾内科(南宁530021)
持续性不卧床腹膜透析(CAPD)是终末期肾病患者(ESRD)的有效替代治疗方法之一,因其在保持残余肾功能及可居家透析等方面的优势,且近年来随着CAPD 技术不断改进,已被越来越多的患者所接受。根据《全国医疗体系服务质量安全报告》,2017年中国全国肾脏数据系统报告的腹膜透析(PD)患者共有86 264 例,并呈逐年增长趋势[1]。尽管PD 的技术水平在不断提升,但目前总体上PD 的长程技术生存率仍偏低,有统计报道PD 龄超过5年的患者仅占PD 总人数的26.2%[2⁃3],较多患者在PD 治疗一段时间后因各种并发症、技术问题或疗效不佳等原因而被迫退出PD。
心血管疾病(CVD)是PD 患者最常见的并发症和死亡原因,严重影响PD 患者的临床转归和生存率[4]。血脂异常已被证实是CVD 的独立危险因素[5],也是ESRD 患者常见表现,研究显示ESRD 患者的血脂异常患病率常高达60%[6],故血脂异常也被发现是PD 患者发生CVD 的重要危险因素[7]。高密度脂蛋白(HDL)是血脂指标之一,既往研究多认为HDL 是CVD 的保护因素,具体HDL水平对PD 患者预后的影响尚不明确。本文拟对我院规律随访的CAPD 患者的临床资料进行分析,旨在探讨HDL 水平与PD 患者临床转归的相关性,以期为临床上改善PD 患者预后,减少PD 退出率提供一定的指导意见。
1 资料与方法
1.1 研究对象 研究对象来自2010年1月至2020年1月在广西医科大学第一附属医院腹膜透析中心规律接受CAPD 治疗的ESRD 患者。排除标准:(1)年龄< 18 岁;(2)严重感染、恶性肿瘤;(3)透析龄小于3 个月;(4)转肾移植或放弃治疗;(5)由血液透析和肾移植转入或联合血液透析的患者。本研究经广西医科大学第一附属医院伦理委员会审核批准(2019KY⁃E⁃051)。
1.2 资料收集 收集患者PD 置管后1 个月首次接受腹膜平衡试验时的临床资料作为基线资料,包括性别、年龄、身高、体质量、血压、血尿常规、肝肾功能、血脂等基线实验指标;记录PD 相关指标:置管日期、腹膜平衡试验和透析充分性指标;记录既往基础病情况。
1.3 分组及研究方法 采用回顾性队列研究方法,所有患者从PD 置管及PD 治疗开始随访至发生临床终点事件(即退出PD:包括全因死亡、转血透),未发生终点事件的患者随访至2020年1月31日。根据临床转归分为退出组和PD 维持组。血脂异常定义为总胆固醇(TC)≥6.22 mmol/L、甘油三酯(TG)≥2.3 mmol/L、低密度脂蛋白(LDL)≥4.1 mmol/L,HDL ≤1.04 mmol/L,符合一项或一项以上指标异常[8]。
1.4 统计学方法 采用SPSS 22.0 统计软件进行统计学分析,符合正态分布的计量数据用(±s)表示,组间比较采用独立样本t检验;非正态分布的计量数据以M(P25,P75)形式表示,组间比较采用非参数检验;计数资料以例(%)表示,组间比较采用χ2检验。通过绘制Kaplan⁃Meier 生存曲线比较不同HDL 水平的PD 退出及全因死亡情况。采用Cox 回归分析影响PD 临床转归的危险因素。P<0.05 为差异有统计学意义。
2 结果
2.1 患者基本资料及临床转归情况 本研究共纳入433 例PD 患者,男246 例(56.8%),开始PD 时的平均年龄为(50.35 ± 14.54)岁,中位随访时间为35.33(21.78,61.17)个月。临床转归:276 例患者继续维持PD 治疗,157 例退出PD(死亡70 例、转血液透析87 例)。
2.2 退出组和维持组临床资料的比较 见表1,PD 患者中退出组的糖尿病比例、收缩压、脉压大于维持组,而中位透析龄、高血压比例、血清白蛋白(Alb)、TC、HDL 水平低于维持组(P<0.05)。两组患者开始PD 时的平均年龄、性别、舒张压、干腹体质量、体质量指数、TG、LDL、载脂蛋白A、载脂蛋白B、载脂蛋白A/B、血红蛋白、尿素氮、血肌酐、血尿酸、血钾、血钙、血磷、透析充分性、腹膜炎发生率的差异无统计学意义(P>0.05)。
表1 退出组和维持组一般临床资料的比较Tab.1 Comparison of general information in maintenance group and withdrawal group ±s
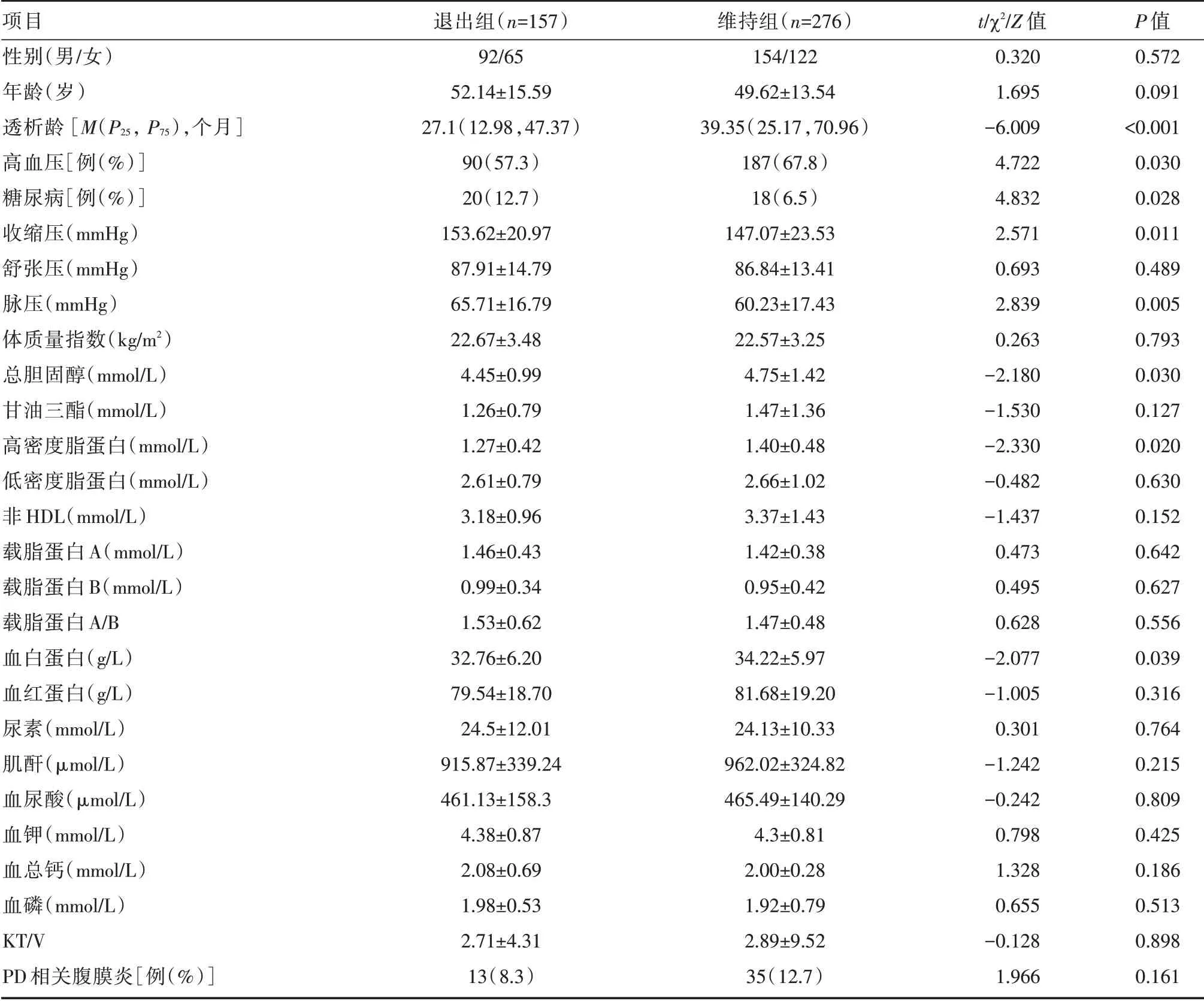
表1 退出组和维持组一般临床资料的比较Tab.1 Comparison of general information in maintenance group and withdrawal group ±s
注:非HDL=非高密度脂蛋白=TC⁃HDL;KT/V=透析充分性
项目性别(男/女)年龄(岁)透析龄[M(P25,P75),个月]高血压[例(%)]糖尿病[例(%)]收缩压(mmHg)舒张压(mmHg)脉压(mmHg)体质量指数(kg/m2)总胆固醇(mmol/L)甘油三酯(mmol/L)高密度脂蛋白(mmol/L)低密度脂蛋白(mmol/L)非HDL(mmol/L)载脂蛋白A(mmol/L)载脂蛋白B(mmol/L)载脂蛋白A/B血白蛋白(g/L)血红蛋白(g/L)尿素(mmol/L)肌酐(μmol/L)血尿酸(μmol/L)血钾(mmol/L)血总钙(mmol/L)血磷(mmol/L)KT/V PD 相关腹膜炎[例(%)]退出组(n=157)92/65 52.14±15.59 27.1(12.98,47.37)90(57.3)20(12.7)153.62±20.97 87.91±14.79 65.71±16.79 22.67±3.48 4.45±0.99 1.26±0.79 1.27±0.42 2.61±0.79 3.18±0.96 1.46±0.43 0.99±0.34 1.53±0.62 32.76±6.20 79.54±18.70 24.5±12.01 915.87±339.24 461.13±158.3 4.38±0.87 2.08±0.69 1.98±0.53 2.71±4.31 13(8.3)维持组(n=276)154/122 49.62±13.54 39.35(25.17,70.96)187(67.8)18(6.5)147.07±23.53 86.84±13.41 60.23±17.43 22.57±3.25 4.75±1.42 1.47±1.36 1.40±0.48 2.66±1.02 3.37±1.43 1.42±0.38 0.95±0.42 1.47±0.48 34.22±5.97 81.68±19.20 24.13±10.33 962.02±324.82 465.49±140.29 4.3±0.81 2.00±0.28 1.92±0.79 2.89±9.52 35(12.7)t/χ2/Z 值0.320 1.695-6.009 4.722 4.832 2.571 0.693 2.839 0.263-2.180-1.530-2.330-0.482-1.437 0.473 0.495 0.628-2.077-1.005 0.301-1.242-0.242 0.798 1.328 0.655-0.128 1.966 P 值0.572 0.091<0.001 0.030 0.028 0.011 0.489 0.005 0.793 0.030 0.127 0.020 0.630 0.152 0.642 0.627 0.556 0.039 0.316 0.764 0.215 0.809 0.425 0.186 0.513 0.898 0.161
2.3 血脂异常组和血脂正常组PD 退出率的差异 有229 例合并血脂异常(52.9%)。血脂异常组的PD 退出率也显著高于血脂正常组(42.0%vs.30.4%,P<0.05)。不同TC、TG 及LDL 血脂组分水平的患者PD 退出率差异均无统计学意义(P>0.05)。
2.4 不同HDL 水平亚组PD 退出率的差异 将患者根据HDL 水平分为不同亚组(各个亚组赋值详见表2)。如表3 所示,低HDL 组的PD 退出率高于非低HDL 组,HDL⁃Q3 组的PD 退出率高于HDL⁃Q2、HDL⁃Q1 组。

表2 HDL 分层与赋值情况Tab.2 Stratification and assignment of HDL
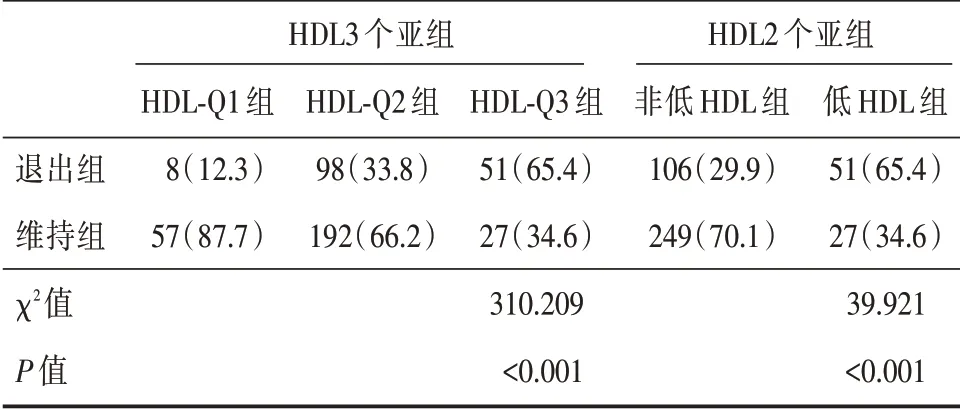
表3 不同HDL 水平亚组PD 退出率的差异Tab.3 Comparison ofPD withdrawal rate in subgroups with different HDL levels例(%)
2.5 不同HDL 水平的累积PD 维持率和累积生存率的比较 Kaplan⁃Meier 生存曲线显示(图1),HDL⁃Q1 组患者的中位PD 维持时间大于HDL⁃Q2、HDL⁃Q3 组,且HDL⁃Q3 组患者的累积PD 维持率低于HDL⁃Q1 和HDL⁃Q2 组。见图2,HDL⁃Q1 组患者的中位生存时间大于HDL⁃Q2、HDL⁃Q3组,且HDL⁃Q3 组患者累积生存率低于HDL⁃Q1 和HDL⁃Q2 组(P<0.05)。
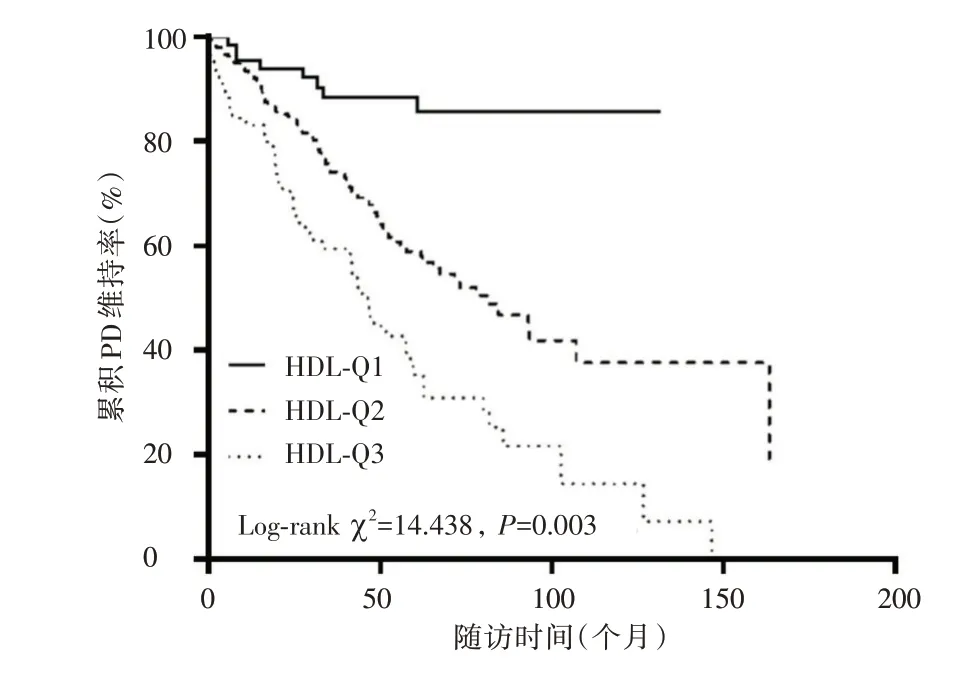
图1 不同HDL 水平亚组PD 维持率的比较Fig.1 Comparison of PD maintenance rates in different HDL subgroups
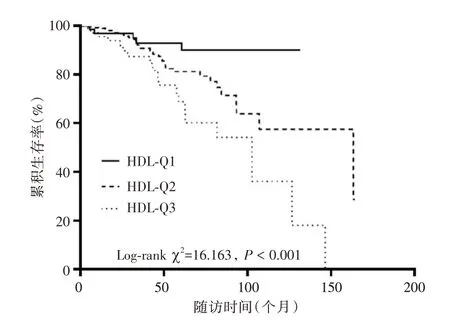
图2 不同HDL 水平亚组累积生存率的比较Fig.2 Comparison of cumulative survival in different HDL subgroups
2.6 影响PD 临床转归的Cox 回归分析、HDL 与PD 临床转归的关系分析 首先采用单因素Cox 回归分析方法对表1 中有统计学意义(P<0.05)的变量(透析龄、糖尿病史、高血压、收缩压、脉压、TC、HDL 及Alb)进行分析,计算风险比值(HR)和P值,筛选出P<0.1 的变量(糖尿病史、收缩压、脉压及HDL)代入多元逐步Cox 回归分析(表4),结果显示矫正了混杂因素影响后,HDL 水平下降仍是影响PD 患者退出PD 的独立危险因素。HDL⁃Q2、HDL⁃Q3 组的PD 退出率分别是HDL⁃Q1 组的3.701倍、5.065 倍。
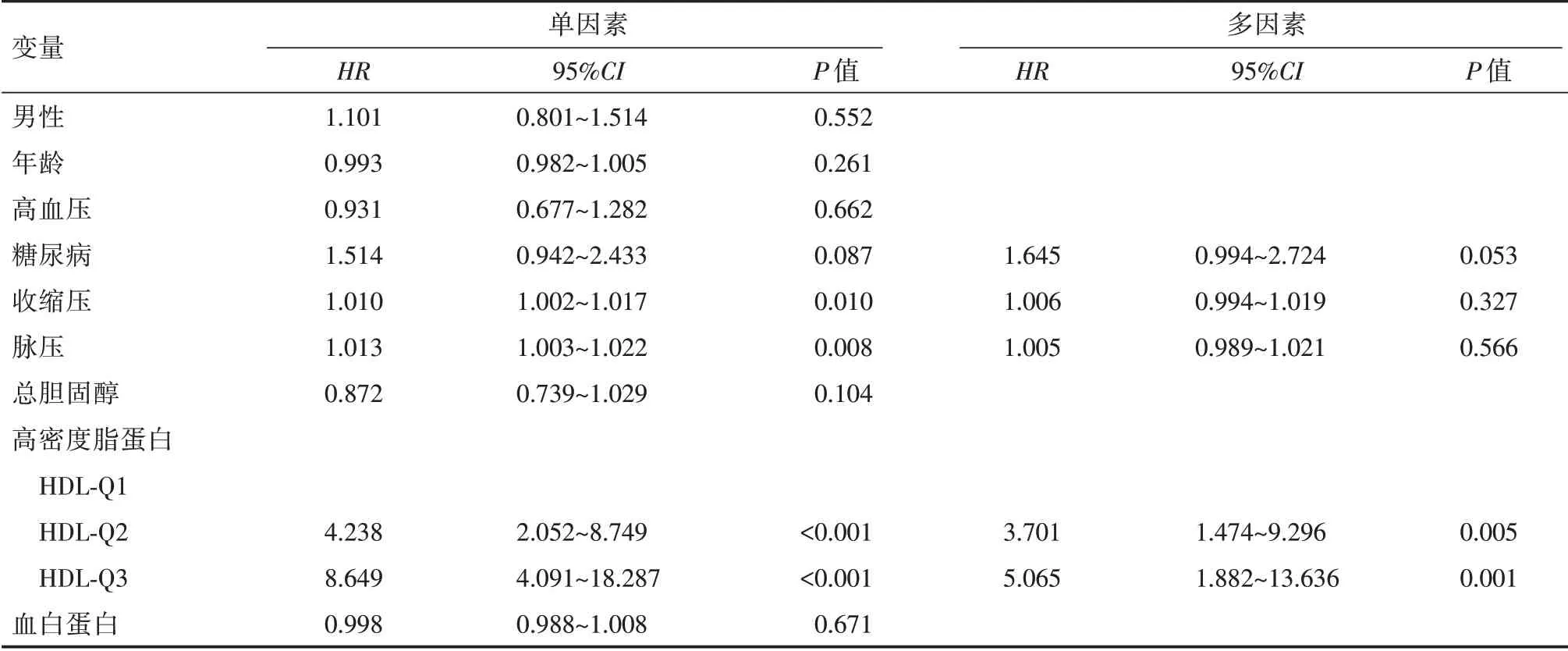
表4 影响PD 患者退出的Cox 回归分析Tab.4 Multiariable Cox regression analysis in PD patients
3 讨论
本研究显示PD 的退出率为36.3%,PD 患者退出PD 的最主要原因为转血液透析。既往的研究PD 退出原因均为死亡和转血液透析[9],但二者所占比例具有一定的差异,可能是由于不同研究的研究人群、随访周期、PD 方案、病程及患者的经济条件不一致等因素引起的[10]。鉴于近年来PD 退出率较高、技术生存率偏低的现状,探讨影响PD患者退出治疗的危险因素,并在治疗过程中积极干预,有利于提高PD 的治疗维持率,改善患者的临床转归。
本研究中PD 患者的血脂异常发生率高达52.9%,PD 退出组的HDL 低于维持组。研究表明PD 患者的脂质谱比非透析和血液透析患者更容易致动脉粥样硬化[11-12],导致内皮功能障碍及加速血管老化、钙化,大大增加心脑血管事件风险。本研究结果还提示血脂异常组的PD 患者全因死亡率、退出率显著高于血脂正常组,可见血脂异常与PD 患者的心脑血管事件、退出PD 等不良临床转归的发生相关。研究表明PD 患者合并基线致动脉粥样硬化的血脂异常与PD 技术失败的高风险显著相关(HR=4.5)[13]。PD 患者合并血脂代谢紊乱可通过肾动脉粥样硬化斑块形成、脂质诱导氧化应激或促进炎症细胞因子的释放而导致肾小球损伤、残肾功能进一步下降[14]。
本研究结果还显示低HDL 是影响PD 患者退出和全因死亡的独立因素。研究表明单核细胞/HDL 比值是高血压并发无症状脑梗死的独立危险因素[15],还有研究显示升高的TG/HDL 和非HDL/HDL 可以预测PD 患者的死亡率[16],均与本研究结果相符。而一项队列研究发现,极高水平的HDL⁃C 也可能增加动脉粥样硬化性CVD 死亡的风险(HR=2.37)[17]。HDL 通过其强大的抗炎、抗氧化和抗血栓活性及调节胆固醇反向运输途径,提供对动脉粥样硬化、氧化应激和全身炎症的保护[18],而在PD 患者中HDL 这种保护功能减弱。近年来的研究表明基线HDL 的外流能力独立于血浆中的HDL、ApoA⁃1 水平,与心血管事件的发展显著相关[19]。低HDL 引起PD 患者退出率和全因死亡率升高可能与以下因素有关:HDL 缺乏和功能障碍可能导致脂质介导的肾脏损伤和功能障碍,促进泡沫细胞的形成,加速动脉粥样硬化和CVD 的发生发展进程[20];HDL 缺乏可能导致ESRD 患者出现严重的内毒素血症和相关的全身炎症,也可能导致微生物感染后的不良预后;HDL 缺乏和/或功能障碍可导致血栓形成,影响PD 患者的预后情况[21]。
本研究存在一定局限性。首先本研究为单中心回顾性研究,样本量较小;其次,评估的是基线血脂水平,没有关注其动态变化和降脂药物的干预对PD 患者临床转归的影响。因此,更可靠的研究结论仍需在后续的多中心大样本临床队列研究中进一步证实。
综上所述,PD 患者血脂异常的发生率较高,且血脂异常患者PD 退出率较正常者高,HDL 下降是影响PD 患者死亡和转血透的危险因素。低HDL 水平的患者退出PD 治疗的风险增高,临床强调对PD 患者的血脂监测可能有助于预测其临床转归。
