全反式维甲酸通过调控sFlt⁃1表达对滋养层细胞侵袭及促血管形成能力的影响
2021-08-25阳双健钟黎黎盛莹郭江虹何宜静
阳双健 钟黎黎 盛莹 郭江虹 何宜静
1南华大学衡阳医学院,附属第一医院产科(湖南衡阳421001);2南华大学衡阳医学院,附属第二医院妇产科(湖南衡阳421001)
子痫前期(PE)属于妊娠期特有疾病,指孕妇在怀孕20 周以后出现以高血压、蛋白尿为主要临床表现的一组临床综合征[1]。既往研究显示[2⁃3],胎盘生长因子(PIGF)和血管内皮细胞生长因子(VEGF)含量在子痫前期患者的胎盘组织及血清中降低,而可溶性血管内皮生长因子受体1(sFlt⁃1)含量升高,表明胎盘血管发育异常与子痫前期形成有关。全反式维甲酸(ATRA)是维生素A 的生物活性衍生物,在体内和体外均表现出调节细胞分化、增殖和凋亡的作用[4⁃5]。有研究[6]指出,ATRA 在子痫前期患者子宫脱膜组织中低表达,胎盘中ATRA 异常表达可能影响到滋养细胞的浸润过程,但ATRA 在此过程中是否参与胎盘滋养层细胞侵袭、迁移等过程的调控以及具体机制尚未明确。因此,本研究拟初步探讨ATRA 对滋养细胞sFlt⁃1 表达的影响以及ATRA 通过调控sFlt⁃1 表达对滋养细胞侵袭及促血管形成能力产生影响,以期为ATRA 治疗子痫前期提供理论依据。
1 材料与方法
1.1 材料 人胎盘滋养细胞系HTR⁃8/SVneo 购自美国模式菌种收集中心(ATCC);ATRA 购自美国Sigma 公司;sFlt⁃1、基质金属蛋白酶⁃2(MMP⁃2)、基质金属蛋白酶⁃9(MMP⁃9)和GAPDH 抗体均购自美国Abcam 公司;RPMI1640 培养基购自美国Hy⁃Clone 公司;反转录试剂盒、实时定量PCR 试剂盒购自美国Thermo Fisher 公司;sFlt⁃1 过表达质粒构建及慢病毒包装、浓缩及纯化由汉恒生物科技(上海)公司完成;PIGF、sFlt⁃1 和VEGF ELISA 试剂盒购自上海卡努生物科技有限公司。
1.2 方法
1.2.1 细胞培养 HTR⁃8/SVneo 细胞复苏后培养于含1%青霉素⁃链霉素溶液和5%胎牛血清的RP⁃MI1640 培养基中,置于37 ℃、5% CO2培养箱培养传代。
1.2.2 ATRA 干预后细胞中sFlt⁃1 表达检测 取对数生长期HTR⁃8/SVneo 细胞,按照1 × 106个/mL的细胞数接种于6 孔板,待细胞生长至60%融合度时,采用0.15 μmol/L ATRA 分别处理细胞0、12、24、48、72 h,然后采用qRT⁃PCR 和ELISA 法分别检测细胞中sFlt⁃1 mRNA 表达水平及蛋白含量。
1.2.3 细胞感染及分组处理 待细胞生长至60%融合度时,分别取阴性对照慢病毒(Vector)和sFlt⁃1 过表达质粒慢病毒(Lv⁃sFlt⁃1)感染HTR⁃8/SVneo细胞(感染比例为1∶50),另设未经病毒感染的细胞作为空白对照组(blank),分别记为Lv⁃sFlt⁃1 组、Vector 组和blank 组。感染8 h 后吸除原培养基,更换为新鲜的培养基继续培养,72 h 后用嘌呤霉素筛选稳定表达株,分别采用RT⁃PCR 和Western blot实验验证sFlt⁃1 过表达效果。而后将细胞分为4组:(1)对照组(Control):HTR⁃8/SVneo 细胞不经任何处理;(2)ATRA 组:HTR⁃8/SVneo 细胞经0.15 μmol/L ATRA 处理24 h;(3)Lv⁃sFlt⁃1 组:稳定过表达sFlt⁃1 的HTR⁃8/SVneo 细胞不经任何处理;(4)ATRA+Lv⁃sFlt⁃1 组:稳定过表达sFlt⁃1 的HTR⁃8/SVneo 细胞经0.15 μmol/L ATRA 处理24 h。
1.2.4 qRT⁃PCR 检测细胞中sFlt⁃1 mRNA 表达水平 收集细胞,采用Trizol 法取总RNA,通过紫外分光光度计检测总RNA 的含量及纯度,按照逆转录试剂盒合成cDNA,逆转录产物作为下一步PCR模版,sFlt⁃1 上游引物序列5′⁃GCAC CTTGGTTGTG⁃GCTGACT⁃3′,sFlt⁃1 下游引物序列5′⁃GGGC CC⁃GGGGGTCTCA TTATT⁃3;GAPDH 上游引物序列5′⁃ACTAG GCGCTCACTGTTCTC⁃3′,下游引物序列5′⁃AT CCGTTGACTCCGACCTTC⁃3′。按照试剂盒说明书进行操作,4 倍梯度稀释模板cDNA 制作标准曲线,确认各个基因的扩增效率,确定cDNA 上样浓度。根据反应条件在每个循环延伸末端收集荧光信号,绘制扩增曲线。PCR 扩增仪按照95 ℃预变性30 s,95 ℃变性5 s,退火30 s,72 ℃延伸20 s的条件扩增40 次。采用2⁃△△Ct法计算sFlt⁃1 mRNA相对表达量。
1.2.5 ELISA 检测细胞上清中sFlt⁃1、PIGF 和VEGF 蛋白含量 收集细胞培养上清液,5 000 g离心10 min,收集上清,具体操作过程按照试剂盒说明书进行,采用酶标仪在450 nm 波长处测定各孔的OD值,根据标准曲线计算细胞培养上清中sFlt⁃1、PIGF 和VEGF 蛋白含量。
1.2.6 Western blot 检测细胞中相关蛋白表达 收集细胞并加入RIPA 细胞裂解液,置于冰上作用30 min,12 000 g 离心15 min,取上清液用BCA 法测定蛋白浓度并进行蛋白定量,经聚丙烯酰胺变性凝胶电泳分离蛋白,用湿转法将蛋白转移到聚偏氟乙烯膜,50 mol/L 脱脂牛奶封闭,加入一抗孵育过夜,稀释比均为1∶500。4 ℃过夜,次日TBST 洗脱3 次,对应加辣根过氧化物酶标记的二抗,室温孵育2 h,TBST 洗脱3 次,用ECL 发光液发光显色,在自动凝胶成像分析系统成像,使用Image J 软件进行分析,以GAPDH 为内参计算总蛋白相对表达量。
1.2.7 Transwell 法检测细胞侵袭和迁移能力 取24 孔板Transwell 小室,使用无血清培养基重悬细胞,以每孔2 × 105的细胞密度接种于PBS 提前湿润的Transwell 小室上室聚碳酸酯微孔膜上,每孔加200 μL 无血清培养基。将600 μL 完全培养基加入下室,作为趋化因子,放至培养箱中培养,显微镜下观察穿过掉入下室5 个细胞时终止培养,PBS 洗3 次,甲醛固定15 min,0.1%结晶紫溶液染色15 min,晾干后取出聚碳酸酯微孔膜。于显微镜下随机计数5 个视野膜上的细胞数目,取其均值,代表细胞转移能力。细胞侵袭实验时Tran⁃swell 小室上室提前加入Matrigel 胶后接种细胞,剩下操作同迁移实验。
1.2.8 小管形成实验检测细胞体外促血管形成能力 将Matrigel 基质胶提前放入4 ℃冰箱过夜,融化后加入到96 孔板中凝胶。取各组HUVEC 细胞上清液,2 000 g 离心5min,收集上清后重悬细胞并调整细胞浓度为2×105个/mL,随后向铺好基质胶的96 孔板中每孔加入100 μL 细胞悬液,置于37 ℃5% CO2的培养箱中培养6 h,显微镜下观察细胞成管情况并拍照,并随机取5 个视野统计小管形成数量取均值。
1.3 统计学方法 所有实验均重复3 次,采用SPSS 22 软件进行统计学分析,计量资料用(±s)表示,多组间比较采用单因素方差分析或连续测量数据的方差分析,两两比较采用LSD⁃t检验。以P<0.05 表示差异有统计学意义。
2 结果
2.1 ATRA 抑制HTR⁃8/SVneo 细胞中sFlt⁃1 的表达 见图1,随着0.15 μmol/L ATRA 处理时间的延长,HTR⁃8/SVneo 细胞中sFlt⁃1 mRNA 表达水平及上清液中sFlt⁃1 蛋白含量逐渐降低,差异有统计学意义(FsFlt⁃1mRNA=11.20,FsFlt⁃1蛋白=49.66,P<0.001)。与0 h 时间点比较,0.15 μmol/L ATRA 处理24、48、72 h 时,HTR⁃8/SVneo 细胞中sFlt⁃1 mRNA 表达水平及上清液中sFlt⁃1 蛋白含量显著降低,差异有统计学意义(均P<0.001),根据该结果选择24 h 作为后续实验时间点。
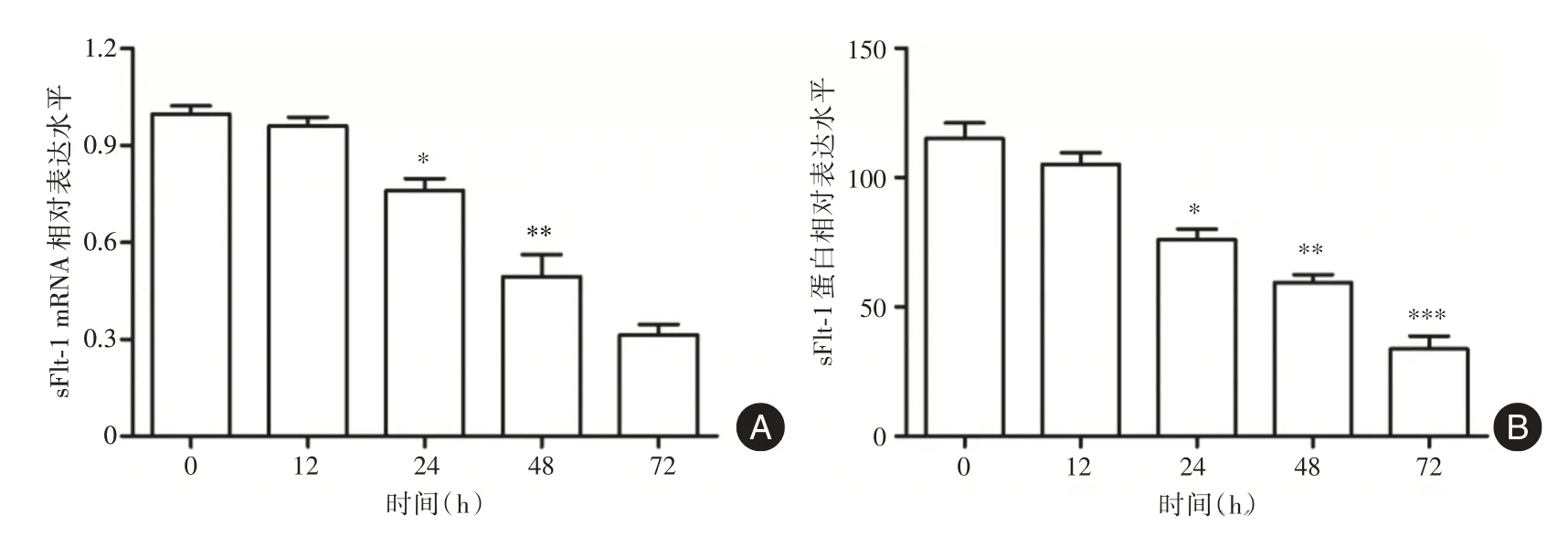
图1 ATRA 对HTR⁃8/SVneo 细胞中sFlt⁃1 表达的影响Fig.1 Effect of ATRA on the expression of sFlt⁃1 in HTR⁃8/SVneo cells
2.2 过表达sFlt⁃1 后HTR⁃8/SVneo 细胞中sFlt⁃1的表达水平 见图2,与blank 组或Vector 组比较,Lv⁃sFlt⁃1 组细胞中sFlt⁃1 mRNA 和蛋白表达水平均显著增加(P<0.001),表明成功构建sFlt⁃1 过表达的HTR⁃8/SVneo 细胞。
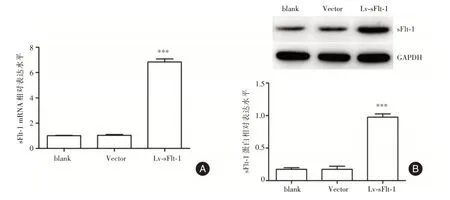
图2 各组细胞中sFlt⁃1 mRNA 和蛋白表达水平Fig.2 The mRNA and protein expression levels of sFlt⁃1 in each group
2.3 ATRA 对HTR⁃8/SVneo 细胞中sFlt⁃1、PIGF和VEGF 蛋白分泌的影响 见图3,与Control 组比较,ATRA 组细胞上清液中sFlt⁃1 蛋白水平显著降低(P<0.05),PIGF 和VEGF 蛋白含量显著升高(P均<0.01);而Lv⁃sFlt⁃1 组细胞上清液中sFlt⁃1 蛋白含量显著升高(P<0.01),PIGF 和VEGF 蛋白含量显著降低(均P<0.05);与ATRA 组比较,ATRA+Lv⁃sFlt⁃1 组细胞上清液中sFlt⁃1 蛋白含量显著升高(P<0.01),而PIGF 和VEGF 蛋白含量显著降低(均P<0.01)。2.4 ATRA 对HTR⁃8/SVneo 细胞侵袭和迁移能力的影响 见图4、5,与Control 组比较,ATRA 组迁移和侵袭细胞数目显著增加(P<0.001),而Lv⁃sFlt⁃1 组迁移和侵袭细胞数目显著减少(P<0.001);与ATRA 组比较,ATRA+Lv⁃sFlt⁃1 组侵袭和迁移细胞数目显著减少(P<0.001)。见图6,与Control 组比较,ATRA 组细胞中MMP⁃9 和MMP⁃2蛋白水平均显著上调(P<0.001),而Lv⁃sFlt⁃1 组细胞中MMP⁃9 和MMP⁃2 蛋白水平均显著下调(P<0.001);与ATRA 组比较,ATRA+Lv⁃sFlt⁃1 组细胞中MMP⁃9 和MMP⁃2 蛋白水平均显著下调(P<0.001)。
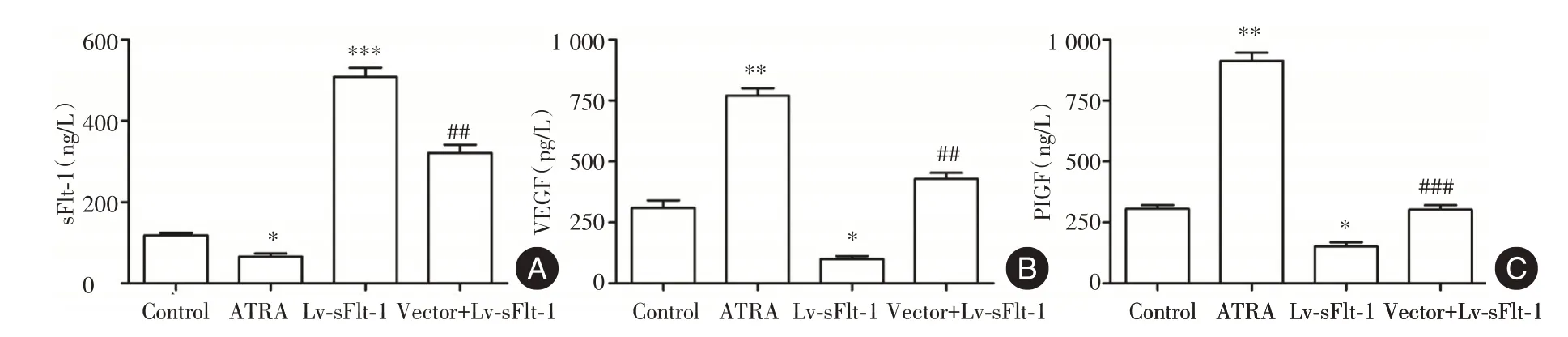
图3 各组细胞上清液中sFlt⁃1、PIGF 和VEGF 蛋白含量比较Fig.3 Comparison of the protein contents of sFlt⁃1,PIGF and VEGF in the supernatant of each group
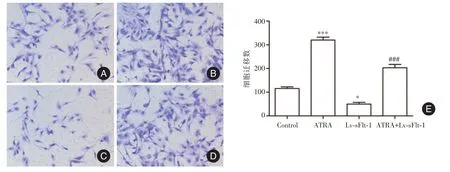
图4 各组细胞迁移能力比较(×200)Fig.4 Comparison of the migration ability of cell in each group(×200)
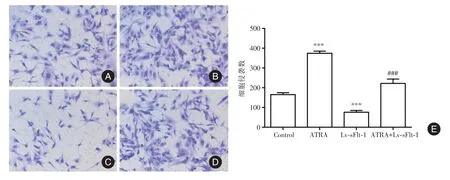
图5 各组细胞侵袭能力比较(×200)Fig.5 Comparison of the invasion ability of cell in each group(×200)
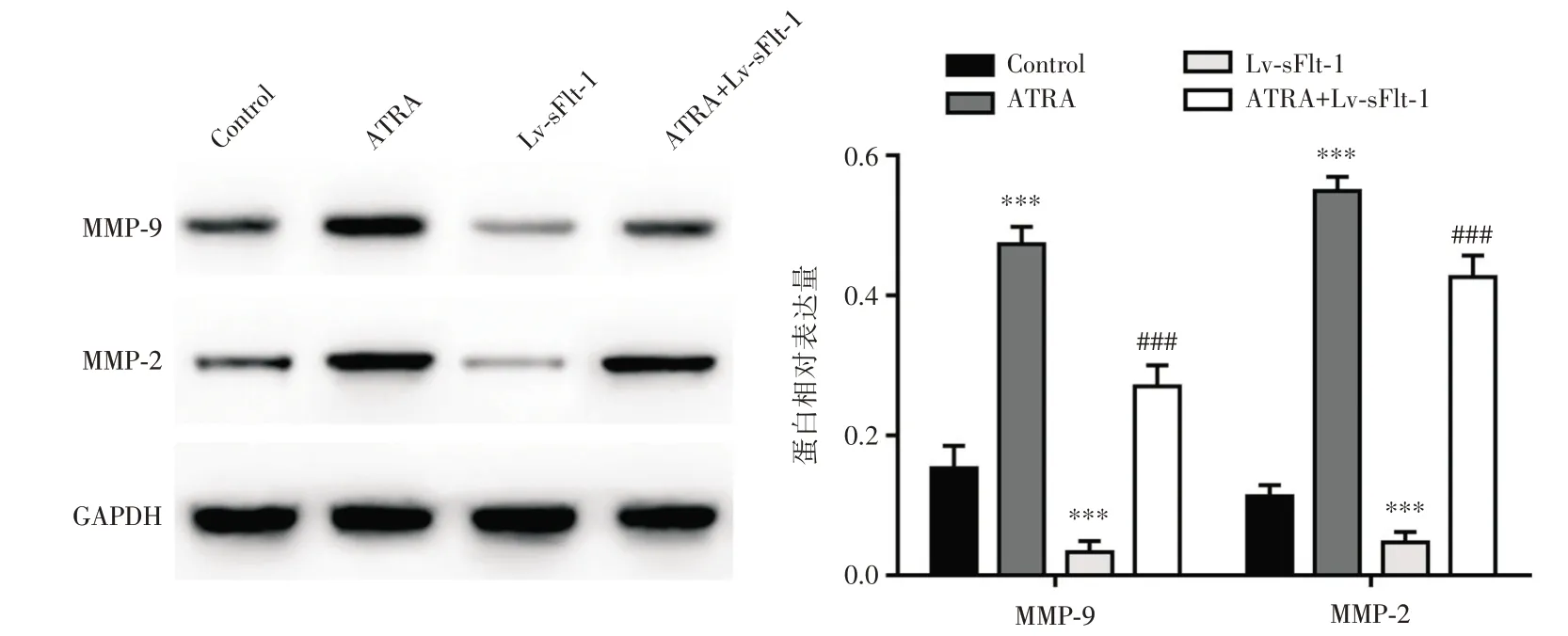
图6 各组细胞中MMP⁃2 和MMP⁃9 蛋白表达水平Fig.6 Comparison of the protein expression levels of MMP⁃2 and MMP⁃9 in each group
2.5 ATRA 对HTR⁃8/SVneo 细胞促血管形成能力的影响 见图7,与Control 组比较,ATRA 组细胞培养上清诱导的HUVEC 细胞血管成管数量显著增加(P<0.001),而Lv⁃sFlt⁃1 组细胞培养上清诱导的HUVEC 细胞血管成管数量显著减少(P<0.001);与ATRA 组比较,ATRA+Lv⁃sFlt⁃1 组细胞培养上清诱导的HUVEC 细胞血管成管数量显著减少(P<0.001)。
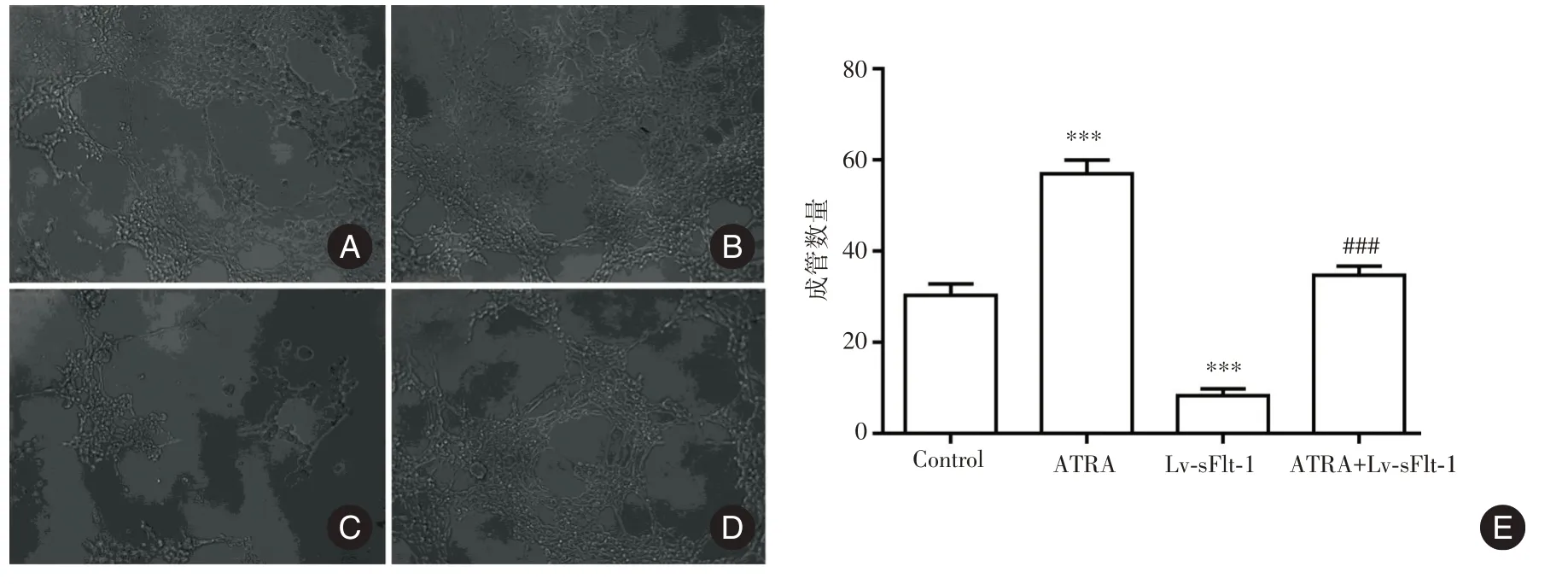
图7 各组细胞的促血管形成能力比较(×100)Fig.7 Comparison of the angiogenesis ability of the cells in each group(×100)
3 讨论
ATRA 是维生素A 在体内的重要活性代谢产物,在胚胎发育、组织器官形成、细胞增殖、分化、代谢及肿瘤的发生发展中均发挥重要作用[7⁃9],但过量的ATRA 会导致胎儿畸形,包括消化道畸形、先天性马蹄内翻足等。有研究显示[6],ATRA 在子痫前期患者子宫脱膜组织中含量较低,采用ATRA干预可导致子痫前期胎盘基底脱膜细胞中sFlt⁃1低表达,而采用ATRA 拮抗剂BMS493 干预可上调sFlt⁃1 表达,推测ATRA 有可能通过抑制sFlt⁃1 表达改善子痫前期胎盘血管发育异常。本研究结果显示,ATRA 可能通过抑制sFlt⁃1 的表达促进滋养细胞的侵袭和血管生成,从而可能影响子痫前期的病理过程。
sFlt⁃1 是血管内皮生长因子受体⁃1(Flt⁃1)的稀有剪接形式,可与Flt⁃1 竞争性结合VEGF 和PIGF,使VEGF 和PIGF 生物学功能被抑制,造成胎盘血管生成障碍[10-11]。有研究利用不同药物抑制sFlt⁃1水平达到了治疗子痫前期的目的,例如硫酸镁[12]、拉贝洛尔[13]、乌拉地尔和香丹注射液[14]等。本研究中首先采用ATRA 处理HTR⁃8/SVneo 细胞不同时间,发现ATRA 可抑制HTR⁃8/SVneo 细胞sFlt⁃1 mRNA 的表达及其蛋白的分泌,且呈时间依赖性,由此推测ATRA 可能抑制sFlt⁃1 表达。
本研究结果显示,ATRA 处理可抑制HTR⁃8/SVneo 细胞分泌sFlt⁃1 蛋白,促进PIGF 和VEGF 蛋白分泌,同时可提高细胞的侵袭、迁移以及促血管形成能力;而sFlt⁃1 过表达可促进HTR⁃8/SVneo 细胞分泌sFlt⁃1 蛋白,抑制PIGF 和VEGF 蛋白分泌,并降低细胞促血管形成等能力;为了进一步探讨ATRA 通过抑制sFlt⁃1 表达而发挥作用,本研究采用ATRA 干预sFlt⁃1 过表达的HTR⁃8/SVneo 细胞,结果显示sFlt⁃1 过表达可逆转ATRA 对HTR⁃8/SV⁃neo 细胞的干预效果,表明ATRA 是通过抑制sFlt⁃1表达,促进PIGF 和VEGF 的分泌,进而增强滋养层细胞促血管形成能力。此外,MMP⁃9 和MMP⁃2 是一类基质金属蛋白酶,表达异常可影响滋养细胞的侵袭能力,导致血管重铸不全[15]。研究表明[16-17],子痫前期患者胎盘组织中MMP⁃2 和MMP⁃9 蛋白表达水平显著降低。本研究结果显示,ATRA 处理可促进HTR⁃8/SVneo 细胞中MMP⁃9 和MMP⁃2 蛋白表达,而sFlt⁃1 过表达可显著下调MMP⁃9 和MMP⁃2 蛋白表达水平;然而,sFlt⁃1 过表达又可抑制ATRA 干预对HTR⁃8/SVneo 细胞中MMP⁃9 和MMP⁃2 蛋白表达的上调作用。因此,ATRA 可能通过抑制sFlt⁃1表达,促进MMP9 和MMP2 蛋白的表达,进而提高滋养细胞的侵袭与迁移能力。
综上所述,ATRA 可能通过抑制sFlt⁃1 调控PIGF 和VEGF 的表达,促进滋养细胞的侵袭及促血管形成能力,因而ATRA 可能具有改善子痫前期的效果。本研究的新颖之处是首次探讨了ATRA对滋养细胞sFlt⁃1表达以及对其侵袭和促血管形成能力的影响,但不足之处是未在动物水平进行验证,因此下一步的研究方向将会进行动物体内探究。
