复方牦牛骨粉对骨质疏松大鼠的影响
2021-08-23郜靓梁丹妮杨红霞肖远灿魏立新杜玉枝
郜靓 梁丹妮 杨红霞肖远灿魏立新杜玉枝*
(1.中国科学院西北高原生物研究所,青海省藏药药理学与安全性评价研究重点实验室,青海 西宁810008; 2.中国科学院藏药重点实验室,青海 西宁810008; 3.中国科学院大学,北京100049)
骨质疏松症是由于雌激素不足、增龄衰老、内分泌功能紊乱等多种病因导致的以骨量丢失、结构改变、生物力学性能减退、易发生骨折为特点的全身性骨代谢疾病,影响了全世界大多数老年人的生活。近几年流行病学调查结果显示,我国约有老龄人口1.3 亿,而骨质疏松症患者就达8 400 万,预计到2050年老龄人口将达到2.5 亿,其中25%~70%可能患有该疾病[1]。全球每年因骨质疏松引起的骨折约有900 万例[2],目前已被世界卫生组织(WHO)列为十大最严重疾病之一[3]。本实验采用维甲酸制备骨质疏松症模型,它是继发性骨质疏松症最常见的病因之一[4],模型大鼠在发病症状、组织学表现、对雌激素的反应方面与人类有较高的相似性[5]。
牦牛主要分布于喜马拉雅山脉和青藏高原,藏医常用其骨、髓入药,《四部医典》 中有用骨汁药浴和三味骨精汤治疗各种骨质增生、骨质疏松、骨性关节病等骨疾病的记载[6]。已有研究表明,牦牛骨粉不仅可显著增加骨密度,而且与相应剂量的碳酸钙比较具有较高的钙表观吸收率[7⁃8],并且含有大量K、Na、Ca、Mg、Mn、Fe、Zn 等人体必需元素[9],钙磷比例为2∶1,可作为良好的补钙剂[10]。因此,本实验考察复方牦牛骨粉对维甲酸诱导骨质疏松症的影响。
1 材料与方法
1.1 动物 8~10 周龄的SPF 级SD 大鼠72 只,体质量(200±20)g,购自甘肃中医药大学科研实验中心,实验动物生产许可证号SCXK(甘)2015⁃0002。动物实验操作过程依照中国科学院西北高原生物研究所动物实验伦理委员会的要求执行。
1.2 试剂与药物 维甲酸(上海阿拉丁生化科技股份有限公司);水合氯醛(天津市大茂化学试剂厂)。朗迪碳酸钙D3片(Ⅱ)(北京振东康远制药有限公司,批号20181074);复方牦牛骨粉(牦牛骨粉、脱脂牦牛骨髓、牦牛皮胶、牦牛奶粉按12∶1∶4∶3 比例混合均匀,添加50 mL 纯水,水浴37 ℃ 加热搅拌至完全溶解,专利号ZL201610061603.1)。Co60辐照钙缺乏繁殖型纯化鼠饲料(北京华博德亿生物技术有限公司)。大鼠BGP、TRAP 酶联免疫检测试剂盒,血清ALP、Ca2+、P 生化检测试剂盒(江莱生物科技有限公司)。
1.3 仪器 直接数字化双能X 线骨密度检测仪(美国GE Healthcare 公司);多排定量小型动物CT、多功能酶标仪(美国PerkinElmer 公司);台式高速冷冻离心机(德国Sigma 公司)。
1.4 方法
1.4.1 造模及分组 72 只大鼠按体质量随机分为6组,即空白组、模型组、阳性对照组(碳酸钙D3片)及复方牦牛骨粉低、中、高剂量组,除空白组外,其余各组大鼠连续灌胃给予维甲酸(70 mg/kg)14 d[11]。模型成立后,空白组、模型组大鼠以纯水灌胃(0.1 mL/10 g),其余各组大鼠分别灌胃给予阳性药碳酸钙D3片(74.74 mg/kg,临床等效剂量)[12]、低剂量复方牦牛骨粉(4.67 mg/kg,临床等效剂量的1/16)、中剂量复方牦牛骨粉(18.69 mg/kg,临床等效剂量的1/4)、高剂量复方牦牛骨粉(37.37 mg/kg,临床等效剂量的1/2),每天1 次,连续4 周。
1.4.2 体质量测定 每周称定大鼠体质量,并根据体其变化调整给药量。于造模前后及给药4 周后3个时间点,对大鼠体质量进行增长率比较。
1.4.3 骨密度(BMD)测定 给药4 周后,10%水合氯醛腹腔注射麻醉大鼠,采用双能X 射线骨密度仪进行全身扫描,检测股骨、脊椎、全身骨密度。
1.4.4 血液指标检测 于造模前后及给药4 周后大鼠眼球采血,采用试剂盒对血清钙(Ca2+)、磷(P)、骨钙素(BGP)水平及碱性磷酸酶(ALP)、抗酒石酸性磷酸酶(TRAP)活性,分析其变化趋势。
1.4.5 Micro⁃CT 扫描 给药4 周后,取大鼠右侧股骨及腰椎L1⁃L4段,除去筋膜,4% 多聚甲醛固定,将大鼠股骨及腰椎标本固定在Micro⁃CT 动物床上,上下扫描200 层,扫描电压90 kV,电流88 μA,视野36 mm。采用Caliper Analyze 软件,对大鼠股骨及腰椎组织体积(TV)、骨体积分数(BV/TV)、骨表面积组织体积比(BS/TV)、骨小梁数量(Tb.N)、骨小梁分离度(Tb.Sp)、骨小梁厚度(Tb.Th)进行分析。
1.5 统计学分析 通过SPSS 20.0 软件进行处理,数据以()表示,多组间比较采用单因素方差分析或非参数检验,组间两两比较采用LSD⁃t检验。P<0.05 表示差异具有统计学意义。
2 结果
2.1 体质量增长率 与造模前比较,空白对照组大鼠体质量增长幅度最显著,其余各组基本相同;给药4 周后,模型组大鼠体质量增长幅度最小,而各给药组均有所增加,其中复方牦牛骨粉组其涨幅与给药剂量成正比。见图1。

图1 各组大鼠体质量变化Fig.1 Weight changes of rats in various groups
2.2 BMD 与空白组比较,模型组大鼠股骨、脊椎及全身BMD 降低(P<0.01);与模型组比较,阳性对照组和各给药组大鼠股骨、脊椎及全身BMD 升高,而且除复方牦牛骨粉低剂量组外,其余各组均升高(P<0.05,P<0.01),见表1。
表1 各组大鼠BMD(, n=12)Tab.1 BMDs of rats in various groups(, n=12)

表1 各组大鼠BMD(, n=12)Tab.1 BMDs of rats in various groups(, n=12)
注:与空白组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01。
2.3 血液指标 与空白组比较,模型组大鼠血清Ca2+、ALP、BGP、TRAP 水平升高(P<0.05,P<0.01),血清P 水平无明显变化(P>0.05);与模型组比较,阳性对照组、各给药组大鼠血清ALP水平降低(P<0.01),复方牦牛骨粉中、高剂量组大鼠血清Ca2+水平降低(P<0.05,P<0.01),P、TRAP 水平升高(P<0.05,P<0.01),见表2、图2。

图2 各组大鼠血液指标变化(, n=12)Fig.2 Changes of blood indices in rats in various groups(, n=12)
表2 各组大鼠血液指标(, n=12)Tab.2 Blood indices in rats in various groups(, n=12)

表2 各组大鼠血液指标(, n=12)Tab.2 Blood indices in rats in various groups(, n=12)
注:与空白组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01。
2.4 Micro⁃CT 与其他各组比较,模型组TV 更低,BV/TV 无明显变化(P>0.05);BS/TV 高于空白组及复方牦牛骨粉中、高剂量组(P<0.05,P<0.01);除阳性对照组外,模型组Tb.N 与其他各组比较无明显变化(P>0.05);模型组Tb.Sp高于空白组及复方牦牛骨粉低剂量组(P<0.05),Tb.Th 低于空白组及复方牦牛骨粉中、高剂量组(P<0.05,P<0.01),见图3、表3。
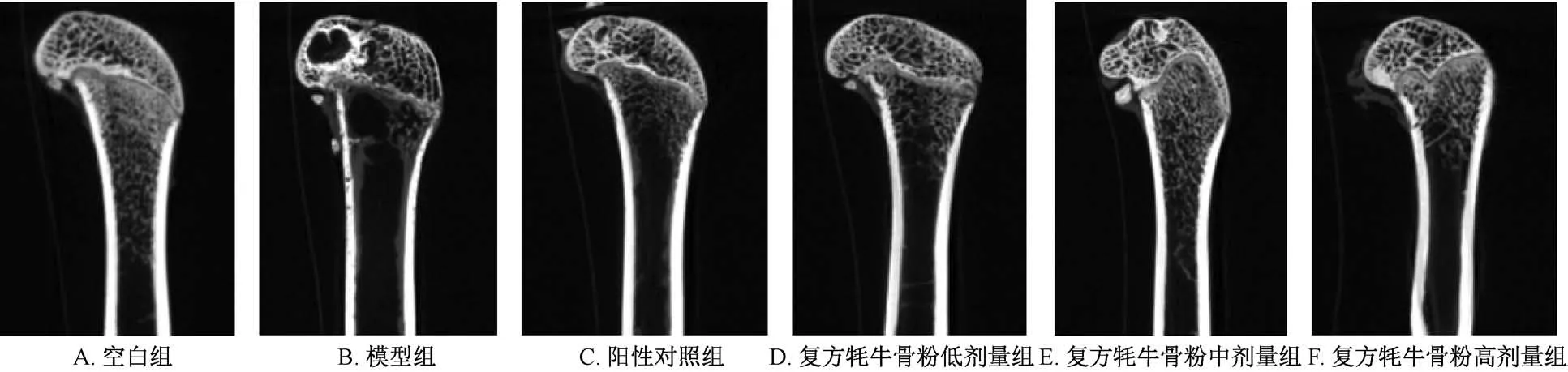
图3 各组大鼠股骨Micro⁃CT图Fig.3 Micro⁃CT images for the femurs of rats in various groups
表3 各组大鼠股骨CT 参数(, n=12)Tab.3 CT parameters of the femurs of rats in various groups(, n=12)

表3 各组大鼠股骨CT 参数(, n=12)Tab.3 CT parameters of the femurs of rats in various groups(, n=12)
注:与空白组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01。
除复方牦牛骨粉低剂量组外,模型组TV 与其他各组比较无明显变化(P>0.05);模型组BV/TV 低于空白组及复方牦牛骨粉中、高剂量组(P<0.05);除复方牦牛骨粉低剂量组外,模型组BS/TV 高于其他各组(P<0.01);模型组Tb.N 小于复方牦牛骨粉低剂量组(P<0.05);各组Tb.Th、Tb.Sp 无统计学差异(P>0.05),见图4、表4。

图4 各组大鼠腰椎Micro⁃CT图Fig.4 Micro⁃CT images for the lumbar spines of rats in various groups
表4 给药干预后各组大鼠腰椎CT 参数(, n=12)Tab.4 CT parameters of the lumbar spine of rats in various groups after drug intervention(, n=12)

表4 给药干预后各组大鼠腰椎CT 参数(, n=12)Tab.4 CT parameters of the lumbar spine of rats in various groups after drug intervention(, n=12)
注:与空白组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01。
3 讨论
骨质疏松症的定义为“以骨量减少、骨显微结构退化为特征,导致骨强度降低而易发生骨折的全身性骨代谢疾病[13]。”因此,任何能够防治骨质疏松症的药物必须是能阻止骨量减少,改善骨显微结构退化和保持骨代谢平衡的药物。骨量、骨代谢生化标志物和骨显微结构的变化因此成为检测骨质疏松症治疗或预防药物的实验指标。而骨密度作为诊断骨质疏松和骨折危险程度的重要指标,目前被认为是反映骨质疏松的黄金标准[14],也是判断药物是否有效的关键指标,其检测结果目前已被广泛应用于临床治疗及动物实验的研究中。
牦牛骨含有多种人体必需元素以及多糖、氨基酸、磷蛋白、软骨素和骨胶原等营养成分,既可直接服用也可以作为补充钙源的添加剂使用,而且牦牛骨中饱和脂肪酸与不饱和脂肪酸的比例接近1∶1,与膳食营养素参考摄入量(DRIs)推荐人体摄入脂肪酸的组成比例相符[15],其促进骨骼发育和骨伤愈合的成分含量远高于一般食草动物的骨骼[16]。
本实验中,血清骨代谢指标的检测结果显示,维甲酸诱导提高了血清中ALP 的活性,增加了血清Ca2+、BGP 含量,证实维甲酸诱导后骨转化增强,与相关的研究相符[17⁃19],也证明本研究中大鼠高转换型骨质疏松模型造模成功。但给药组TRAP 活性高于模型组,可能提示复方牦牛骨粉对维甲酸诱导的骨质疏松大鼠骨吸收无明显抑制作用[20]。在给予不同剂量的复方牦牛骨粉后血清中ALP 活性和BGP 的含量有所下降,同时随给药剂量的增加,血清中的Ca2+含量显著降低,提示骨形成明显增强[21⁃22]。
腰椎和股骨是BMD 以及骨微结构常用的检测部位[23],骨小梁结构是影响骨强度的关键因素[24]。目前有研究表明,BS/TV、BV/TV、Tb.N和Tb.Sp 可能是早期检测骨小梁结构改变的敏感变量,可预示骨质疏松症的发展[25]。也有研究报道BMD 检测与骨微结构检测有一定的相关性[26]。本研究中对大鼠股骨及腰椎进行了BMD 以及骨微结构检测,结果显示,维甲酸诱导可降低大鼠股骨、脊椎以及全身骨密度,并且会导致大鼠股骨及腰椎不同程度的骨量减少。使用复方牦牛骨粉干预治疗后,大鼠BMD 及骨量丢失状况有明显的改善,并且随剂量增高改善程度增强。同时骨量丢失的情况,在给药后也有所好转。
综上所述,本研究表明,复方牦牛骨粉可通过增加骨形成、改善骨代谢的途径防治维甲酸诱导的高转换型骨质疏松症。但是对于复方牦牛骨粉改善骨质疏松症的优势尚不明确。本实验以期为复方牦牛骨粉补钙机制的进一步研究和产品工艺及复方优化提供参考。
