马铃薯腐烂茎线虫Dd-mel-26基因的克隆与功能分析
2021-08-22高波马娟李秀花李焦生王容燕陈书龙
高波 马娟 李秀花 李焦生 王容燕 陈书龙
(河北省农林科学院植物保护研究所 河北省农业有害生物综合防治工程技术研究中心 农业农村部华北北部作物有害生物综合治理 重点实验室 保定 071000)
马铃薯腐烂茎线虫(Ditylenchus destructorThorne,1945)是重要的迁移性植物内寄生线虫,主要为害植物地下部尤其是块根、块茎和球茎等[1-2],也是国内外重要的检疫性线虫[3]。该线虫引起甘薯茎线虫病,给我国的甘薯生产造成严重损失,一般发病田块减产10%-30%,重则达50%-60%,甚至绝产无收[4]。在实际生产中甘薯茎线虫病的防治主要以涕灭威之类的高毒药剂为主,导致农药残留、环境污染以及线虫抗药性的产生。选用抗耐病品种是目前最经济有效且环境友好的方法之一,近些年虽利用传统方法育成了数百个甘薯新品种,其中不乏抗线品种,但往往由于品质欠佳,使得其产业化价值大打折扣[5]。
RNAi技术以其高特异性,绿色安全,无残留,不易产生抗药性,且开发成本远低于化学农药等优点,已成为当前植物病虫害防控领域的研究热点[6]。RNAi技术在植物寄生线虫中的应用也越来越广泛,如通过外源dsRNA递送的方法已成功地对香蕉穿孔线虫[7]、马铃薯腐烂茎线虫[8]、南方根结线虫[9]等线虫的靶基因进行了沉默;通过转基因寄主递送dsRNA的方式也已在马铃薯腐烂茎线虫[10]、南方根结线虫[11-12]、大豆孢囊线虫[13]等线虫中得到成功应用;另外通过植物病毒载体递送dsRNA的方法,也已成功应用到根结线虫的防治研究中[14-15]。因此,RNAi技术在未来植物寄生线虫的防治策略制定和新技术的开发中将扮演着越来越重要的角色。
利用RNAi技术防控植物寄生线虫的靶标基因主要为线虫的管家基因或寄生相关基因,将这些基因沉默后可以有效阻碍线虫侵染寄主植物[16-17]。因此,为获得具有RNAi应用价值的线虫靶标基因资源,我们在前期研究中构建了马铃薯腐烂茎线虫的潜在致死基因库(在秀丽隐杆线虫中RNAi表型为致死或胚胎致死的同源基因),Dd-mel-26(Maternal Effect Lethal)基因即是其中的一员。MEL-26蛋白在秀丽隐杆线虫中主要作为底物特异性适配体蛋白(substrate-specific adaptor protein)来介导泛素连接酶CUL-3(E3连接酶)对底物MEI-1蛋白的泛素化降解,从而对卵细胞由减数分裂转有丝分裂的进程进行调节[18]。此外,MEL-26还参与了秀丽隐杆线虫其他生命进程,如:其可以与CUL-3结合来正调控胞质分裂[19];将该基因敲除/沉默后会导致线虫体壁的横纹肌粗肌丝无法正确组装[20]、细胞分裂时染色体无法正常分离[21]、体长变短[22]、胚胎致死[22-24]、卵无法孵化[25]、高雄性占比[26]以及种群适应性降低[27]等。由此可知,该基因在线虫繁殖、发育和运动中均发挥着重要作用。本研究拟对马铃薯腐烂茎线虫的Dd-mel-26基因进行克隆和功能分析,为开发马铃薯腐烂茎线虫防控新策略与技术研发提供理论支撑。
1 材料与方法
1.1 材料
马铃薯腐烂茎线虫为本实验室保存,分离自河北省卢龙县发病甘薯,为A型种群,室内采用胡萝卜愈伤组织培养法活体保存[28]。
1.2 方法
1.2.1 马铃薯腐烂茎线虫RNA和DNA的提取及cDNA第一链的合成 收集的马铃薯腐烂茎线虫加入Trizol后用冻融法进行充分裂解,再按照TransZolUp Plus RNA Kit(北京全式金)试剂盒说明书进行总RNA的提取。用MiniBEST Universal Genomic DNA Extraction Kit Ver.5.0(大连宝生物)试剂盒,并按照其说明书提取茎线虫的基因组DNA。将获得的RNA用PrimeScriptII 1st Strand cDNA Synthesis Kit(大连宝生物)试剂盒按照说明书合成cDNA第一链。
1.2.2Dd-mel-26基因cDNA及基因组序列扩增与分析 根据马铃薯腐烂茎线虫的Dd-mel-26基因的EST序列设计特异性引物,cDNA序列中间片段扩增引物为mel-26F/mel-26R(表1),扩增试剂为2×EasyTaqPCR SuperMix(全式金),并按试剂说明进行操作。利用经典RACE技术扩增获得两端序列[29-30]。利用引物mel-26GF/mel-26GR(表1)扩增获得Dd-mel-26基因组序列。扩增获得的所有序列片段均经琼脂糖凝胶回收后连接克隆载体pMD18-T,之后转化感受态大肠杆菌DH5α,最后将经筛选获得的阳性克隆送至上海生工进行测序。获得的序列使用DNAMAN、DNAstar软件进行比对拼接,使用NCBI-ORF finder在线进行开放阅读框查找、蛋白翻译;使用NCBI-Blast进行基因同源性分析;使用MEGA6.0邻接法(Neighboor Joining)构建系统发育树;使用在线工具SignalP 4.0 Server(http://www.cbs.dtu.dk/services/SignalP-4.0/)和TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)进行蛋白质信号肽和跨膜结构域预测;使用ProtParam(http://us.expasy.org/tools/protparam.html)预测蛋白质序列理化性质;使用 EBI 的 InterProscan(http://www.ebi.ac.uk/Tools/InterProScan/)预测蛋白质的保守结构域;使 用PSIPRED(http://bioinf.cs.ucl.ac.uk/psipred/)预测蛋白质二级结构;使用SWISS-MODEL(https://swissmodel.expasy.org/interactive)预测蛋白质的三级结构,使用EzMol(www.sbg.bio.ic.ac.uk/ezmol/)进行三维结构重现及分析;使用PSORT II(https://psort.hgc.jp/form2.html)预测蛋白亚细胞定位。使用GSDS2.0(http://gsds.gao-lab.org/)进行基因组结构分析。试验用到的所有引物序列信息均列于表1。
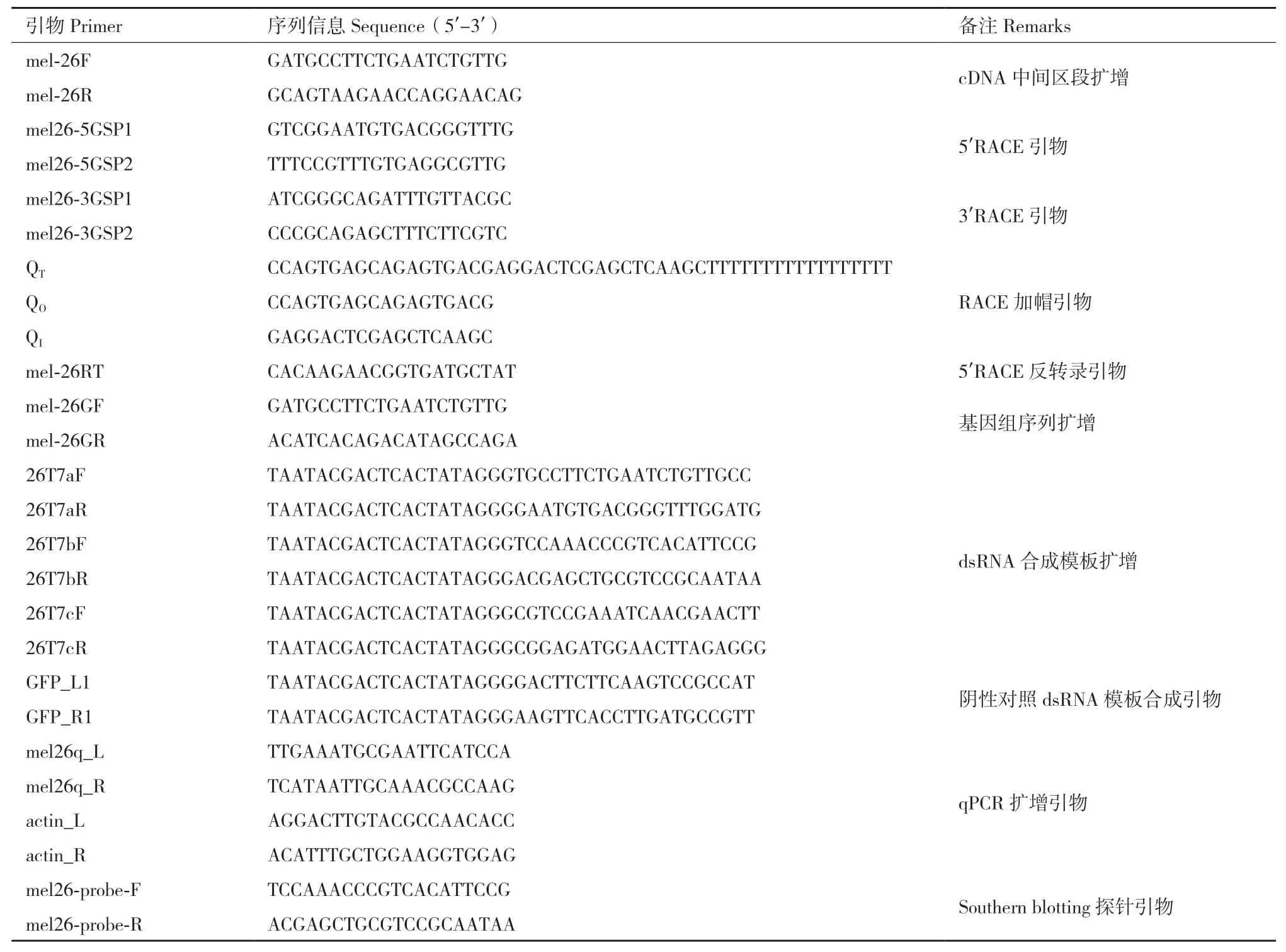
表1 本研究所用引物信息Table 1 Primer information used in this study
1.2.3Dd-mel-26基因在茎线虫基因组中的拷贝数分析 根据Dd-mel-26基因的cDNA和基因组序列信息,设计并合成探针引物mel26-probe-F/mel26-probe-R(表1),线虫基因组的提取方法同1.2.1,基因组酶切使用XbaI、HindIII和EcoR V。Southern杂交采用DIG-High Prime DNA Labeling and Detection Starter Kit I(罗氏)试剂盒,参照彭焕等[8]的方法进行操作。最终显色的杂交膜晾干后用扫描仪进行扫描后保存图片,分析拷贝数。
1.2.4Dd-mel-26基因在茎线虫不同发育时期的表达情况 收集马铃薯腐烂茎线虫卵约10 000个,人工挑取2龄3龄混合期幼虫(J2-J3 mix)、4龄幼虫(J4)、雄虫、雌虫各300头,3次重复。并利用RNAiso Plus(大连宝生物)提取线虫各发育期总RNA,使用EasyScriptAll-in-One First-Strand cDNA Synthesis SuperMix for qPCR(One-Step gDNA Removal)(全式金)合成cDNA第一链,利用TransStartTop Green qPCR SuperMix(全式金)试剂盒进行qPCR,引物序列见列表1,体系为:2×Top Green qPCR SuperMix,10 μL;正反向引物(10 μmol/L)各0.4 μL;cDNA模板1.2 μL;加RNase free H2O至20 μL。qPCR反应在耶拿qTOWER3上运行,程序为94℃ 30 s;94℃ 5 s,57℃ 15 s,72℃ 10 s,40个循环。以卵为参照组,采用2-ΔΔCt法计算不同龄期基因相对表达量。
1.2.5体外诱导Dd-mel-26基因的沉默 dsRNA的合成:分别从Dd-mel-26基因CDS序列的5'端(片段a:358 bp)、中间区域(片段b:410 bp)和3'端(片段c:315 bp)设计靶标片段,并利用T7 RiboMAX Express RNAi System(Promega)试 剂 盒并合成dsRNA,并按照说明书的步骤进行操作。参考李宇等和彭焕等的方法[7-8]刺激线虫取食:M9 buffer(1×),125 μL;5%的间苯二酚,100 μL;加线虫悬浮液至总体积500 μL。25℃,旋转混匀仪上(20 r/min)浸泡处理3 h。用DEPC H2O快速洗涤线虫5次。配制诱导沉默混合液:dsRNA溶液,终浓度1.5 mg/mL;加线虫悬浮液至100 μL。25℃、旋转混匀仪上(20 r/min)浸泡处理24 h,每个处理3个重复,以dsGFP浸泡的线虫作为阴性对照,以DEPC H2O代替dsRNA作为空白对照;之后用DEPC H2O洗涤处理后的线虫5次并用1 mL DEPC H2O悬浮线虫。受不同区段dsRNA浸泡处理的线虫利用1.2.1中的方法提取总RNA,并利用qPCR的方法(同1.2.4)分析受处理线虫靶基因的沉默效率。
1.2.6Dd-mel-26沉默后线虫的生物学表型测定 采用沙柱法分析受处理线虫的垂直迁移力[31-33]。取内径为25 mm、高60 mm 的PVC管,一端包以150目(孔径0.106 mm)的尼龙网纱,在管内填满经高温消毒、且过40目筛(孔径0.38 mm)的干燥沙子。将装有沙子的PVC管垂直立于60 mm培养皿中,皿中加入20 mL水,待沙柱中沙子全部浸透后,从沙柱上端加入300头线虫,每个处理3个重复,室温静置15 h后收集皿中线虫,并统计通过率(线虫通过率=通过的线虫数/300)。采用接种胡萝卜愈伤组织法测定受处理线虫繁殖量[28],每皿接种100头线虫,每处理4个重复,25℃黑暗培养30 d后收集皿中线虫并进行计数。
1.2.7 统计学分析 采用DPS v6.55软件进行数据分析,并用单因素方差分析及Turkey法分析不同处理的差异显著性。不同处理间字母相同代表两处理间的差异不显著(P>0.05),反之,则差异显著 (P<0.05)。
2 结果
2.1 Dd-mel-26基因cDNA及基因组序列扩增与 分析
Dd-mel-26基因cDNA的两端及中间片段电泳图见图1-A,1-B和1-C,基因组DNA的扩增结果见图1-D。Dd-mel-26基因cDNA全长为1 594 bp(Gen-Bank登录号:MZ158305),包含一个1 158 bp的开放阅读框,预测编码一个含385个氨基酸的蛋白质,分子量为43.52 kD,等电点为5.4,其5' 非翻译区(UTR)序列长为86 bp,并存在一个反式剪接引导序列 SL1(GGT TTA ATT ACC CAA GTT TGA G),3' UTR长为350 bp,并含有加尾信号AATAAA。测得Dd-mel-26基因组序列长2 824 bp(GenBank登录号:MZ190837),基因组结构中包含10个外显子和9个内含子序列(图2),且符合GU/AG的剪接规律,9个内含子中有4个内含子的3'端发现了UUUCAG序列,在所有9个内含子的3'端-5位点均为尿嘧啶碱基(U)。

图1 马铃薯腐烂线虫Dd-mel-26 cDNA及其基因组序列扩增结果Fig. 1 Amplification results of the cDNA and genomic sequence of Dd-mel-26

图2 Dd-mel-26基因组结构图Fig. 2 Genome structure of Dd-mel-26
InterProscan分析结果显示Dd-MEL-26蛋白含有两个保守的功能结构域MATH(Meprin-Associated Traf Homology) 和BTB(Bric-à-brac/ Tramtrack/ Broad complex),分别位于氨基酸序列的36-158 aa和187-294 aa区段。SignalP 和TMHMM 软件分析显示该蛋白不具有信号肽和跨膜结构域,PSORT II软件预测该蛋白定位于细胞核中,PSIPRED对该蛋白的二级结构分析结果显示(图3),该蛋白在N端MATH保守结构域区域有8个β折叠股(strand)和2个α螺旋(helix)结构,而在C端的BTB保守结构域有5个α螺旋和3个β折叠股结构。通过SWISS-MODEL进行了同源建模,模板比对结果显示与SWISS-MODEL模板库中ID为3hu6.1的蛋白同源性最高为34.8%,以此为模板构建了MEL-26蛋白的三级结构图(图4),GMQE值为0.48,QMEN值为-2.41,说明Dd-MEL-26的三维结构与模板蛋白匹配度较高。通过三维结构可以看出,Dd-MEL-26蛋白以同源二聚体形式存在,两个单体分别命名为26_A和26_B。其中结构的上半部分富含β折叠股的蝶状结构为MATH功能结构域所在的部位(MATH_A和MATH_B),下半部分富含α螺旋的碟状结构为BTB功能结构域所在的部位(BTB_A和BTB_B),在BTB保守结构域结束后紧跟着两个α螺旋结构为3-box结构域(图4红色部分)
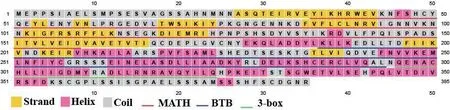
图3 Dd-MEL-26蛋白的二级结构预测图Fig. 3 Predicted secondary structure of Dd-MEL-26 protein

图4 Dd-MEL-26蛋白的三级结构图Fig. 4 Tertiary structure of Dd-MEL-26 protein
2.2 Dd-mel-26基因的系统进化分析
基于Dd-MEL-26蛋白的氨基酸序列进行系统进化分析,结果(图5)显示所有线虫被分为了4组,其中植物寄生线虫、食细菌线虫和昆虫病原线虫均单独聚为1组,而动物寄生线虫则分为了两个亚组。马铃薯腐烂茎线虫的Dd-MEL-26蛋白与植物寄生线虫象耳豆根结线虫(M. enterolobii)、冲绳伞滑刃线虫(Bursaphelenchus okinawaensis)和松材线虫(B. xylophilus)聚为一组,其中与象耳豆根结线虫的同源性最高达76.14%,与另两个植物病原线虫的同源性为(66.54±0.79)%。另外,Dd-MEL-26与食细菌线虫的同源性为(63.05±0.77)%,与动物寄生线虫A亚组的同源性为(70.52±1.13)%,而与B亚组的同源性为(62.88±1.27)%。

图5 基于Dd-mel-26基因的氨基酸序列利用邻接法构建的系统发育树Fig. 5 Neighbor-Joining tree calculated from the sequences of Dd-mel-26 amino acid sequence
2.3 Dd-mel-26基因在茎线虫基因组中的拷贝数 分析
Southern杂交结果(图6)显示用EcoRV和XbaI酶切的基因组泳道中只出现一条带,而Hind III酶切的基因组泳道中出现了两条带,通过分析探针序列及其对应的基因组序列发现探针序列所对应的基因组序列中有一个Hind III酶切位点,从而导致了杂交结果为两条带,综合以上分析可得Dd-mel-26在基因组中为单拷贝基因。

图6 Dd-mel-26基因的Southern杂交结果图Fig. 6 Southern blotting results of Dd-mel-26 gene
2.4 Dd-mel-26基因在茎线虫不同发育时期的表达情况
对马铃薯腐烂茎线虫不同发育时期Dd-mel-26基因的相对表达量进行分析发现(图7),Dd-mel-26基因在卵中的相对表达量最高,且显著高于其他几个发育时期,其次为雌雄成虫,最低为二龄和三龄期混合线虫(J2-J3 mix),但从二龄到成虫的4个发育时期中该基因的相对表达量差异不显著。
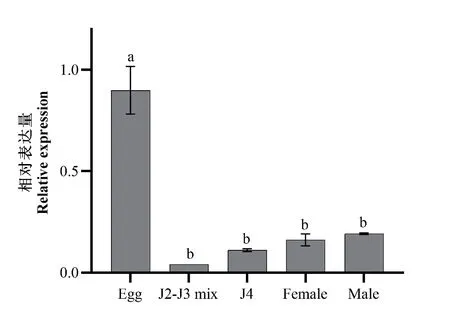
图7 马铃薯腐烂茎线虫不同发育时期Dd-mel-26基因的相对表达量Fig. 7 Relative expressions of Dd-mel-26 gene at different developmental stages of D. destructor
2.5 Dd-mel-26基因不同区段dsRNA诱导RNAi沉默效率分析
用Dd-mel-26的3个片段dsRNA处理线虫24 h后,qPCR结果(图8)显示靶基因的沉默效率最高的为b段和c段dsRNA处理线虫,分别下调了55.8%和55.6%,而受a段dsRNA处理的线虫靶基因仅下调了12.8%,与空白对照组相比不显著。因此,沉默效率最高的为b段dsRNA。
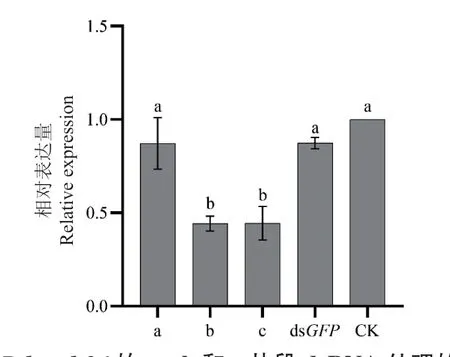
图8 受Dd-mel-26的a、b和c片段dsRNA处理的线虫Dd-mel-26的相对表达量Fig. 8 Relative expressions of Dd-mel-26 after treatment with dsRNA of fragments a,b and c of Dd-mel-26
2.6 Dd-mel-26沉默后线虫的生物学表型分析
用Dd-mel-26基因b段dsRNA处理线虫24 h后,靶基因相对表达量显著降低,达51.4%(图9-A);受处理线虫的沙柱通过率显著地高于空白对照组,提高约31.8%(图9-B);线虫繁殖量则显著地高于空白对照组,提高约28%(图9-C)。而GFP阴性对照组与空白对照组差异不显著。
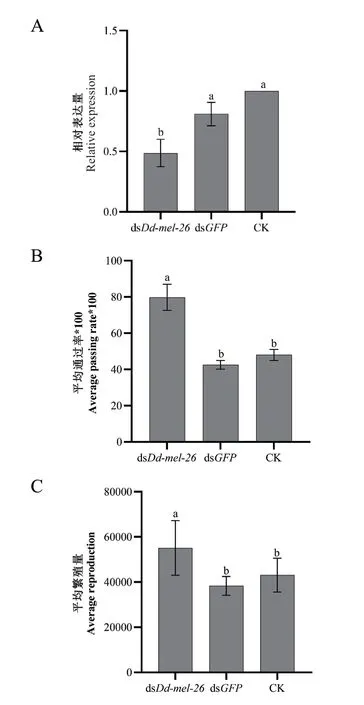
图9 受Dd-mel-26 dsRNA处理线虫靶基因的相对表达量(A)、沙柱平均通过率(B)及其平均繁殖量(C)Fig. 9 Relative expressions of target gene(A),average passing rate in sand column(B),and average reproduction(C)in the Dd-mel-26 dsRNA-treated nematodes
3 讨论
马铃薯腐烂茎线虫在我国主要为害甘薯,是我国甘薯生产中的一种重要的病原线虫。为更深入地了解马铃薯腐烂茎线虫并寻找具有RNAi应用价值的靶标基因资源,本研究对马铃薯腐烂茎线虫的一个潜在致死基因底物特异性适配体基因Dd-mel-26的全长cDNA序列进行了克隆和功能分析,发现该基因在基因组中为单拷贝,与象耳豆根结线虫的亲缘关系最近。预测该蛋白可能主要以二聚体形式在细胞核中发挥作用,将该基因沉默后线虫的繁殖量增加,垂直移动能力增强,另外,该基因在卵中的表达量最高。
马铃薯腐烂茎线虫的Dd-mel-26基因的基因组序列9个内含子中,有4个内含子的3'端发现了UUUCAG序列,在所有9个内含子的3'端负5位点均为尿嘧啶碱基(U),与Blumenthal等[34]在秀丽隐杆线虫中的研究结果基本一致。这些保守的嘧啶碱基在3'剪切位点的正确选择中发挥着重要的作用[35-36]。Dd-mel-26的内含子中有3个的序列长度小于50 bp,据报道这种短序列内含子是线虫所特有的[34],而在其它的脊椎动物中是无法进行剪切的[37]。另外,Gorlova等[38]研究显示基因内含子的数量在10以内时则内含子数量与基因的保守性呈正相关,而当大于10时则基因的保守性不再随内含子数量发生改变。本研究中Dd-mel-26基因的基因组序列中含有9个内含子,说明该基因的保守性比较强。结合该基因在基因组中为单拷贝的结果,推测该基因应该属于一种管家基因。
马铃薯腐烂茎线虫Dd-MEL-26的系统发育分析显示其与植物寄生线虫聚为一组,但其与动物寄生线虫A亚组的同源性却比与植物寄生线虫冲绳伞滑刃线虫与松材线虫的同源性高,这可能是因为象耳豆根结线虫与植物寄生线虫冲绳伞滑刃线虫与松材线虫的同源性(67.07±0.97)%高于与动物寄生线虫A亚组的同源性(66.07±0.60)%,而同时马铃薯腐烂茎线虫与象耳豆根结线虫的同源性76.14%又显著高于其与动物寄生线虫A亚组的同源性(70.52±1.13)%,所以综合以上因素MEGA软件将马铃薯腐烂茎线虫与植物寄生线虫聚为一组的结果是可靠的。这也从另一个角度证明了该基因在不同种线虫间的高度保守性。另外,马铃薯腐烂茎线虫和象耳豆根结线虫均属于垫刃目,而冲绳伞滑刃线虫与松材线虫则均属于滑刃目,这也可能是造成马铃薯腐烂茎线虫与这两种线虫的同源性较象耳豆根结线虫低的原因。
马铃薯腐烂茎线虫Dd-MEL-26蛋白含有MATH和BTB两个保守结构域,与秀丽隐杆线虫的MEL-26蛋 白 一 致[18,39],属 于MATH-BTB蛋 白 家 族。Dd-MEL-26蛋白MATH结构域区域有8个β折叠股,BTB结构域区域有5个α螺旋和3个β折叠股的二级结构组成,均符合该家族蛋白的共同特征[40],其三维结构以二聚体形式存在,亦与秀丽隐杆线虫和拟南芥中对MATH-BTB蛋白的三维结构研究结果一致[41-42]。另外,Dd-MEL-26的三维结构中紧跟在BTB结构域后面存在一个类似“3-box”的结构,与Zhuang等[43]研究结果一致,其研究发现MATHBTB蛋白SPOP以二聚体形式与CUL-3蛋白(E3连接酶)结合,而“3-box”结构的存在能使这种结合更稳固。
MEL-26蛋白主要在性腺和受精的胚胎中被检测到[39],且在刚受精胚胎的16细胞期仍处于高水平表达状态,而到64细胞期则降到很低的水平[26]。本研究中Dd-mel-26在卵中高水平表达,而在其他虫态时表达水平较低,亦与前人研究结果一致。说明Dd-mel-26主要在马铃薯腐烂茎线虫的胚胎发育早期发挥重要作用。
秀丽隐杆线虫MEL-26蛋白在胚胎早期发育、细胞分裂以及肌肉形成中都发挥着重要的作 用[18,20-21,40],将其敲除后会导致线虫出现胚胎致死、卵无法孵化、体长变短、高雄性占比以及种群适应性降低等表型[22-27]。因此,预测该基因在马铃薯腐烂茎线虫中应该也有类似的功能。将该基因沉默后对马铃薯腐烂茎线虫的繁殖和迁移均应该有较大的抑制作用,而本研究中将Dd-mel-26基因沉默后其繁殖量及沙柱通过率均显著增加,与预期不符,原因可能是:(1)目前对于mel-26基因的研究还仅在模式线虫秀丽隐杆线虫中,在其它线虫尤其是植物寄生线虫中还未有研究,因此该基因的功能是否与模式线虫的完全一致还不清楚;(2)秀丽隐杆线虫的基因功能研究可以通过基因敲除或饲喂表达dsRNA的细菌来稳定持久的沉默线虫的靶基因[44],而利用体外dsRNA浸泡法对马铃薯腐烂茎线虫靶基因的沉默具有一定的时效性[8,45],且往往只能对幼虫和成虫进行基因沉默,无法对线虫全生育期尤其卵的靶基因进行沉默,而本研究中Dd-mel-26基因恰恰是在卵中表达量最高;(3)Li等[46]发现一种E3连接酶(RLE-1)被敲除后可以延长秀丽隐杆线虫的寿命,而MEL-26在蛋白泛素化降解中亦是通过与CUL-3蛋白(E3连接酶)结合来发挥作用[44],因此,mel-26基因被敲除后可能也有同样的效应,而在另一项研究证明将秀丽隐杆线虫的mel-26基因敲除后确实可以延长线虫的寿命[44]。本研究中将该基因沉默后导致线虫的繁殖量增加可能也是此原因造成的,线虫寿命的增加一方面会拉长其繁殖期,另一方面会降低死亡率,最终使得线虫的总繁殖量超出正常水平;(4)有研究显示将mel-26敲除或过表达均会导致秀丽隐杆线虫的肌肉发育异常[20],因此,维持正常的肌肉发育可能需要mel-26基因的表达处于一定的平衡范围内,而本研究对该基因的部分沉默可能打破了这种平衡从而对马铃薯腐烂茎线虫的肌肉组织产生了刺激效应,最终表现出对沙柱的通过率显著提高。
通过对马铃薯腐烂茎线虫致死基因的研究,可以为利用RNAi技术来防治植物寄生线虫提供靶标基因资源。本研究对马铃薯腐烂茎线虫Dd-mel-26的研究虽未能抑制茎线虫的繁殖和垂直移动,但明确了该基因在马铃薯腐烂茎线虫的繁殖和垂直移动中发挥着重要的作用,也显示出体外浸泡法诱导线虫基因沉默的方法具有一定的局限性,即其时效性和无法实现对卵中靶基因的沉默。也提示我们今后在对抗线靶基因资源的筛选中选择寄主介导的基因沉默,或通过提高dsRNA的稳定性延长其饲喂时间从而得到更稳定持久可靠的RNAi表型,从而推动RNAi技术在植物寄生线虫防控中的应用。
4 结论
马铃薯腐烂茎线虫Dd-mel-26基因在基因组中为单拷贝属于管家基因的一种,其与象耳豆根结线虫的亲缘关系最近,主要在胚胎发育早期发挥作用,且在一定条件下可以正调控马铃薯腐烂茎线虫的繁殖和垂直移动,但将该基因做为RNAi靶标可能需要更加深入的研究。
