miR-203介导TNFα调控牙周膜干细胞成骨分化*
2021-08-19袁清敏冯保静王国庆刘会娟王献利
袁清敏 冯保静 王国庆 刘会娟 王献利
牙周炎作为一种高发病率的慢性炎症疾病,是成年人牙齿脱落的主要原因[1,2]。近年来PDLSCs已被证明在小鼠移植时可形成异位牙骨质/韧带样复合体[3]。因此,研究炎症微环境下PDLSCs成骨分化的分子机制具有重要意义。研究表明,肿瘤坏死因子(Tumor necrosis factor-α,TNFα的过度释放会导致牙周和骨组织的损伤,如牙槽骨缺损、牙槽窝缺损、牙支持组织缺损等[4]。此外,研究证实TNFα可抑制牙周膜干细胞的成骨向分化[5]。因此,深入研究炎症微环境下hPDLSCs成骨向分化的调控机制在牙周膜干细胞的临床应用具有重要作用。
MicroRNAs(miRNAs)已被证明参与调节人骨髓间充质干细胞的成脂和成骨分化[6]。我们前期研究也发现miR-203可通过靶向调控RUNX2进而抑制牙周膜干细胞成骨向分化能力[7]。然而炎症状态下miR-203对hPDLSCs成骨向分化的影响及其作用机制尚不明确。研究证实miR-203通过抑制TNFα及IL-24促炎因子的表达,从而抑制皮肤免疫反应[8],表明在细胞分化过程中TNFα和miRNA之间存在潜在调控关系。因此,我们推测miR-203可能通过调控TNFα参与炎症状态下hPDLSCs的成骨分化。本研究将探索miR-203在炎症微环境下对PDLSCs成骨向分化能力的影响及其机制,以期为牙周炎骨缺损提供新的机制和潜在的治疗靶点。
1.材料和方法
1.1 实验材料 胎牛血清(Gibco,美国);胰蛋白酶(Hyclone,美国);TNFα(Peprotech,美国);α-MEM培养基(Hyclone,美国);低温高速离心机(Eppendorf,德国),酶联免疫检测仪(BIO-TEK,美国);离心机(Eppendorf,德国);Ⅰ型胶原酶、地塞米松、β-甘油磷酸钠、维生素C(Sigma,美国),RUNX2、ALP、OCN、OPN、TNFα及β-actin引物(生工,中国),cDNA合成试剂盒、SYBR Green试剂盒(Takara,日本);miR-203 mimics、miR-203 inhibitor(锐博,中国);Lipofectamine 2000(Invitrogen,美国);TNFα ELISA试剂盒(碧云天,中国);双萤光素酶报告基因检测试剂盒(碧云天,中国)。
1.2 细胞培养、转染及矿化诱导 收集口腔颌面外科18-24岁志愿者即刻拔除的前磨牙或第三磨牙,要求牙齿健康完整,拔除牙齿在无菌条件下充分冲洗,并用手术刀片分离出牙齿根中段牙周膜组织,加入500μL浓度为4mg/L的Ⅰ型胶原酶37℃消化45min,每15min重悬一次,用完全培养基(含10%胎牛血清的α-MEM培养液)重悬并接种于6孔板中,于细胞培养孵箱内培养,待细胞长至80%融合率时,有限稀释法挑选细胞单克隆株,传代扩大培养后用于后续实验。细胞饥饿培养12h后,按照预实验得到的病毒滴度与细胞比例加入病例液(MOI=10),12h后更换培养基,培养48h后荧光显微镜下观察绿色荧光蛋白表达情况,并通过qPCR鉴定转染效率。
取P3代hPDLSCs消化、计数,以1.5×105个/孔的细胞密度接种于6孔培养板中,分为矿化诱导组和对照组(未矿化诱导组),待细胞长至80%融合率时,更换为成骨诱导液(完全培养基、50mg/L维生素C、10nmol/L地塞米松和10mmol/L β-甘油磷酸钠),诱导2周后通过qRCR检测TNFα及成骨相关基因表达。
1.3 实时定量聚合酶链反应(qRCR)检测mRNA的表达 取P3代hPDLSCs消化、计数,以1.5×105个/孔的细胞密度接种于6孔培养板中,待细胞长至80%融合率时,更换为成骨诱导液,并添加TNFα和miR-203作为刺激因素,实验分为TNFα组(20ng/ml)、对 照 组、TNFα+miR-203组 及TNFα+miR-203 inhibitor组培养2周后,提取细胞总RNA,按照Prime Script™RT reagent Kit(Takara生物公司,日本)说明书逆转录合成cDNA。
q-PCR反应根据SYBR®Premix Ex TaqTM(Takara生物公司,日本)说明书操作,miR‑203上游引物为:5′-GUGAAAUGUUUAGGACCACUAG-3′,下游引物为:5′-CCAGUGGUUCUUAACAGUUCAAC-3′;内参U6上游引物为:5′-CTCGCTTCGGCAGCACA-3′,下 游 引 物 为:5′-AACGCTTCACGAATTTGCGT-3′;TNFα上游引物为:5′-CCGGGCAACAATGTCCAAAAG-3′,下游引物为:5′-AGGACGACTGTTCAGCACG-3′;RUNX2上游 引 物 为:5′-GGGTAAGACTGGTCATAGGACC-3′,下游引物为:5′-CCCAGTATGAGAGTAGGTGTCC-3′;OCN上游 引物为:5′-GCCGAGGTGATAGTGTGGTT-3′,下 游 引 物 为:5′-ACTCCTCGCTTTCCATGTGT-3′;ALP上游引物为:5′-CCCACCTCAGGCTATGCTA-3′,下游引物为:5′-CACTGGGCAGACAGTCAGAA-3′;内参β‑actin上 游 引 物 为:5′-AAAGACCTGTACGCCAACAC-3′,下游引物为:5′-GTCATACTCCTGCTTGCTGAT-3′。
1.4 茜素红检测miR-203及TNFα对hPDLSCs成骨分化能力的影响 取P3代hPDLSCs消化、计数,以1.5×105个/孔的细胞密度接种于6孔培养板中,待细胞长至80%融合率时,更换为成骨诱导液,并分为TNFα组(20ng/ml)、对照组、TNFα+miR-203组及TNFα+miR-203 inhibitor组,诱导2周后进行茜素红染色:PBS轻柔漂洗细胞3次,弃PBS后加入4%的多聚甲醛固定细胞20min;弃多聚甲醛固定液,PBS轻柔漂洗细胞3次,弃PBS后加入茜素红染液染色10min;PBS洗去残留的茜素红染液,显微镜下观察并记录钙化结节的形成;加入10%氯化十六烷基吡啶孵育15min,充分释放出染色的茜素红,酶标仪检测各组562nm处的OD值,以OD值作茜素红染色定量分析。
1.5 双荧光素酶报告基因实验参照Lipofectamine 2000(Invitrogen,美国)说明书对hPDLSCs进行转染,转染筛选后48h后用于后续实验。利用生物信息学预测发现TNFα为miR-203的潜在靶基因,为确定miR-203靶向结合于TNFα的3′UTR区,将TNFα突变型(TNFα-MUT)和野生型(TNFα-WT)3′UTR合成,并连接到psiCHENK-2载体质粒。在hPDLSCs中共转染miR-203 mimics、miR-203-NC和TNFα质粒,转染48h后冰上裂解细胞,检测萤火虫和海肾荧光素酶荧光强度并进行分析。
1.6 酶联免疫吸附试验(ELISA实验)按照ELISA试剂盒(碧云天,中国)说明书步骤检测TNFα组(20ng/ml)、对照组、TNFα+miR-203组及TNFα+miR-203 inhibitor组细胞上清液中TNFα水平,TNFα因子被固相捕获后通过酶标仪检测450nm处的吸光度值,绘制标准曲线,对照样品吸光度值,即可计算出靶蛋白浓度。
1.7 统计学分析 采用Graph 5.0软件对数据进行统计学分析,计量资料以均数±标准差表示,组间比较采用t检验或one-way ANOVA单因素方差分析,P<0.05表示差异有统计学意义。通过样品的吸光度值和标准曲线计算出样品的相应浓度。
2.结果
2.1 牙周膜干细胞分化前后TNFα和成骨相关基因的表达 原代培养的细胞呈长梭形,围绕组织块呈放射状排列(1A);通过茜素红染色对牙周膜干细胞矿化能力进行鉴定(1B);qPCR检测hPDLSCs分化前后TNFα和成骨基因mRNA的表达水平,结果显示:hPDLSCs分化后TNFα的表达水平与对照组相比显著下调(图1C),而RUNX2、ALP、OCN、OPN的表达水平则明显升高(图1D),差异有统计学意义。
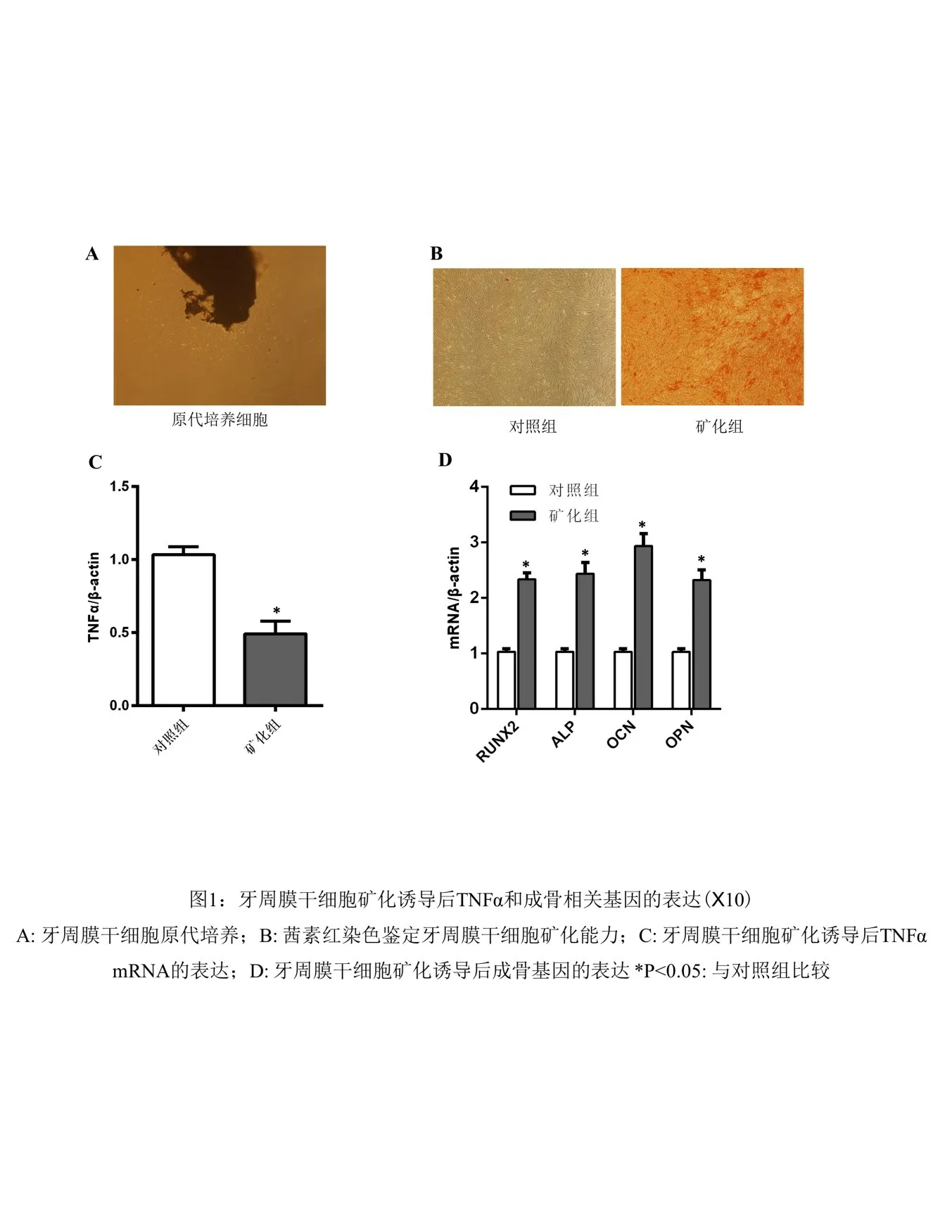
图1 牙周膜干细胞矿化诱导后TNFα和成骨相关基因的表达(×10)
2.2 TNFα对牙周膜干细胞成骨分化能力及miR-203影响TNFα(20ng/ml)刺激牙周膜干细胞后通过茜素红染色及qPCR检测细胞成骨分化和miR‑203表达情况,qPCR结果显示TNFα刺激后牙周膜干细胞中成骨相关基因RUNX2、ALP、OPN、OCN mRNA的表达水平显著下调,而miR‑203的表达则明显上调,差异有统计学意义(P<0.05)(图2)。茜素红结果显示TNFα刺激后牙周膜干细胞中的矿化结节比对照组明显较少,差异有统计学意义(P<0.05)(图2)。
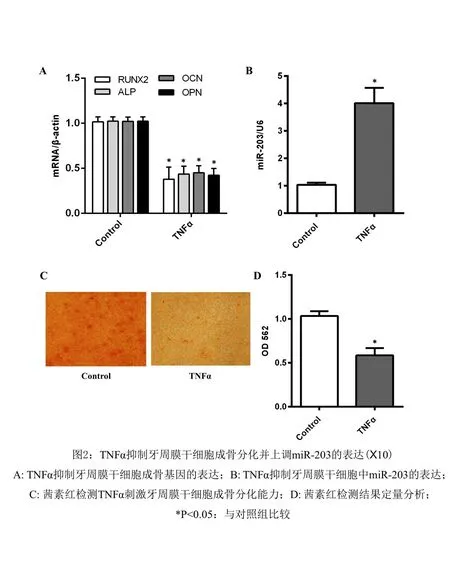
图2 TNFα抑制牙周膜干细胞成骨分化并上调miR-203的表达(×10)
2.3 miR-203 inhibitor逆转TNFα对牙周膜干细胞成骨能力的抑制作用miR-203转染牙周膜干细胞48h后可见细胞表达绿色荧光蛋白(图3A)。qPCR验证牙周膜干细胞转染qPCR验证牙周膜干细胞转染miR-203 inhibitor和miR-203 mimics效果,结果显示miR-203 mimics组中miR‑203的表达显著增加,而miR-203 inhibitor组结果相反,差异有统计学意义(P<0.05)(图3B)。TNFα刺激牙周膜干细胞并转染miR-203后矿化诱导2周,结果显示TNFα对牙周膜干细胞成骨能力有明显抑制作用,而miR-203 inhibitor组则可逆转TNFα对牙周膜干细胞成骨能力的抑制作用,而miR-203 mimics组则进一步抑制牙周膜干细胞成骨能力,差异有统计学意义(P<0.05)(图3C-E)。
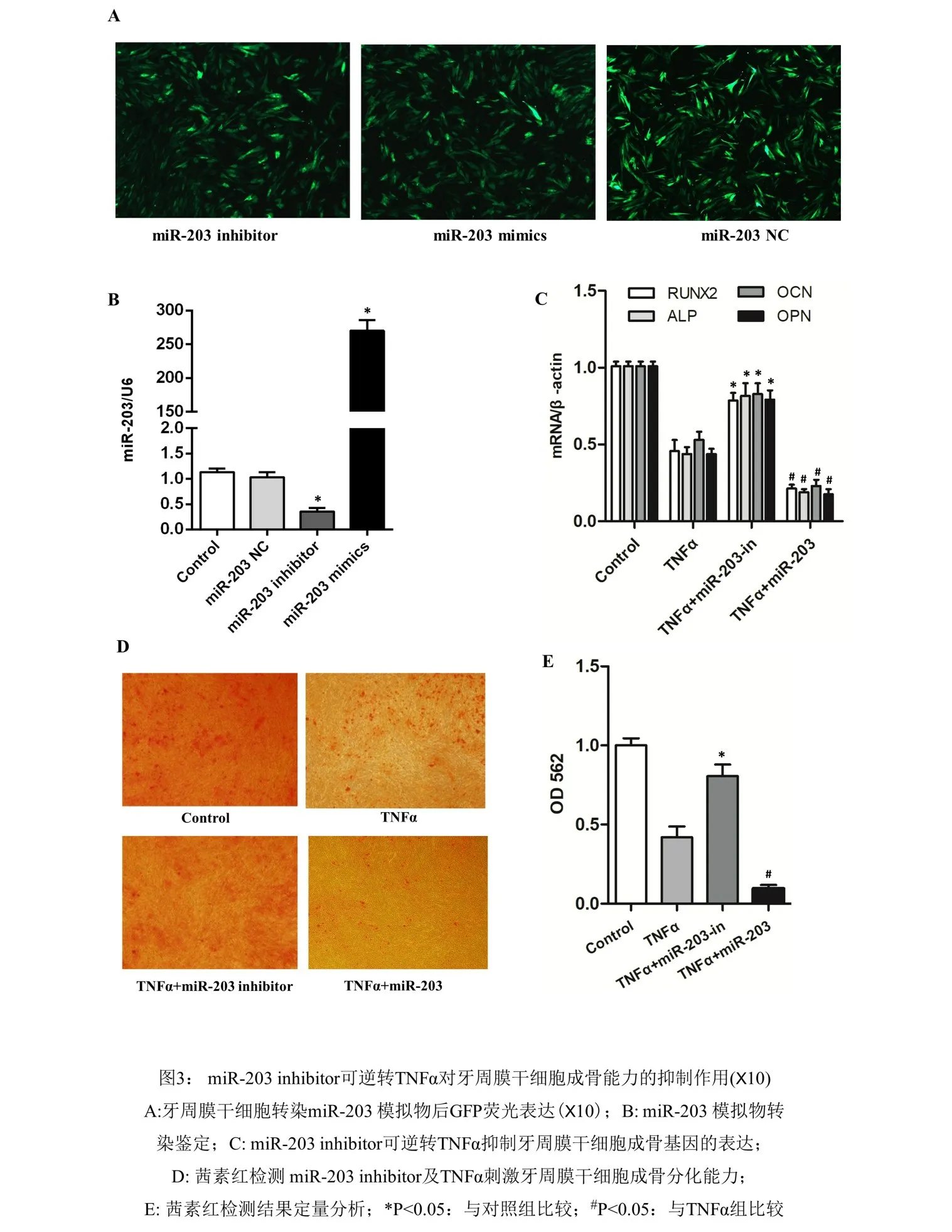
图3 miR-203 inhibitor可逆转TNFα对牙周膜干细胞成骨能力的抑制作用(×10)
2.4 TNFα为miR-203的靶基因 通过生物信息学网站预测TNFα为miR-203的潜在靶基因,miR-203转染后通过qPCR及ELISA实验检测hPDLSCs中TNFα水平,结果显示miR-203 mimics组中的TNFα mRNA和蛋白表达水平明显低于对照组,而miR-203 inhibitor则结果相反(图4),说明TNFα可被miR-203负向调控。双荧光素酶报告基因实验结果显示TNFα-WT+miR-203组的荧光比值显著低于TNFα-WT+miR-NC组,差异有统计学意义(图4)(P<0.05);而TNFα-MUT+miR-203组和TNFα-MUT+miR-NC组的荧光比值相比较差异无统计学意义(P>0.05)。结果进一步确认TNFα是miR-203的靶基因,表明miR-203可与TNFα的3′-UTR区上的位点结合,并直接负向调控TNFα基因。
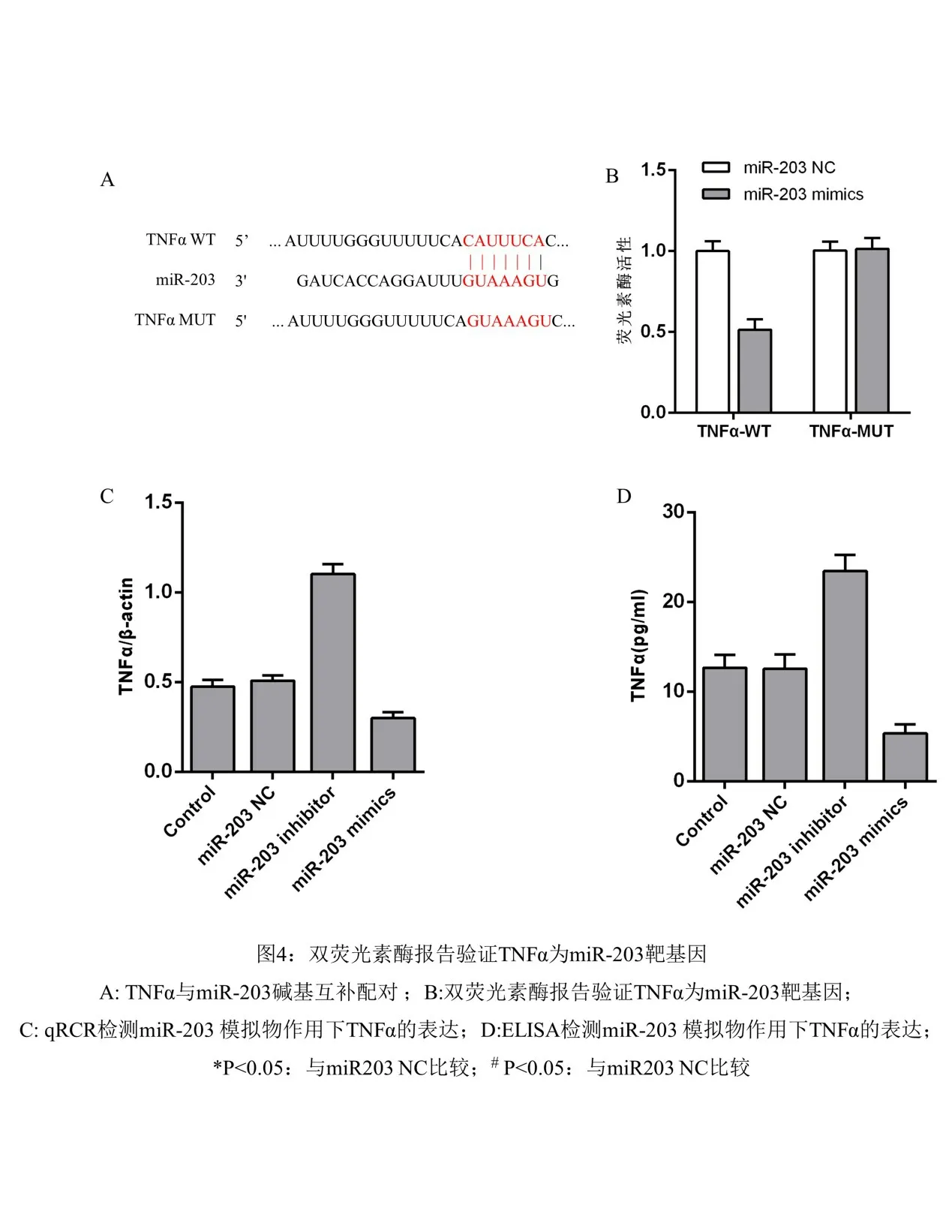
图4 双荧光素酶报告验证TNFα为miR-203靶基因
3.讨论
牙周炎发病过程中,炎症不仅影响骨吸收和破骨细胞活性,而且还会抑制牙周膜干细胞形成新的牙周结缔组织牙槽骨的能力[9]。研究表明炎性微环境可能导致干细胞功能缺失[10]。因此,PDLSCs成骨分化能力降低可能与牙周炎的发病机制有关[11]。研究发现与正常PDLSCs相比,炎症来源的PDLSCs多向分化能力明显减弱[2]。但炎症微环境下PDLSCs分化能力降低的机制尚不清楚。研究发现miR-203负向调节TNFα及白细胞介素-24(IL24)等关键细胞促炎因子,进而抑制皮肤免疫反应。而我们前期研究表明抑制miR-203表达后可促进牙周膜干细胞成骨向分化,此外我们还发现miR-203可与RUNX2的3′-UTR区上的位点结合,表明miR-203与RUNX2存在直接负向调控关系。而RUNX2作为一种成骨向分化特异性转录因子,能调控众多与成骨相关基因的转录[12]。因此,我们推断miR-203在炎症微环境下调控PDLSCs成骨向分化发挥着关键作用。
决定细胞命运相关的分子机制包括特定的信号通路和特定的转录因子,这些转录因子被细胞外信号顺序激活。而在决定细胞命运的过程中,miRNAs是信号网络和基因重编程不可或缺的调节因子。研究表明miRNAs是介导细胞分化的调节因子,靶向调控这些miRNAs可能是治疗炎症性疾病的一种十分具有前景的方法[13]。牙周炎作为一种慢性炎症环境,我们预测它可能具有与正常生理状态不同的miRNA表达谱。基于这一假设,我们检测了hPDLSCs成骨分化过程中差异表达的miRNAs。结果显示,正常情况下hPDLSCs在成骨分化过程中,miR-203及miR-124表达明显上调[7,14]。而本研究发现在TNFα诱导的炎性微环境下,miR-203在hPDLSCs成骨分化过程中表达水平上调,提示miR-203可能在炎症微环境下具有调控PDLSCs成骨分化的重要作用。研究发现TNFα是导致牙周炎的主要细胞因子之一,TNFα水平的升高被证实与牙周病的严重程度和免疫反应有关[15]。TNFα可通过抑制骨形成和促进骨吸收促进牙周炎的发生[16]。然而,也有报道称TNFα能促进人骨髓间充质干细胞的成骨分化,并证明TNFα通过增强肌肉源性基质细胞的募集和分化促进骨折修复[17]。因此,TNFα在干细胞成骨分化中的作用是复杂的、双相的。大量研究显示TNFα体外刺激牙周膜干细胞的浓度在10-100ng/ml之间,多数文献选择的刺激浓度是10-20ng/ml[16,18,19]。本实验通过预实验检测了0、10、20、50、100ng/ml TNFα对牙周膜干细胞中成骨相关基因的影响,发现20ng/ml TNFα可显著下调成骨基因,故本实验选择了20ng/ml作为刺激浓度。为研究miR-203调节炎症微环境下PDLSC成骨分化潜在的分子机制,我们寻找与miR-203相关的潜在成骨目标基因,发现miR-203可靶向调控Runx2进而抑制牙周膜干细胞成骨向分化[7]。此外,我们还发现TNFα也可被miR-203靶向调控,结果与文献报道相一致[8]。值得注意的是,miR-203在PDLSCs炎症微环境中显著上调,而高表达miR-203则抑制TNFα的产生,从而形成了miR-203-TNFα负反馈循环。此外,双荧光素酶报告实验证实TNFα含有miR-203结合位点,该位点位于3′-UTR中并与miR-203序列互补,这意味着miR-203可靶向TNFα进而调控PDLSCs的成骨向分化。
本研究首次探索了炎症微环境下miR-203对hPDLSCs成骨分化能力的影响,研究结果显示TNFα刺激下可上调hPDLSCs中miR-203的表达并抑制hPDLSCs的成骨分化能力,两者的表达呈负相关。此外,在TNFα诱导的炎症微环境下抑制miR-203的表达可逆转TNFα对hPDLSCs成骨向分化的抑制作用。双荧光素酶报告实验进一步证实TNFα是hPDLSCs中miR-203的直接靶点。miR-203可以直接靶向TNFα负向调控PDLSCs成骨向分化。值得注意的是,在炎症环境中TNFα可以通过靶向miR-203形成负反馈循环,从而抑制PDLSC的成骨向分化。这些结果提示miR-203/TNFα功能轴形成的负反馈环路在炎症微环境下hPDLSC的成骨分化过程中发挥关键作用。综上,本研究证实了在炎症微环境下TNFα通过靶向miR-203负向调控hPDLSCs的成骨向分化能力,提示miR-203具有重建牙周炎损伤的牙周组织的潜力,研究为牙周炎和其他炎症性疾病的治疗策略提供分子基础。
