EPL/PCL/HA复合支架修复兔颅骨骨缺损的实验研究*
2021-08-19田彬江青松张振庭
田彬 江青松 张振庭
由肿瘤、外伤、先天性畸形以及老年性骨质疏松等导致的骨组织缺损,是发生于颅颌面部的常见问题[1]。骨组织缺陷的修复与重建主要依赖于骨移植替代材料。随着组织工程各学科的发展,人工合成骨替代材料逐渐得到临床的认可。口腔颌面部由于存在与外界相通的窦腔的解剖特点,增加了骨移植术后感染的风险,因此,骨组织工程学的研究集中于开发可以预防潜在感染风险同时具有良好的成骨能力的理想的骨组织工程材料[2]。
ε-多聚赖氨酸(ε-poly-lysine,EPL)是由链霉菌天然产生的阳离子多肽[3]。它易溶于水,可以分解为赖氨酸或胺,酰胺,羟基或羧基,从而促进细胞粘附和生长[4]。重要的是,EPL具有广谱的抗菌活性,可生物降解,并且对人类无毒[5],因而被广泛应用于食物防腐、制药、材料表面改性及基础研究细胞培养等领域。但以往的文献报道中并未见将EPL应用于骨组织工程复合支架的研究报道。
我们前期的研究已通过FDM-3D(熔融沉积成型-3D)打印技术成功构建了具有EPL涂层的3D结构纳米级聚己内酯/羟基磷灰石(EPL/PCL/HA)复合支架[6]。前期的体外实验证实,EPL涂层的3D结构EPL/PCL/HA支架具有抗菌性能,还可以促进成骨细胞的成骨分化。然而,EPL/PCL/HA支架的动物体内骨缺损修复作用仍不清楚。本实验将EPL/PCL/HA复合支架植入兔颅骨临界骨缺损模型,观察其在体内是否可以促进骨缺损的成骨。
1.材料与方法
1.1 主要试剂、实验仪器和动物 纳米羟基磷灰石(HA)(昆山华侨科技新材料有限公司),聚己内酯(PCL)(深圳市易生新材料有限公司),ε-多聚赖氨酸(EPL)(郑州拜纳佛生物工程有限公司)。OLYMPUS倒置光学/荧光显微镜(OLYMPUS BX61,日本),种植机(诺瓦格MD20)。
20只雄性4-6月龄,体重3.0±0.5千克的普通级新西兰白兔,实验动物的使用已通过首都医科大学附属北京口腔医院研究所实验动物伦理委员会审查通过(伦理号:KQYY-201803-002)。
1.2 PCL支 架、PCL/HA复 合 支 架 及EPL/PCL/HA复合支架的制备3D PCL支架和3D PCL/HA复合支架由江阴瑞康健生物医学科技有限公司通过自行开发的熔融沉积成型仪打印制作而成[6]。简要步骤如下:
PCL/HA支架采用聚己内酯与羟基磷灰石(PCL和HA混合比例7∶3)为原材料,搅拌器搅拌均匀混合,然后使用熔融沉积建模(FDM)系统构建PCL/HA支架。计算机编写相关程序设定参数后,微型挤出机系统通过沉积喷嘴以熔融形式输出PCL/HA支架,制成直径为300μm,间距为450μm的3D支架。PCL支架仅用PCL作为原材料打印。支架打印完成后钴60辐照灭菌,密封包装备用。
将PCL/HA支架浸入5mg/ml EPL溶液(EPL溶于无菌去离子水,制成浓度为5mg/ml的EPL水溶液),24小时后,吸出溶液。支架在无菌干燥箱中干燥,完成EPL/PCL/HA支架的制备。并密封于无菌存储器中备用。
1.3 支架的动物体内植入实验 将舒泰10mg/kg和速新眠II 0.2ml/kg混合后肌肉注射,全身麻醉实验兔。麻醉起效后,颅顶区备皮,消毒,铺巾。沿颅中线做4cm矢状切口,剥离皮下组织及骨膜,暴露骨面。在低速旋转和大量生理盐水冷却下,颅顶区制备四个圆形直径6mm的全层骨缺损。骨缺损中心点距中缝5mm连线,与中缝交点处球钻制备凹坑至松质骨层,填入金属钉做参考标记点(方便以后结果测量及分析时骨缺损中心点的确定)。然后以四个中心点为标志使用外径为6mm的取骨环钻制备四个圆形全层骨缺损,保证下方硬脑膜完整。骨缺损分为四组:1.BC,空白对照组;2.PCL组;3.PCL/HA组;4.EPL/PCL/HA组。根据分组填充对应的复合支架,空白对照组不填入任何材料,仅以新鲜出血形成的血凝块充盈骨缺损(图1)。没有使用额外膜覆盖。严密对位缝合术区骨膜,分层缝合皮下组织和皮肤。消毒皮肤。在手术后即刻和手术后48h内肌肉注射青霉素(10万U/kg),并密切观察头颅手术区恢复情况。
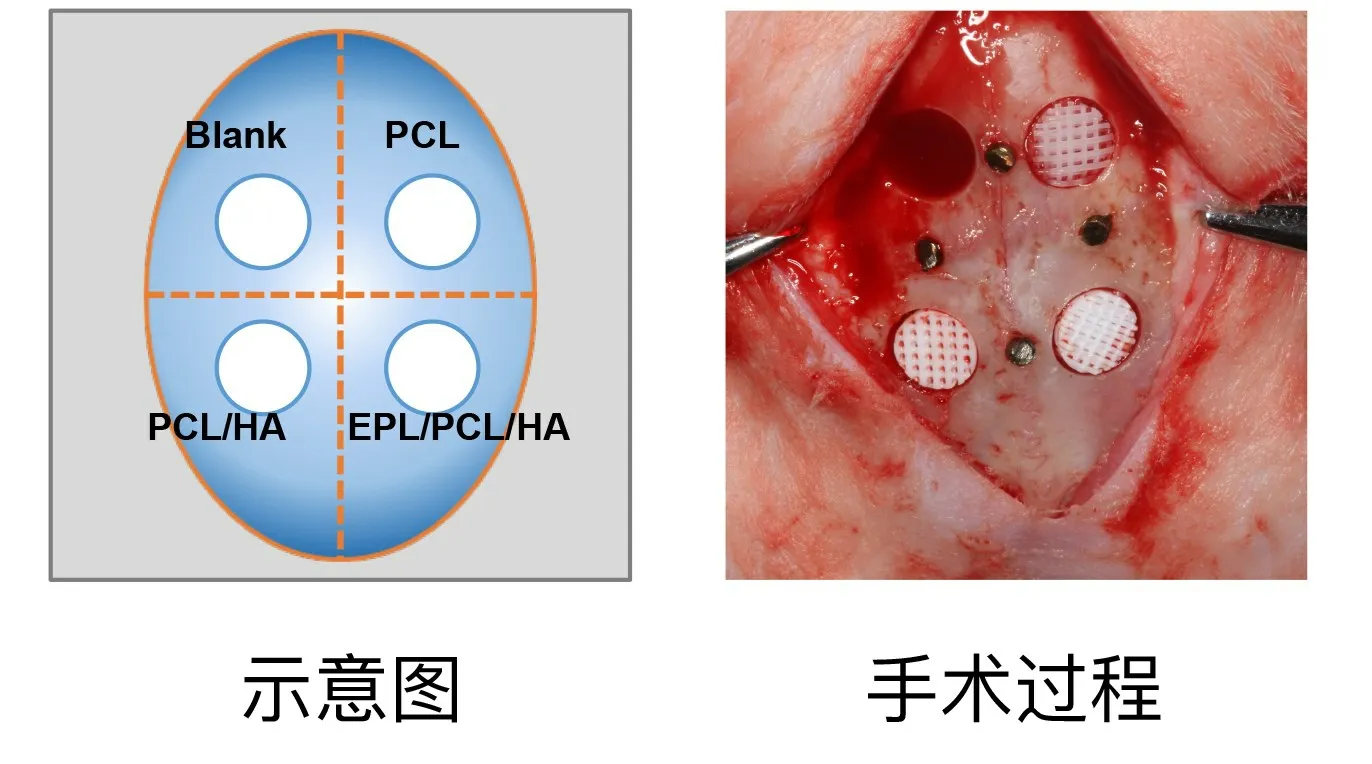
图1 兔颅骨制备4个6 mm直径的标准骨缺损,填入不同成骨材料示意图及手术过程图。
1.4 荧光标记及标本制取 动物处死前13、14天耳缘静脉注射10mg/ml钙黄绿素荧光注射液,动物处死前3、4d耳缘静脉注射10mg/ml茜素红荧光注射液。实验动物随机分为2组,每组10只,分别于术后4周、8周处死,取颅顶骨标本。
1.5 影相学检测 颅骨标本,大体观察完成后,常规固定,通过微型计算机断层扫描(micro-CT:Siemens Inveon Micro,德国)系统对其进行360度旋转扫描。数据在Micro-CT自带软件中进行三维重建,观察骨缺损的愈合情况。
1.6 脱钙标本组织学切片及不脱钙磨片的制取 经过缺损中心分切标本,平均分成2份。一份行脱钙处理,切片行HE染色及Masson染色;另一份行脱水处理,制备硬组织磨片。标本在共聚焦显微镜下观察钙黄绿素、茜素红相应的激发荧光,分别观察到绿色和红色的自发荧光,采集图像。然后,用甲苯胺蓝对磨片进行染色,在显微镜下观察并拍片。确定以下组织形态学参数:新骨面积比(%)=(新形成的骨面积,mm2)/(总面积,mm2)×100(%)。
1.7 统计分析 采用SPSS 20.0统计软件进行数据分析,计量资料以“均数±标准差”表示,统计方法采用ANOVA单因素方差分析比较各组间及组内差异,P<0.05认为差异有统计学意义。
2.结果
2.1 术后观察及标本大体观察 所有手术均顺利完成,头颅伤口恢复良好,手术区域未出现感染、及伤口裂开等并发症,无一例动物死亡,均可参加实验数据统计。
所取标本肉眼观察均可见骨缺损处覆盖纤维软组织,如图2所示。术后4周标本,触摸骨缺损处,所有空白对照组的骨缺损处组织都较软,边缘清晰;放置支架组较空白对照组略硬,边界模糊。术后8周,空白对照组,触摸较软,边界变模糊。PCL组骨缺损处支架材料变软,骨缺损处边界不明显。PCL/HA组和EPL/PCL/HA组骨缺损处无明确边界,缺损区质地较硬。
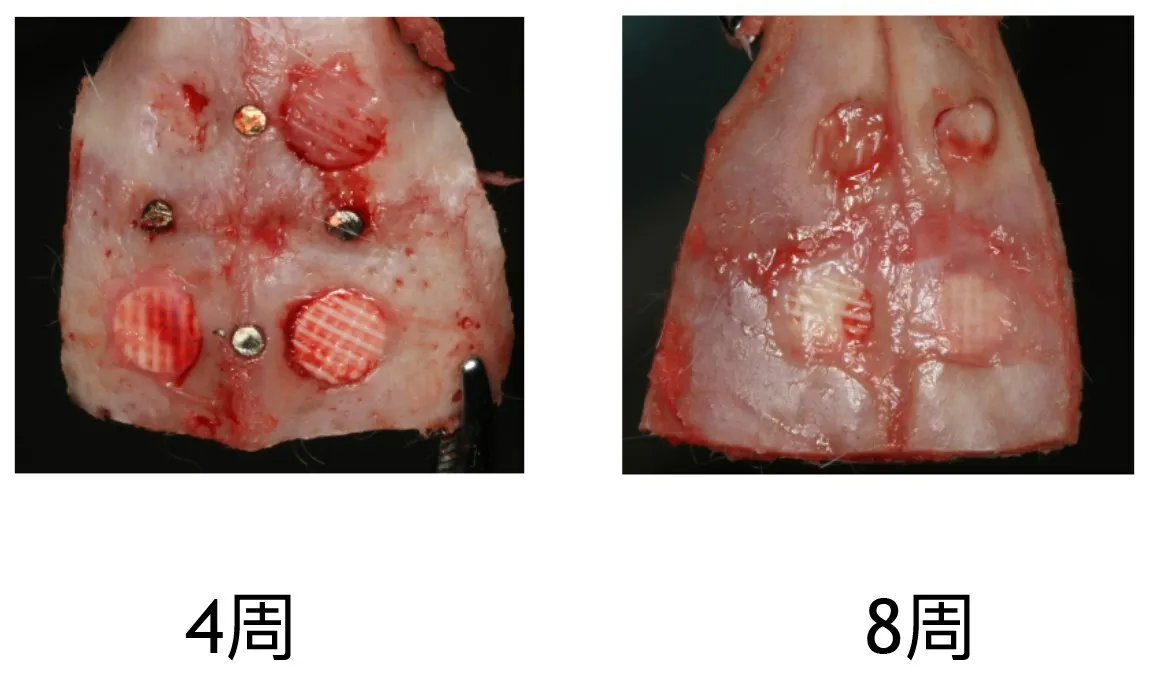
图2 手术后4周及8周的骨组织样本大体观
2.2 CT结果Micro-CT扫描数据进行三维重建,结果见图3。对数据进行分析,Micro-CT分析中,骨体积分数(BoneVolume/TotalVolume,BV/TV)表示骨组织体积与组织体积比值,可直接反应骨量变化情况。用BV/TV对新生骨组织进行定量分析,四周时,EPL/PCL/HA组和PCL/HA组中新生骨显著多于PCL组及BC组,EPL/PCL/HA组与PCL/HA组差别不大。术后8周时,与4周相比,各组新生骨均有所增加,四组新生骨组织量均有显著性差异,EPL/PCL/HA>PCL/HA>PCL>BC,EPL/PCL/HA组中新生骨在所有组中是最多的(图四)。

图3 手术后4周及8周的骨组织样本Micro-CT三维重建图及骨体积分数(BV/TV)统计分析
2.3 脱钙切片的组织形态学检测(HE染色,Masson染色)HE染色和Masson染色用于评估缺损区域的骨再生情况。结果表明,新生的矿化组织为骨样组织。在第4周,空白组和PCL组中从缺损周围向中心的新形成的骨组织非常有限。在PCL/HA和EPL/PCL/HA组中检测到更多的新骨形成,EPL/PCL/HA组有最多的新骨形成。当植入时间延长至8周时,空白组仅形成了少量新骨,在放置支架的三组中均比4周对应组有更多新形成的骨。在EPL/PCL/HA组中观察到的新骨形成量最高,这表明EPL/PCL/HA支架具有强大的骨缺损修复能力(图4,图5)。
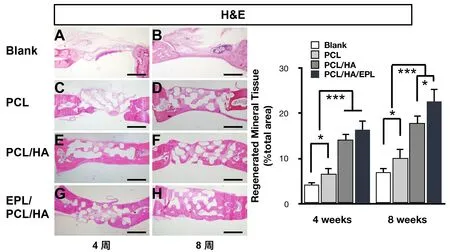
图4 手术后4周及8周的骨组织样本切片HE染色(×40)及新生骨组织面积的统计分析

图5 手术后4周及8周的骨组织样本切片Masson染色(×40)及新生骨组织面积的统计分析
2.4不脱钙磨片的荧光检测与组织形态学检测
2.4.1 不脱钙磨片的荧光检测 在激光共聚焦显微镜下分别拍摄2种荧光条带并获得融合照片,新生骨组织螯合钙黄绿素而呈现出亮绿色,螯合茜素红而呈现为红色。用Image J图像分析软件通过读取荧光显微镜图片的灰度值来进行统计学分析。4周时,结果显示BC组中没有明显的新生矿化物组织形成,而PCL、PCL/HA和EPL/PCL/HA组的缺损边缘处形成了少量不规则和不对称的新生矿化骨组织,并且支架的形状得到了很好的维护(图6 A,C,E,G),且没有迹象显示骨代用品的吸收或溶解。EPL/PCL/HA组和PCL/HA组中新生骨显著多于PCL组及BC组,EPL/PCL/HA组与PCL/HA组差别不大。8周时,放置支架的三组中新生的矿化物组织形成的数量均显著增加。支架材料的表面逐渐被新的矿物组织所替代(图6 B,D,F,H)。数据分析显示,在EPL/PCL/HA组中形成了新的矿物质组织最多,随后是PCL/HA和PCL组。最低的新矿物组织形成发生在BC组中(图6)。
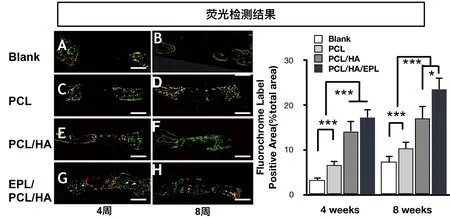
图6 手术后4周及8周的骨组织样本磨片荧光检测(×40)及新生骨组织面积的统计分析
2.4.2 不脱钙磨片的组织形态学检测 如图7所示,甲苯胺蓝染色结果表明,骨缺损边缘的新生骨组织被染成蓝色,也有少量在骨缺损的中心区形成的新生骨组织被染成蓝色。图六的荧光染色中的亮绿色及红色标记与染色结果中新生骨组织位置基本一致。统计学结果表明,在兔颅骨骨缺损植入后第4和第8周,与空白组和PCL组相比,EPL/PCL/HA和PCL/HA组中出现了更多的新生矿物组织形成(图7A-H)。此外,EPL/PCL/HA组中新矿化组织的百分比在第8周时显著高于其他三组(图7)。
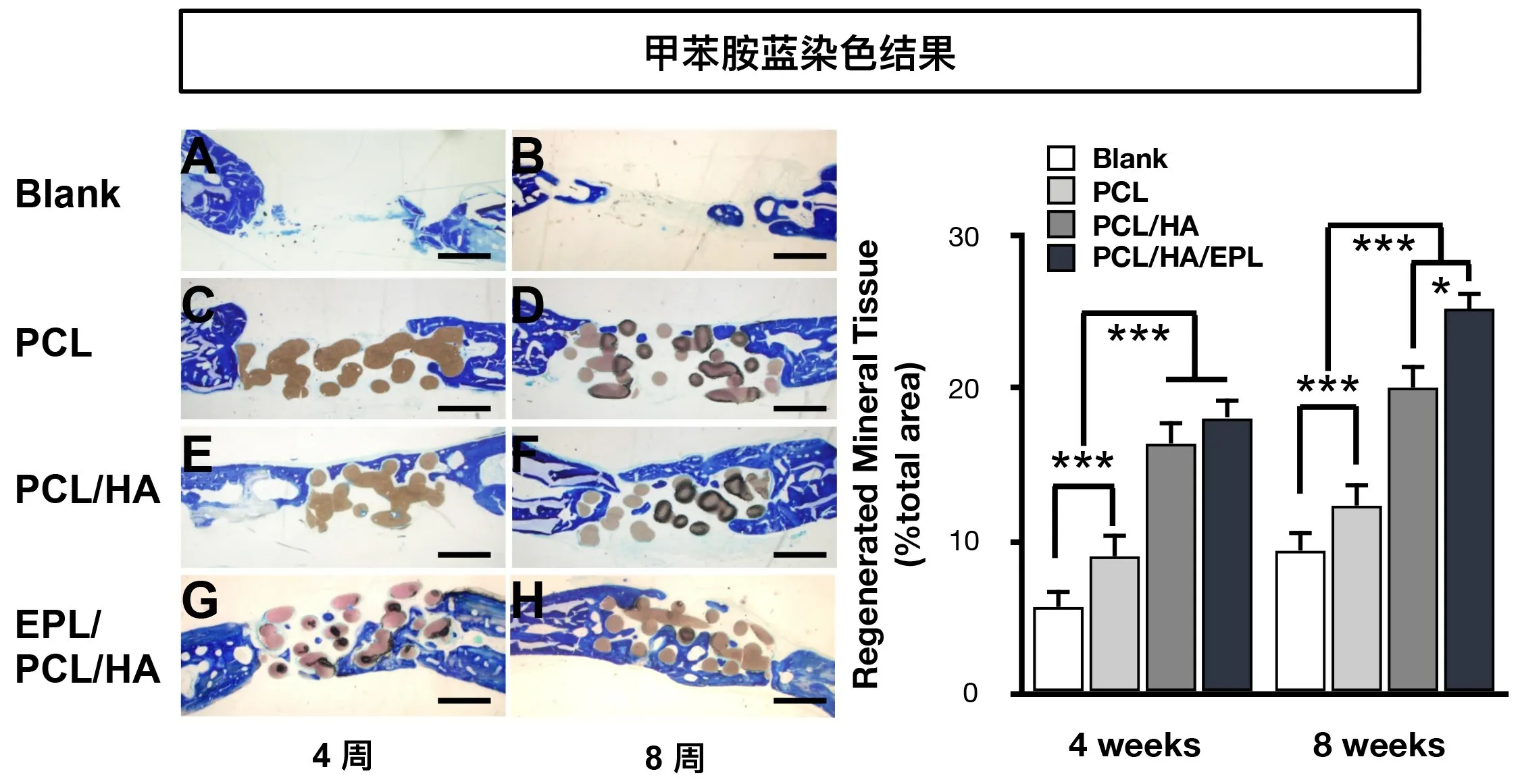
图7 手术后4周及8周的骨组织样本磨片甲苯胺蓝染色(×40)及新生骨组织面积的统计分析
3.讨论
本研究通过熔融沉积成型(FDM)技术,将纳米羟基磷灰石与聚己内酯成功的制备了具有仿生多孔结构的PCL/HA支架,然后在此基础上负载ε-多聚赖氨酸,形成EPL/PCL/HA复合支架。课题组前期的体外实验已经证实,EPL/PCL/HA支架具有抗菌性能,还可以促进成骨细胞的成骨分化[6]。本研究将支架运用于兔颅骨骨缺损的修复,从大体解剖、影像学及组织病理学等方面观察其动物体内的促成骨能力,从而获得一种具有潜在抗感染功能有具有骨诱导性的骨组织替代物的新型组织工程骨。
3.1 实验动物模型的选择 兔的生长周期短,颅骨与颌骨的胚胎学的同源性,颅骨手术操作方便,可重复性好,因而兔颅骨缺损是研究颅颌面部骨缺损的动物模型中最为常用的。
对于兔颅骨的临界骨缺损的尺寸有多种理论[7],我们综合各种观点后进行了前期实验验证,选择了以直径6mm全层骨缺损做为本实验的动物模型。我们的实验结果显示,在手术后4周和8周,空白对照组新生骨百分比均少于10%,反应出我们采用制作的6mm圆形贯通颅骨缺损符合临界骨缺损的要求。此外实验结果进行micro-CT、不脱钙组织磨片的显微荧光分析,以及多种的组织学评价结果分析,放置支架的三组骨缺损形成的新骨均明显多于空白对照组。由此说明我们的组织工程支架对于骨缺损的修复是有明确意义的。
3.2 3D打印复合材料的优势 由单一组分加工而成的骨组织工程支架难以实现复杂的临床条件下的骨再生要求。近年来,学者们着力于将几种组分材料通过简单可行的方法复合,从而集中几种材料的优势,形成的复合型支架材料,更好的促进骨缺损的愈合。
羟基磷灰石是自然骨的主要无机部分,具有良好的生物相容性和骨传导性。但羟基磷灰石生物陶瓷脆性高、抗折强度低。聚己内酯(Polycaprolactone,PCL)是一种人工高分子材料。PCL由于其生物可吸收性、力学性能优良、熔点较低、低温成型等,是优秀的3D打印材料,因而常用作FDM技术制造材料。但是其机械强度低不能够满足骨组织工程支架的需求。本实验中,我们将羟基磷灰石与聚己内酯以3∶7的比例混合,然后使用FDM技术进行三维支架的打印,因而PCL/HA复合支架综合了两种材料的优点。
支架材料影响支架的性能,而支架的结构更是影响其成功的重要的因素。成功的支架取决于它的孔隙率、孔结构、力学性能和其表面化学性质[8]。支架需要具有高的孔隙率和贯穿性以支持细胞的黏附和增殖,同时方便营养物质和代谢废物的转移[9]。传统的支架制造方法包括粒子沥滤法、溶剂浇铸法、气体诱导发泡法、纤维网格粘结法、溶液浇铸法、阶段分离法和冷冻干燥法等等[10],这些传统的支架制造方法制造的生物支架内部结构随机,不可控,批次之间无法形成统一的结构。熔融沉积成型(FDM)属于快速成型技术,在3D打印技术的辅助下,对材料孔径、孔隙率调控的同时将几种材料融合整合了几种成分材料的优势。本研究采用3D-FDM打印技术制备的PCL/HA支架保证了其多孔状结构,表面形态整齐,孔径规整均匀,连通性好。本实验的结果中4周及8周时,PCL/HA组及EPL/PCL/HA组均可观察到缺损中心区域成骨,而空白对照组仅观察到从骨缺损边缘向中央方向开始形成新生骨,缺损中央未见新生骨。证明了本研究通过FDM技术打印的3D支架达到了组织工程支架的要求,有利于骨组织的细胞及血管向支架内部生长,使缺损中心区域成骨。
对实验组数据进一步分析,4周时PCL/HA组与EPL/PCL/HA支架组新骨形成量没有显著性差异,但两组明显高于PCL组。此结果说明组织工程支架由于HA的加入对成骨有明显的促进作用。8周时PCL/HA组与EPL/PCL/HA支架组仍然明显高于PCL,但这两组间也存在显著性差异,EPL/PCL/HA支架组明显高于PCL/HA支架组。这个结果说明打印出的PCL/HA支架被EPL表面改性后,有抗菌功能的EPL的添加并没有影响骨组织生长而是更加促进了成骨。
3.3 EPL的促成骨作用 如何预防骨移植后造成手术失败的最主要的原因——感染的发生,是材料学、组织工程学等相关学科领域共同关注的难题。全身应用抗生素存在感染位点药物浓度低、用药时间长、易产生抗药性等缺点。因此,对于骨缺损修复的感染的控制,寻找既促进成骨又有局部抗感染能力的骨替代物成为当前研究的热点。
提高骨组织工程支架的骨传导性的主要手段有对支架材料进行表面改性,以增强其对细胞的亲和力。在我们的研究中,用ε-多聚赖氨酸修饰PCL/HA支架,除了增加了支架的抗菌功能,同时达到对支架表面进行改性的目的。先前的研究发现,EPL作用于细胞膜和蛋白质合成系统以及通过与核糖体结合来抑制蛋白质和酶的合成,抑制细菌的呼吸作用,而具有抗菌功能。那么EPL的加入是否会影响骨缺损区域的成骨呢?
在我们的实验结果中,4周时EPL/PCL/HA支架和PCL/HA支架促成骨作用相似,而8周时EPL/PCL/HA支架组新骨形成最多,促成骨作用最好。可以说明EPL对支架表面的改性并没有影响成骨。
EPL是一类可通过体内的水解或酶解反应最终降解为可被人体吸收的小分子氨基酸的可生物降解高分子聚合物,因而具有良好的生物相容性。EPL促进细胞生长、增殖的作用机制可能有几点。1.通过EPL带的阳离子与组织细胞表面或细胞外基质的特异阴离子产生的的交联作用,增加细胞与黏附表面的亲和性。EPL能通过静电吸引等作用,避免细胞聚集成球状,使细胞在材料上黏附并铺展为单层,明显提高了三维条件下的细胞黏附效率[11]。2.EPL修饰过的PCL/HA支架表面亲水性增强,表面正电荷增多,吸附组织液和血清中层的粘连蛋白和纤维粘连蛋白,容易保持支架的结构[12]。3.EPL与细胞磷脂双层有直接的相互作用,材料表面的活性提高了,从而增加细胞的黏附[13]。4.前期实验中扫描电镜高放大倍数下观察到EPL/PCL/HA支架纤维表面呈微粗糙状,说明经EPL处理后支架表面变的粗糙,提高了细胞在材料上的黏附[6]。
通过实验证明我们制作的EPL/PCL/HA支架材料因为其良好的宏观和微观的三位孔隙结构,表面改性后利于细胞粘附,组织再生,具有良好的生物相容性及促成骨性能。EPL/PCL/HA支架可以增强骨缺损的修复能力。我们的结果表明,EPL/PCL/HA是骨组织工程的有希望的替代品。
鉴于体内研究的观察时间较短,EPL/PCL/HA支架用于骨缺损的修复效果仍有待于更长观察时间的评价,此外EPL对PCL/HA支架的表面改性的机理及促成骨机理也是该材料值得进一步研究的方向。
