TNF-α刺激下人牙周膜干细胞对CD3+T细胞功能的影响*
2021-08-19刘娜李影王燕一张维刘洪臣
刘娜 李影 王燕一 张维 刘洪臣
近些年间充质干细胞(Mesenchymal stem cells,MSCs)免疫调节能力受到广泛关注,其可以与体内微环境互相影响,分泌多种细胞因子从而发挥调控作用[1,2]。PDLSCs作为MSCs的一种同源性的干细胞,其免疫调节能力与间充质干细胞相似,关于PDLSCs的免疫调节功能越来越受到关注[3]。近期相关研究结果表明炎症微环境下PDLSCs的免疫调节能力也会降低[4]。Wada等的研究发现人牙周膜干细胞能通过分泌可溶性因子介导免疫调节功能[5]。
T细胞能够产生细胞免疫应答,是适应性免疫系统的主要细胞。免疫细胞在体外活化以后可以分泌IFNγ、TNFα等可溶性因子,能够启动MSCs的免疫抑制程序,从而导致IDO、iNOS等蛋白的大量分泌,它们的酶活性产物抑制了免疫细胞的功能及增殖[6-8]。此外,有研究表明在牙周组织的破坏及牙槽骨吸收中T细胞扮演重要的角色。Tian M等发现在慢性牙周炎患者外周血T淋巴细胞中PD-1和PDL-1呈高表达,其能够通过负性免疫调节效应来增强炎症反应,从而促进牙槽骨的吸收和破坏[9]。
然而,T细胞参与牙周炎发生发展及其与PDLSCs之间相互作用的机制尚不明确。本实验将通过外源性人重组肿瘤坏死因子构建体外炎症微环境,刺激PDLSCs,并与CD3+T细胞共培养,检测PDLSCs对CD3+T细胞生物学功能的影响。
1.材料方法
1.1 样本来源 从解放军总医院第一医学中心口腔颌面外科门诊收集健康第三磨牙。所有患者身体健康,无近期急性感染及服药史。患者年龄在20-35岁之间,样本量共8例。另外,从解放军总医院第一医学中心输血科获取人外周血白膜层细胞浓缩血样,所有捐献者身体健康,无半年内用药史及系统性疾病。样本量共8例。本研究经中国人民解放军总医院伦理委员会批准(批准号:IACUC-2016067),所有患者均签署了知情同意书。
1.2 人牙周膜干细胞分离培养 将本课题组获取的新鲜离体牙样本,使用无菌镊子将牙齿倒置,用提前配置的PBS(含1%青链霉素,北京Solarbio)小心冲洗5-7次,刮取根中1/3部分牙周膜,用眼科剪将组织小心剪碎,然后置于盛有5mL预制PBS的15mL离心管中,在室温下使用水平离心机800r/min离心5min。使用胰酶消化法(1mL EDTA-胰蛋白酶消化液(北京Solarbio)消化2-4min后终止消化)处理组织碎块,同样的转速离心5min后加入5mL含血清α-MEM培养液(含1%青链霉素、10%FBS,美国Gibco)重悬,置于直径10cm的无菌培养皿中,放入孵箱连续培养7d左右,倒置显微镜下可见形似成纤维细胞的纺锤形细胞爬出。待细胞长至80%汇合时传代。采用有限稀释法进行克隆培养分离培养人牙周膜干细胞,具体方法步骤参考本课题组前期工作[10]。
本课题组从人健康离体牙样本中分离培养出健康牙周膜干细胞标记为:H-PDLSCs(Healthy-Periodontal ligament stem cells);本课题组将H-PDLSCs采用10ng/mL的TNFα(美国,Peprotech)提前刺激24h作为炎症诱导条件下的牙周膜干细胞,标记为:I-PDLSCs(Inflammatory-Periodontal ligament stem cells)。
1.3 CD3+T细胞的体外分离培养 将全血白膜层10mL加等量预冷PBS稀释,缓慢加入20mL人外周血淋巴细胞分离液(天津灏洋生物技术有限公司),离心(2000rpm,15min)。白膜层吸取物用PBS(加入5mL的RPMI1640培养液,美国Gibco)洗2次,沉淀物富含单个核细胞,进行细胞计数。调整细胞密度1×107/100μL按照说明书(德国MiltenyiBiotec GmbH)流程进行CD3+T细胞提取:按照107细胞添加10μL CD3e-biotin试剂并混匀;置于4℃避光孵育10min,加入预制冷却的PBS清洗后离心弃上清;加入1mL预制冷却的PBS重悬,每107细胞添加20μL anti-biotin磁珠混匀,重复上述孵育及清洗离心步骤,弃上清;重悬后使用适量预制缓冲液润湿细胞分选柱,然后用1mL预制缓冲液加力冲洗2次;将分选柱撤离磁力架后预制缓冲液冲洗2次,可获得CD3+T细胞。随后进行CD3+T细胞的培养及活化:T细胞计数后分选适量的细胞置于离心管中,一部分按照实验所需浓度加入配制的RPMI 1640刺激液4mL,调整细胞密度为8×105/100uL,另一部分加入配制的RPMI 1640培养液,分别混合均匀后置于两个直径6cm的培养皿中,标记,放入37℃,5%CO2孵箱内进行培养,用于下步实验。
1.4 PDLSCs与CD3+T细胞共培养 将第三代PDLSCs消化后重悬后进行细胞计数:8×104/100μL,采用48孔板(美国,Corning),每孔液体量400μL,每孔CD3+T细胞的数量均为8×105个,PDLSCs与CD3+T细 胞 的 比 例 为1∶1、1∶10、1∶20、1∶50、1∶100[11,12]。共培养时间为48h。10ng/mL的TNFα(美国,Peprotech)提前刺激H-PDLSCs 24h作为I-PDLSCs,在刺激24h后PBS清洗3遍随后按比例加入相应的CD3+T细胞。
1.5 实时定量PCR检测CD3+T细胞凋亡及炎症相关基因表达 共培养48h后,Trizol裂解细胞提取RNA,反转录试剂盒(Takara,日本)逆转录为cDNA,Sybr Green试剂盒进行qRT-PCR检测(全式金,中国),在反应管中扩增目的基因及管家基因(华大基因,中国),反应体系为20μL。引物序列:TNFα,上游引物:5′-CACCACTTCGAAACCTGGGA-3′,下游引物:TGTAGGCCCCAGTGAGTTCT-3′;Caspase-3,上游引物:5′-CCTGGTTCATCCAGTCGCTT-3′,下游引物:5′-TCTGTTGCCACCTTTCGGTT-3′;Caspase-8,上 游 引 物:5′-CTGGTCTGAAGGCTGGTTGT-3′,下 游 引 物:5′-CAGGCTCAGGAACTTGAGGG-3′;IL-6,上游引物:5′-GCACAGCTCTGGCTTGTTCC-3′,下游引物:5′-TGAGGAGACTTGCCTGGTGA-3′GAPDH,上游引物:5′-TCTGACGACTCTGCTTCACG-3′,下游引物:5′-TTCAGGGCATGTGTGATGCT-3′;CCND-1,上游引物:5′-GATGCCAACCTCCTCAACGA-3′,下游引物:5′-ACTTCTGTTCCTCGCAGACC-3′;。反应条件:95℃变性20min,95℃30s,60℃1min,40个循环。采用实时荧光定量PCR仪(Applied Biosystems 7500,美国Life Technologies公司)监测记录数据,重复3次。
1.6 统计学处理 采用SPSS 22.0统计软件进行数据分析,数据以均数±标准差表示。独立样本t检验进行两组间比较;多组间比较时,P值进行Bonferroni校正。P<0.05、P<0.01为差异有统计学意义。
2.结果
2.1 CD3+T细胞分离培养 显微镜下T细胞被PHA活化后,CD3+T细胞呈圆形悬浮生长,细胞增殖活跃,活性良好(图1)。

图1 CD3+T细胞镜下观(×200;×400)
2.2 共培养对CD3+T细胞Caspase3、Caspase8基因表达的影响 将H-PDLSCs及I-PDLSCs分别与CD3+T细胞以1∶10、1∶20、1∶50及1∶100比例共培养48h后,进行RNA的提取及逆转录。按照protocol进行实时定量PCR检测,本课题组的检测结果表明:在1∶10-1∶100范围内,随H/I-PDLSCs与CD3+T细胞比例的降低,H-PDLSCs组Caspase3及Caspase8 mRNA的表达水平较对照组显著降低,且呈逐级下降趋势(图2A、B)。而在1∶10-1∶100范围内,随PDLSCs与CD3+T细胞比例的降低,I-PDLSCs组Caspase3、Caspase8表达水平降低与其对照组相比显著降低,在1∶20、1∶50时,表达较为稳定(图2C、D),而当I-PDLSCs与CD3+T细胞以1∶100比例共培养后Caspase3及Caspase8基因表达虽与对照组相比显著降低但较1∶20、1∶50明显升高(图2A、B)。
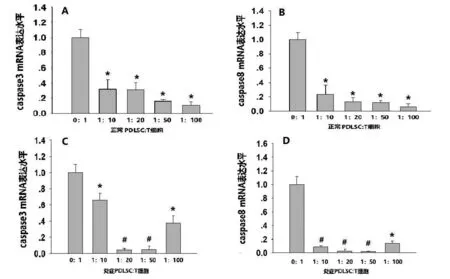
图2 CD3+T细胞凋亡相关基因表达
A:正常组共培养48h后Real Time PCR检测Caspase3 mRNA的相对表达量(*P<0.05);B:正常组共培养48h后Real Time PCR检测Caspase8 mRNA的相对表达量(*P<0.05);C:炎症组共培养48h后Real Time PCR检测Caspase3 mRNA的相对表达量(*P<0.05,#P<0.01);D:炎症组共培养48h后Real Time PCR检测Caspase8 mRNA的相对表达量(*P<0.05,#P<0.01)。
2.3 牙周膜干细胞对CD3+T细胞IL-6、TNFα基因表达的影响 我们的研究结果显示H-PDLSCs与CD3+T共培养比例为1∶10、1∶20、1∶50及1∶100时随着浓度的降低其IL-6、TNFα均呈现随浓度变化而降低的趋势,在共培养比例为1∶20、1∶50时,表达较为稳定(图3A、B)。随PDLSCs与CD3+T细胞比例的降低,I-PDLSCs组IL-6、TNFα表达水平显著降低,1:50比例时IL-6、TNFα降低程度最高,而在共培养比例为1∶100时IL-6、TNFα的基因表达水平较1∶50有所增高(图3C、D)。
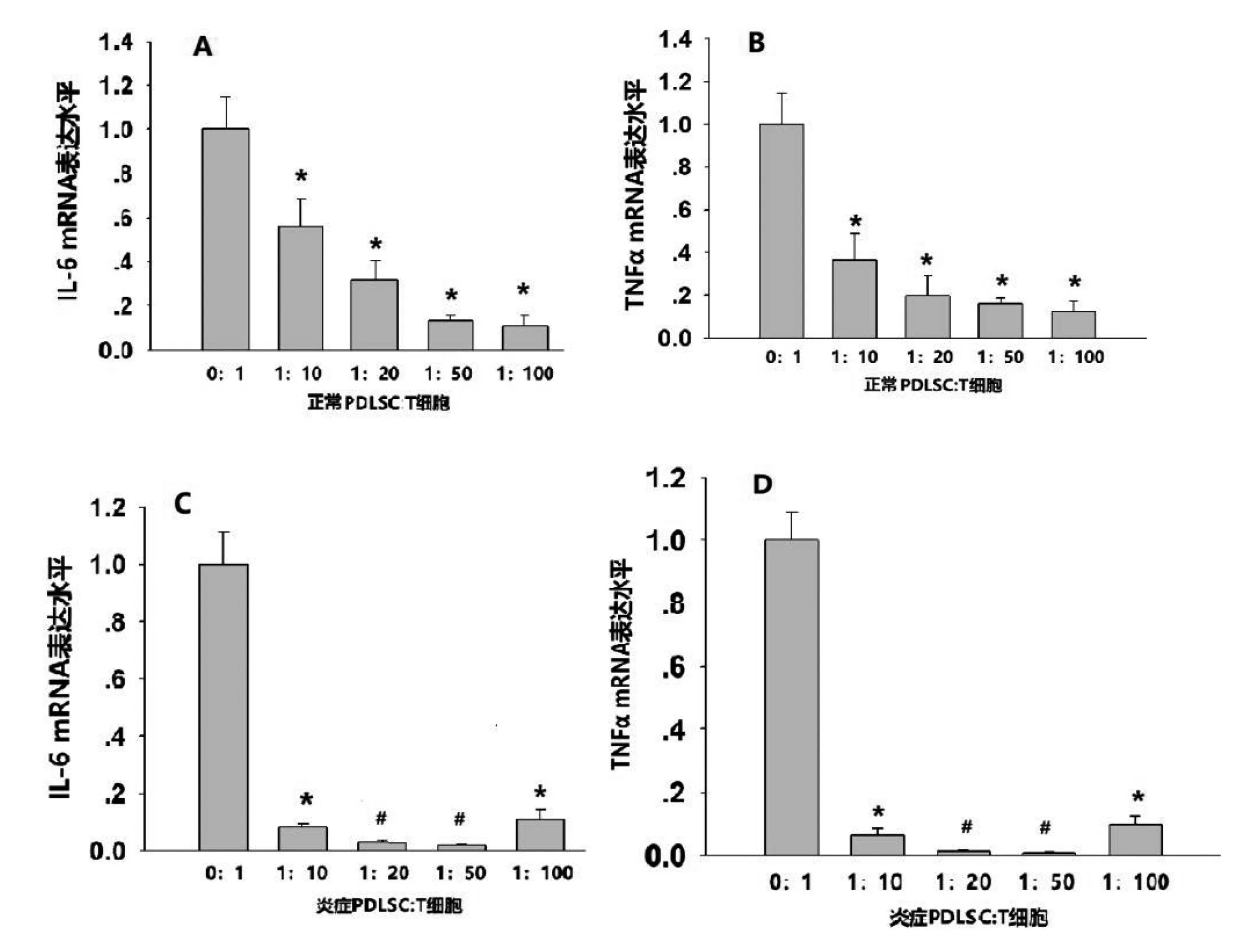
图3 CD3+T细胞炎症相关基因表达
A:正常组共培养48h后Real Time PCR检测IL-6 mRNA的相对表达量(*P<0.05);B:正常组共培养48h后Real Time PCR检测TNFαmRNA的相对表达量(*P<0.05);C:炎症组共培养48h后Real Time PCR检测IL-6 mRNA的相对表达量(*P<0.05,#P<0.01);D:炎症组共培养48h后Real Time PCR检测TNFαmRNA的相对表达量(*P<0.05,#P<0.01)。
2.4 H-PDLSCs、I-PDLSCs对CD3+T细胞增殖抑制作用 综合上述研究结果,在牙周膜干细胞与CD3+T细胞共培养比例为1∶20时其基因检测较为稳定,因此此部分实验检测PDLSCs与CD3+T细胞在共培养比例1∶20时CD3+T细胞CCND1 mRNA表达水平。结果显示,H-PDLSCs与CD3+T细胞共培养组相较对照组CCND-1表达水平降低(0.27倍,P<0.05);I-PDLSCs与CD3+T细胞共培养组CCND-1相较对照组表达水平降低(0.48倍,P<0.05)。而与I-PDLSCs共培养后CD3+T细胞CCND-1的表达水平高于与H-PDLSCs组共培养组(图4)。
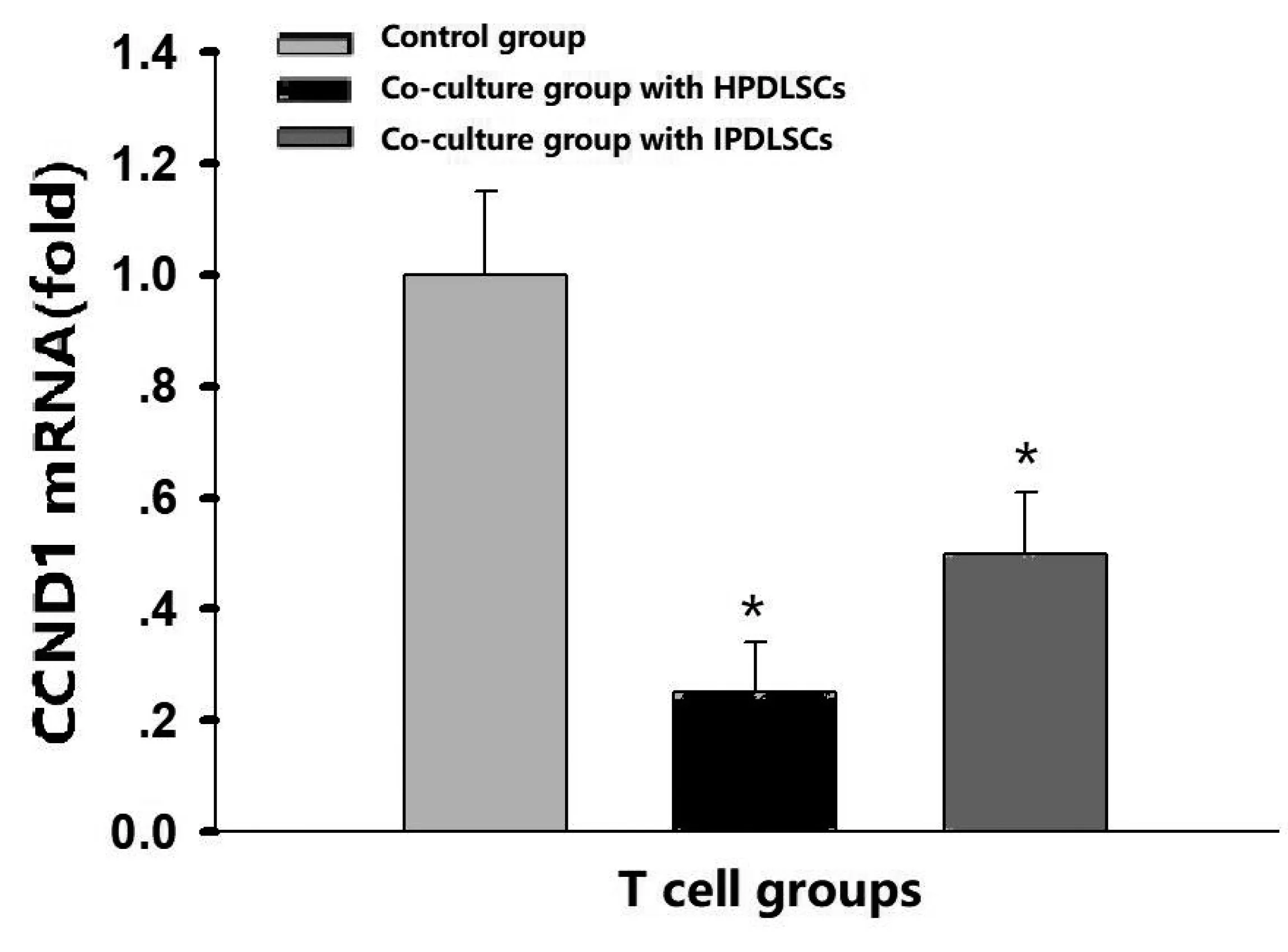
图4 H-PDLSCs/I-PDLSCs与CD3+T细胞以1∶20比例共培养48h后Real Time PCR检测CCND1 mRNA的相对表达量(*P<0.05)
3.讨论
PDLSCs近年来在牙周组织再生领域的研究中,受到了广泛关注。其多向分化潜能已经得到公认。MSCs可以释放多种细胞因子,其条件培养基能够有效增加骨缺损部位的组织愈合,促进纤维结缔组织及骨组织增生。与MSCs类似,PDLSCs具有很强的免疫调节能力。PDLSCs在维持牙周组织内环境稳定、创伤愈合及组织再生中发挥重要的作用。有学者通过对PDLSCs条件培养基及牙周炎动物模型的研究发现,PDLSCs可以通过降低TNFα的水平,来抑制牙槽骨吸收,促进牙周组织再生[13,14]。LI等研究表明PDLSCs可以通过分泌可溶性因子的旁分泌途径及直接接触抑制来抑制PHA激活的外周血单核细胞的增殖,并可以抑制IL-2及IFNγ的分泌[15]。炎症环境下,当免疫细胞被活化后,干细胞分泌的免疫调节蛋白增加,从而调控自身免疫调节能力。针对干细胞的免疫调节与组织再生的双重功能本研究设计相关实验以检测炎症条件下PDLSCs对免疫细胞生物学性能的影响。
MSCs在机体微环境调控下,可以分泌特定的蛋白质,在多种细胞组织的抗炎和生长愈合中发挥重要的作用。其可以从多种组织中获得,除优异的分化能力外,其最显著的特征是免疫调节及营养能力[16]。有报道证实MSCs可以促进调节性T细胞的产生[17]。组织驻留记忆T细胞(Tissue resident memory T cells,Trm)是一种新的长寿命记忆T细胞亚群,在先前的细菌或病毒感染后仍存在于屏障组织中,以支持早期/即时防御机制,提供针对病原体攻击的位点特异性保护。有学者研究提示,Trm在维持牙周内稳态中发挥重要的作用。当牙周内稳态被打破,牙龈屏障的防护作用被破坏,细菌抗原进入更深的结缔组织,激活记忆性T细胞,导致牙周炎的发生发展[18,19]。本实验采用免疫磁珠法进行T细胞的分离培养,磁珠分选系统分离的细胞纯度可以达到80-99%,得率在60-90%左右[20],我们使用了CD3+磁珠从人外周血单个核淋巴细胞中特异性分离获取了CD3+T细胞。
虽然大部分的文献报道间充质干细胞具有较强的抗炎作用,但近期也有相关研究表明在炎症也能反作用于干细胞,并提升其免疫调节性能。当使用外源性炎症因子TNF-α及INF-γ刺激MSCs后其分泌的iNOS水平增高,从而使其对T淋巴细胞的增殖抑制能力增强,能够更好的发挥免疫抑制作用[21]。INF-γ联合Toll受体激动剂能共同介导PDLSCs产生IDO-1,从而增强PDLSCs在牙周炎疾病条件下的免疫应答。T淋巴细胞在人体细胞免疫中起着重要作用,研究证实PDLSCs不引起同种异体T淋巴细胞的增殖,却能抑制丝裂原和混合淋巴细胞反应引起的T淋巴细胞增殖,其主要是由可溶性因子在PDLSCs介导的免疫抑制中发挥了主导作用[22]。Caspase-8在Caspases家族中举足轻重,作为介导细胞凋亡的重要蛋白,可以在外界因素刺激下,启动级联反应,从而激活Caspase-3,释放DNA降解酶,降解DNA,最终使细胞发生凋亡[23]。TNFα作为牙周炎发生发展中经典的炎症因子,在活动性牙周炎的牙周组织中呈高表达水平,在牙周胶原破坏以及骨质吸收中发挥关键性作用。IL-6具有多种生物学活性,可以借助内分泌途径发挥全身功效,其中就包括强大的免疫调节及抗感染功能。本实验结果表明,正常组PDLSCs与CD3+T细胞共培养时,在PDLSCs与CD3+T细胞比例1∶10至1∶100范围内,随着PDLSCs比例的降低,前者对后者的抑制作用增加,抑制了凋亡基因Caspase3/8、炎症因子IL-6、TNFα的mRNA表达水平。在二者比例为1∶50时,抑制作用较为稳定。炎症因子组PDLSCs与CD3+T细胞共培养时,在PDLSCs与CD3+T细胞比例1∶10至1∶100范围内,随着PDLSCs比例的降低,前者对后者凋亡及炎症因子分泌的抑制作用增加,抑制了凋亡基因Caspase3/8、炎症因子IL-6、TNFα的mRNA表达水平。说明PDLSCs可以保护淋巴细胞数目的减少。在二者比例为1∶20及1∶50时,作用较为稳定。这与Najar M等的研究结果相似,从各种来源中(骨髓、脂肪组织等)分离的MSCs以剂量依赖方式抑制CD4+T细胞和CD8+T细胞亚群[24]。H-PDLSCs在与CD3+T细胞按照1∶10、1∶20、1∶50及1∶100的比例共培养后CD3+T细胞的Caspase3、Caspase8、IL-6、TNF-α的表达呈逐步下降趋势,说明正常情况下H-PDLSCs的免疫调节方面的能力呈稳定趋势。而在I-PDLSCs在与CD3+T细胞按照1∶10、1∶20、1∶50及1∶100的比例共培养后CD3+T细胞的Caspase3、Caspase8、IL-6、TNF-α的表达在1∶10、1∶20、1∶50时呈逐步降低趋势,而在1∶100时出现反弹式增高趋势,呈现这种不稳定的趋势的原因可能是由于在本实验的检测期间CD3+T Caspase3、Caspase8表达水平增高致使细胞呈现显著凋亡趋势,而鉴于CD3+T的免疫执行能力进而反馈性的转录合成大量IL-6、TNF-α。另一方面,慢性炎症导致的干细胞生物学功能的变化机理较为复杂,炎症刺激可导致干细胞内关键蛋白的自分泌及旁分泌功能发生变化,这些蛋白可影响干细胞的自噬、凋亡、增殖、分化等功能,本研究的结果在而在I-PDLSCs在与CD3+T细胞按照1∶100时出现反弹式增高趋势这与上述因素有一定的关系,其具体分子生物学机制尚待深入研究。
此外,我们的研究还证实无论正常还是炎症条件下的牙周膜干细胞对CD3+T细胞均有一定的增殖抑制能力。CCND1在细胞周期调控中发挥重要的作用。细胞周期蛋白依赖性激酶与细胞周期蛋白结合后被激活,促进细胞周期G1、S、G2、M的定向转变。本实验数据表明,在共培养后,与H-PDLSCs组共培养的CD3+T细胞CCND1基因的表达水平是与I-PDLSCs共培养的0.5倍,说明I-PDLSCs对CD3+T细胞增殖的抑制作用减弱。提示在炎症状态下PDLSCs的免疫调节能力下降。我们证实了正常及炎症因子组PDLSCs均可呈浓度依赖性抑制CD3+T细胞的增殖及炎症因子分泌。但是具体的机制尚不清楚,仍待我们进一步探究。
