18F标记的苯乙烯基嘧啶类Aβ显像剂的制备与初步生物评价
2021-08-19李忠勇沈浪涛乔来成王成志崔海平
李忠勇,沈浪涛,乔来成,王成志,梁 巍,沈 忱,崔海平
(1.原子高科股份有限公司,北京 102413;2.中国原子能科学研究院,北京 102413)
阿兹海默病(AD)是影响人类,特别是老年人健康的重大疾病。许多研究证实,β淀粉样蛋白(Aβ)在AD发病中起着关键作用,因此,以Aβ为生物标志物,利用PET等分子影像学技术及相应的放射性药物,在临床症状发生之前进行Aβ显像,已成为早期无创诊断AD的重要技术手段[1-3]。近年来,大量小分子被设计用于Aβ显像,如18F-FDDNP、11C-PIB、18F-AZD4694、18F-GE67、18F-BAY94-9172、18F-AV45等,其中18F-AV45(即[18F]Florbetapir,商品名Amyvid,Eli lilly公司)、18F-GE67(即[18F]Flutemetamol,商品名Vizamyl,GE公司)和18F-BAY94-9172(即[18F]Florbetaben,商品名Neuraceq,Piramal公司)分别于2012年、2013年和2014年获得FDA上市许可,用于辅助诊断AD。这使得PET技术在早期无创诊断AD中表现出了极大潜力[3-5]。尽管如此,由于AD本身发病机理仍不明确,机理研究仍需深入,同时,新型Aβ显像剂的研发仍需继续,以期更好地解决AD的早期诊断[6-7]。在三种已获FDA上市许可的Aβ显像剂中,有两种(18F-BAY94-9172和18F-AV45)属于二苯乙烯类衍生物,对于该类Aβ显像剂,整个分子呈大共轭结构,其中一个芳环单元的对位通常含有给电子基团,如-NH2、-NHMe、-NMe2、-OH、-OMe等,对于保持与Aβ的高亲和性起重要作用,而另一个芳环单元有较大的可修饰性,如改变芳环结构(引入N、S等原子)、N甲基个数、聚乙二醇链长度等,苯乙烯基吡啶衍生物18F-AV45就是在18F-BAY94-9172的相应苯环结构中引入N原子,既保持了对Aβ的高亲和性,又能更快的达到高信噪比[8]。如果在18F-AV45的吡啶环结构中再引入氮原子,可以得到苯乙烯基嘧啶衍生物18F-SPm2和18F-SPm5,相关理论模型研究结果显示,18F-SPm2和18F-SPm5具有适宜的亲脂性(LogP=0.9~3.0),可能具有作为Aβ显像剂的潜力[9]。本工作将18F-SPm2和18F-SPm5作为潜在的Aβ显像剂,进行相关研究,探讨其用作Aβ显像剂的可能性。
1 实验部分
1.1 主要仪器与装置
DF-101S型集热式恒温加热磁力搅拌器:郑州长城科工贸有限公司;RE-5203A型旋转蒸发器:上海振捷试验设备有限公司;CRC-25R型活度计:美国CAPINTEC公司;6224型液质联用系统:美国AGILENT公司;400 MHz核磁共振波谱仪:德国BRUKER 公司;WIZARD2 2470型自动伽马计数仪:美国PERKINELMER公司;M-48型多头细胞收集器:美国BRANDEL公司;EVOS Fl型荧光显微镜:美国LIFE TECHNOLOGIES公司。
1.2 主要材料与试剂
C18液相色谱柱:美国AGILENT公司;Light C18柱、Light QMA柱:美国WATERS公司;18F离子溶液:原子高科股份有限公司;氨基聚醚K2.2.2:德国MERCK公司;色谱纯乙腈:美国SIGMA-ALDRICH公司;灭菌注射用水、氯化钠注射液:石家庄四药有限公司;其他试剂均为市售分析纯,国药集团化学试剂(北京)有限公司;除特别说明外,所用化学试剂均直接使用。
1.3 18F-SPm2和18F-SPm5的制备
1.3.118F-SPm2和18F-SPm5的结构
18F-SPm2和18F-SPm5的结构示于图1。
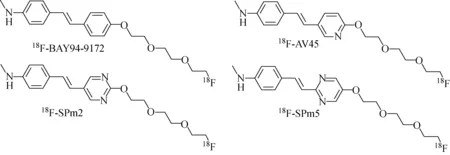
图1 18F-BAY94-9172、18F-AV45、18F-SPm2和18F-SPm5的分子结构Fig.1 Structures of 18F-BAY94-9172, 18F-AV45, 18F-SPm2 and 18F-SPm5
1.3.2标记前体化合物Boc-SPm2-OTs和Boc-SPm5-OTs的合成[10-11]
标记前体化合物Boc-SPm2-OTs和Boc-SPm5-OTs的合成路线示于图2。
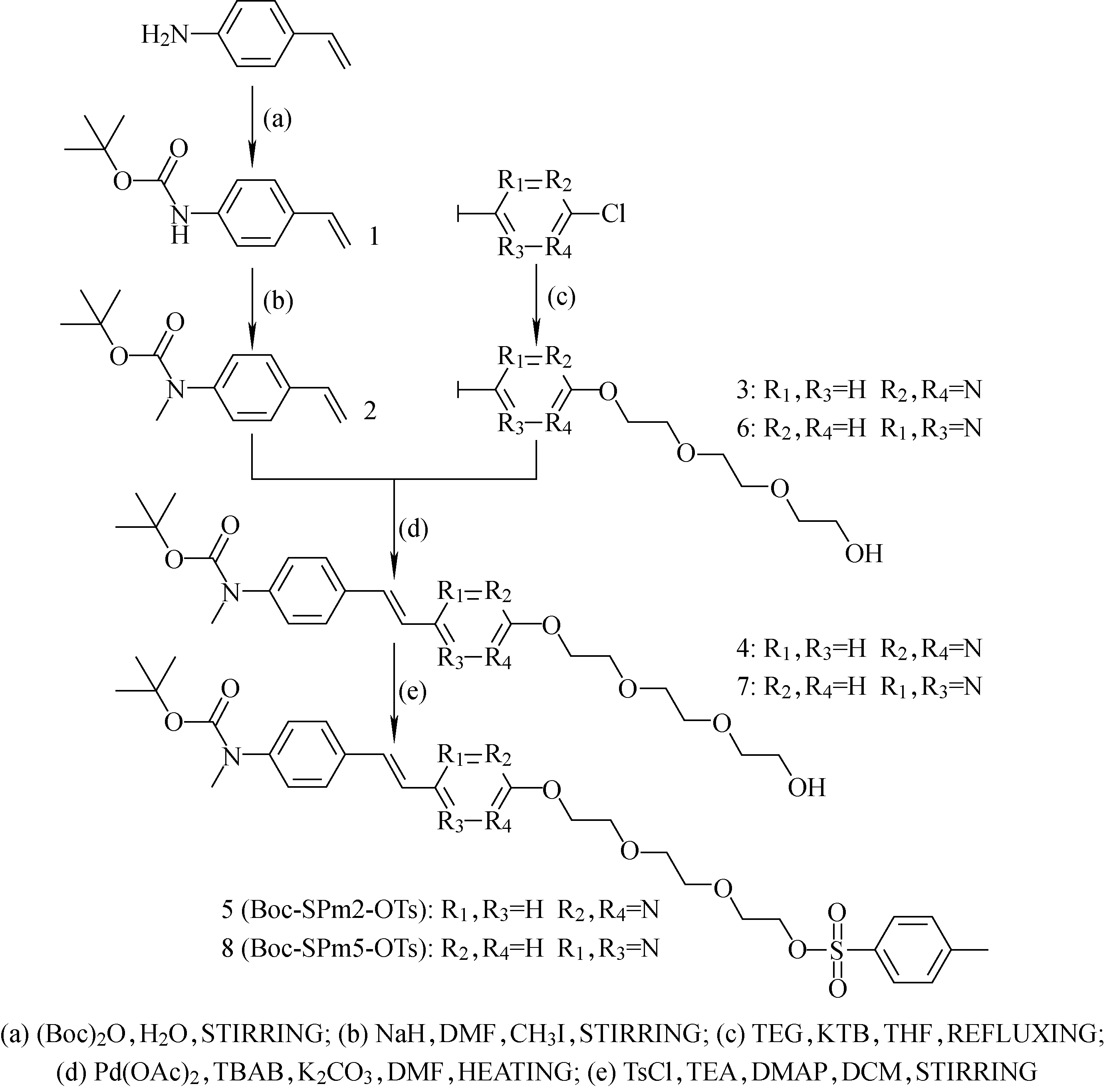
图2 Boc-SPm2-OTs和Boc-SPm5-OTs的合成路线Fig.2 Synthetic scheme of Boc-SPm2-OTs and Boc-SPm5-OTs
1) 化合物1的合成。10 mL水中加入1.2 g 4-氨基苯乙烯和2.91 g二碳酸二叔丁酯,35 ℃条件下搅拌4 h,用50 mL二氯甲烷萃取2次,混合有机相,依次用50 mL水、50 mL卤水清洗,无水硫酸钠干燥,过滤,滤液减压浓缩,剩余物用柱层析色谱(200~300目硅胶,VEA:VPE=1∶4作为淋洗剂)纯化,真空干燥。
2) 化合物2的合成。在氮气保护下,30 mL无水N,N-二甲基甲酰胺中加入0.65 g氢化钠(70%),0 ℃下滴加10 mL含2.19 g化合物1的无水N,N-二甲基甲酰胺溶液,0 ℃下搅拌1 h,30 ℃下搅拌1 h,0 ℃下滴加12.9 g碘甲烷,0 ℃下搅拌1 h,自然升温至室温,搅拌过夜,体系倾入40 mL 0 ℃饱和氯化铵溶液中淬灭,用120 mL乙酸乙酯萃取,有机相依次用40 mL水、40 mL卤水清洗,无水硫酸钠干燥,过滤,滤液减压浓缩,剩余物用柱层析色谱(200~300目硅胶,VEA∶VPE=1∶4作为淋洗剂)纯化,真空干燥。
3) 化合物3的合成。50 mL无水四氢呋喃中加入2.09 g 2-氯-5-碘吡啶和6.76 g三乙二醇,分次加入1.11 g叔丁醇钾,70 ℃油浴加热回流10 h,减压除去溶剂,加入100 mL水,用100 mL乙酸乙酯萃取3次,混合有机相,用100 mL卤水清洗,无水硫酸钠干燥,过滤,滤液减压浓缩,剩余物用柱层析色谱(200~300目硅胶,VEA∶VPE=4∶1作为淋洗剂)纯化,真空干燥。
4) 化合物4的合成。在氮气保护下,100 mL无水N,N-二甲基甲酰胺中加入1.66 g化合物2和2.49 g化合物3,并加入4.14 g四丁基溴化铵、4.9 g碳酸钾和103.92 mg乙酸钯,体系通氮排气20 min,然后100 ℃下搅拌20 h,减压除去溶剂,加入100 mL水,用100 mL乙酸乙酯萃取3次,混合有机相,依次用100 mL水、100 mL卤水清洗,无水硫酸钠干燥,过滤,滤液减压浓缩,剩余物用柱层析色谱(200~300目硅胶,VEA∶VPE=15∶1作为淋洗剂)纯化,真空干燥。
5) 化合物5的合成。20 mL二氯甲烷中加入497 mg化合物4,0 ℃下加入467.32 mg甲苯-4-磺酰氯,并加入726 mg三乙胺和34.98 mg 4-二甲胺基吡啶,30 ℃下搅拌10 h,加入30 mL二氯甲烷和50 mL水萃取,水相用50 mL二氯甲烷萃取,混合有机相,依次用50 mL水、50 mL卤水清洗,无水硫酸钠干燥,过滤,滤液减压浓缩,剩余物用柱层析色谱(200~300目硅胶,VEA∶VPE=2∶1作为淋洗剂)纯化,真空干燥。
6) 化合物6的合成。方法同化合物3。
7) 化合物7的合成。方法同化合物4。
8) 化合物8的合成。方法同化合物5。
1.3.3参比化合物19F-SPm2和19F-SPm5的合成[12-13]
参比化合物19F-SPm2和19F-SPm5的合成路线示于图3。
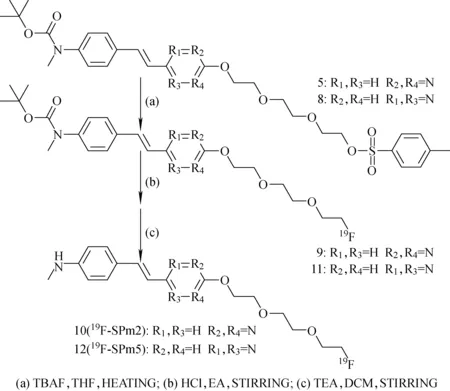
图3 19F-SPm2和19F-SPm5的合成路线Fig.3 Synthetic scheme of 19F-SPm2 and 19F-SPm5
1) 化合物9的合成。在氩气保护下,2.5 mL无水四氢呋喃中加入350.5 mg化合物5,0 ℃下滴加0.9 mL 1 mol/L的四丁基氟化铵的四氢呋喃溶液,60 ℃下搅拌5 h,减压除去溶剂,加入25 mL水,用25 mL二氯甲烷萃取2次,混合有机相,依次用25 mL水、25 mL卤水清洗,无水硫酸钠干燥,过滤,滤液减压浓缩,剩余物用柱层析色谱(200~300目硅胶,VEA∶VPE=2∶1作为淋洗剂)纯化,真空干燥。
2) 化合物10的合成。4 mL乙酸乙酯中加入179.2 mg化合物9,0 ℃下滴加0.4 mL浓盐酸,30 ℃下搅拌5 h,减压除去溶剂,加入5 mL二氯甲烷,0 ℃下滴加2.5 mL三乙胺,30 ℃下搅拌0.5 h,减压除去溶剂,加入25 mL水,用25 mL二氯甲烷萃取2次,混合有机相,依次用25 mL水、25 mL卤水清洗,无水硫酸钠干燥,过滤,滤液减压浓缩,剩余物用柱层析色谱(200~300目硅胶,VEA∶VPE=2∶1作为淋洗剂)纯化,真空干燥。
3) 化合物11的合成。方法同化合物9。
4) 化合物12的合成。方法同化合物10。
1.3.418F-SPm2和18F-SPm5的放化合成
18F-SPm2和18F-SPm5的放化合成路线示于图4。

图4 18F-SPm2和18F-SPm5的放化合成路线Fig.4 Radiosynthetic scheme of 18F-SPm2 and 18F-SPm5
将由回旋加速器制备的[18F]F-水溶液通过活化的QMA柱,用1 mL K2.2.2/K2CO3溶液(体积比为96∶4的乙腈和水中含有K2.2.214.4 mg/mL和K2CO33 mg/mL)淋洗QMA柱,淋洗液接收入5 mL V底反应瓶中,密封,100 ℃加热及氩气流条件下蒸干溶液,加入1 mL无水乙腈,100 ℃加热及氩气流条件下蒸干溶液。V底反应瓶中加入1 mL 1 mg/mL Boc-SPm2-OTs或Boc-SPm5-OTs的无水DMSO溶液,120 ℃油浴加热10 min,加入0.25 mL 10% HCl溶液,120 ℃油浴加热8 min,加入0.825 mL 1 mol/L NaOH溶液,混合均匀后转移入10 mL小瓶中,再用4 mL H2O清洗V底反应瓶,洗液转移入同一小瓶中。
将得到的混合溶液通过活化的C18柱,用1 mL HPLC-CH3CN淋洗C18柱,淋洗液通过半制备HPLC(55% CH3CN和45% 20 mmol/L NH4OAc,流速:4 mL/min, 时间:20 min)进行纯化,收集需要组分并加入2倍的水,混合均匀,然后通过活化的C18柱,用0.5 mL乙醇淋洗,淋洗液加入4.5 mL NaCl注射液,混合均匀,最后通过0.22 μm无菌滤膜过滤。
1.4 18F-SPm2和18F-SPm5的脂水分配系数
在2支10 mL离心管中分别依次加入0.2 mL18F-SPm2或18F-SPm5的制剂溶液(约20 μCi)、2.0 mL PBS饱和的正辛醇和1.8 mL正辛醇饱和的PBS,涡旋5 min,5 000 r/min离心10 min,静置分层,分别取上层PBS饱和的正辛醇(OA相)和下层正辛醇饱和的PBS(PBS相)各0.2 mL于计数管中,平行取4次,测量放射性计数N,计算脂水分配系数LogP=Log(NOA相/NPBS相)值。
1.5 18F-SPm2和18F-SPm5的体外稳定性
取100 μL18F-SPm2或18F-SPm5的制剂溶液(约100 μCi),加入1 mL生理盐水中,置于室温下,孵育5、30、60、120、180 min,采用Radio-HPLC法测定放化纯度,以观察稳定性。
1.6 体外荧光染色
AD患者脑切片(女性,64岁,颞叶)和转基因小鼠脑切片(C57BL6,APP/PS1,雌性,14月龄)各一张,经过3×20 min的二甲苯脱蜡,然后依次经过2×5 min的无水乙醇、2×5 min的95%乙醇、5 min的80%乙醇和5 min的70%乙醇洗涤,再经过流水冲洗10 min后,置于10 mmol/L的PBS中。将处理过的AD患者脑切片和转基因小鼠脑切片分别浸于5 μmol/L19F-SPm2或19F-SPm5的溶液(溶剂为20%乙醇溶液)中10 min,然后依次经过5 min的40%乙醇和2 min的去离子水洗涤,干燥后用荧光显微镜观察。
1.7 体外竞争结合
在12 mm×75 mm硼硅玻璃管中分别加入100 μL不同浓度19F-SPm2或19F-SPm5的乙醇溶液(10-3~10-9mol/L)、100 μL125I-IMPY溶液(计数率106min-1·mL-1)[14]、700 μL PBS和100 μL Aβ1-42水溶液(30 nmol/L)[15],用封口膜密封,涡旋,在37 ℃恒温水浴中振荡孵育2 h,用0 ℃的PBS终止反应,多头细胞收集器收集反应液,用玻璃纤维滤膜分离结合复合物与游离的放射性配基,用3 mL 0 ℃的PBS冲洗三次,测量滤膜上的放射性计数。利用Graphpad Prism 4.0 分析数据得到半抑制常数IC50,根据Cheng-Prusoff方程计算抑制常数Ki。
1.8 体内生物分布
将100 μL18F-SPm2或18F-SPm5的制剂溶液(约100 μCi)经尾静脉注射到20只正常ICR小鼠(每组4只,20~25 g,雌性,北京华阜康生物科技股份有限公司)体内,分别于注射后5、30、60、120、180 min时,从眼部取血并迅速处死,解剖后取肺、心、肝、脾、胃、肠、肾、肌肉、腿骨、头骨、脑等器官,分别置于事先称重的计数管底部,测量放射性计数并称重,计算放射性摄取率(%ID/g)。
2 结果与讨论
2.1 18F-SPm2和18F-SPm5的制备
2.1.1标记前体化合物Boc-SPm2-OTs和Boc-SPm5-OTs的合成
化合物1的合成。得到白色固体,产率为100%。HRMS(EI):m/zC13H17NO2219.125 9(M),219。1H NMR(400 MHz,CDCl3)δ7.34(s,4H),6.66(dd,J=17.6,10.9Hz,1H),6.47(s,1H),5.65(d,J=17.6 Hz,1H),5.16(d,J=10.9 Hz,1H),1.52(s,9H)。13C NMR(101 MHz,CDCl3)δ 152.63,137.93,136.19,132.49,126.83,118.40,112.36,80.58,28.33。
化合物2的合成。得到淡黄色液体,产率为89%。HRMS(EI):m/zC14H19NO2233.141 6(M),233。1H NMR(400 MHz,CDCl3)δ7.36(d,J=8.6 Hz,2H),7.17(d,J=8.5 Hz,2H),6.69(dd,J=17.6,10.9 Hz,1H),5.70(d,J=17.6 Hz,1H),5.23(d,J=10.9 Hz,1H),3.25(s,3H),1.45(s,9H)。13C NMR(101 MHz,CDCl3)δ154.66,143.32,136.13,134.60,126.30,125.35,113.55,80.35,37.20,28.33。
化合物3的合成。得到白色固体,产率为83%。HRMS(ESI+):m/zC10H15IN2O4(M+H)+355.014 9,355.022 3;m/zC10H15IN2O4(M+Na)+376.996 9,376.999 5。1H NMR(400 MHz,CDCl3)δ8.64(s,2H),4.50(t,J=4.8 Hz,2H),3.88(t,J=4.8 Hz,2H),3.77-3.70(m,4H),3.70-3.65(m,2H),3.65-3.57(m,2H)。13C NMR(101 MHz,CDCl3)δ164.29,163.96,82.55,72.51,70.86,70.37,69.08,67.25,61.74。
化合物4的合成。得到白色固体,产率为48%。HRMS(ESI+):m/zC24H33N3O6(M+H)+460.244 2,460.248 8;m/zC24H33N3O6(M+Na)+482.226 2,482.231 0。1H NMR(400 MHz,CDCl3)δ8.63(s,2H),7.45(d,J=8.6 Hz,2H),7.26(d,J=8.5 Hz,2H),7.05(d,J=16.4 Hz,1H),6.90(d,J=16.5 Hz,1H),4.56(t,J=4.8 Hz,2H),3.91(t,J=4.8 Hz,2H),3.78-3.72(m,4H),3.72-3.67(m,2H),3.66-3.59(m,2H),3.28(s,3H),2.60(s,1H),1.47(s,9H)。13C NMR(101 MHz,CDCl3)δ164.15,156.68,154.55,143.72,133.31,129.28,126.65,125.47,125.21,20.62,80.57,72.57,70.89,70.39,9.27,66.99,61.76,37.13,28.34。
化合物5的合成。得到淡黄色胶状体,产率为81%。HRMS(ESI+):m/zC31H39N3O8S(M+H)+614.253 1,614.256 8;m/zC31H39N3O8S(M+Na)+636.235 0,636.237 9。1H NMR(400 MHz,CDCl3)δ8.63(s,2H),7.80(d,J=8.3 Hz,2H),7.46(d,J=8.6 Hz,2H),7.34(d,J=8.1 Hz,2H),7.25 (s,1H),7.06 (d,J=16.5 Hz,1H),6.90(d,J=16.4 Hz,1H),4.53(t,J=4.8 Hz,2H),4.16(t,J=4.8 Hz,2H),3.85(t,J=4.8 Hz,2H),3.74-3.63(m,4H),3.62-3.57(m,2H),3.28(s,3H),2.44(s,3H),1.47(s,9H)。13C NMR(101 MHz,CDCl3)δ164.26,156.69,154.56,144.76,143.71,133.33,133.00,129.81,129.22,127.98,126.64,125.47,125.17,120.69,80.57,70.78,70.75,69.35,69.25,68.71,66.98,37.13,28.34,21.64。
化合物6的合成。得到白色固体,产率为62%。1H NMR(400 MHz,CDCl3)δ8.53(s,2H),4.51(t,J=4.8 Hz,2H),3.88(t,J=4.8 Hz,2H),3.77-3.70(m,4H),3.70-3.65(m,2H),3.65-3.57(m,2H)。13C NMR(101 MHz,CDCl3)δ163.62,159.59,111.96,72.57,70.84,70.34,69.09,67.38,61.73。
化合物7的合成。得到白色固体,产率为72%。HRMS(ESI+):m/zC24H33N3O6(M+H)+460.244 2,460.249 4;m/zC24H33N3O6(M+Na)+482.226 2, 482.231 7。1H NMR(400 MHz,CDCl3)δ8.63(s,2H),7.45(d,J=8.6 Hz,2H),7.26(d,J=8.5 Hz,2H),7.05(d,J=16.5 Hz,1H),6.90(d,J=16.5 Hz,1H),4.57(t,J=4.8 Hz,2H),3.91(t,J=4.8 Hz,2H),3.78-3.72(m,4H),3.72-3.66(m,2H),3.66-3.59(m,2H),3.28(s,3H),2.72(s,1H),1.47(s,9H)。13C NMR(101 MHz,CDCl3)δ164.12,156.67,154.54,143.72,133.29,129.30,126.66,125.46,125.21,20.60,80.57,72.55,70.90,70.40,69.27,67.02,1.76,37.13,28.34。
化合物8的合成。得到淡黄色胶状体,产率为85%。HRMS(ESI+):m/zC31H39N3O8S(M+H)+614.253 1,614.256 8;m/zC31H39N3O8S(M+Na)+636.235 0,636.237 8。1H NMR(400 MHz,CDCl3)δ8.63(s,2H),7.80(d,J=8.4 Hz,2H),7.46(d,J=8.6 Hz,2H),7.34(d,J=8.0 Hz,2H),7.25(s,1H),7.06(d,J=16.5 Hz,1H),6.90(d,J=16.5 Hz,1H),4.53(t,J=4.8 Hz,2H),4.16(t,J=4.8 Hz,2H),3.85(t,J=4.8 Hz,2H),3.73-3.63(m,4H),3.63-3.53(m,2H),3.28(s,3H),2.44(s,3H),1.47(s,9H)。13C NMR(101 MHz,CDCl3)δ164.22,156.68,154.56,144.76,143.72,133.32,133.00,129.81,129.24,127.98,126.65,125.47,125.18,120.66,80.57,70.78,70.75,69.34,69.25,68.71,67.00,37.13,28.34,21.64。
2.1.2参比化合物19F-SPm2和19F-SPm5的合成
化合物9的合成。得到白色固体,产率为81%。HRMS(ESI+):m/zC24H32FN3O5(M+H)+462.239 9,462.247 2;m/zC24H32FN3O5(M+Na)+484.221 8,484.229 1。1H NMR(400 MHz,CDCl3)δ8.63(s,2H),7.45(d,J=8.2 Hz,2H),7.25(s,1H),7.05(d,J=16.4 Hz,1H),6.90(d,J=16.4 Hz,1H),4.62(t,J=4.0 Hz,1H),4.56(t,J=4.9 Hz,2H),4.50(t,J=4.0 Hz,1H),3.91(t,J=4.8 Hz,2H),3.79(t,J=4.0 Hz,1H),3.79-3.65(m,5H),3.28(s,3H),1.47(s,9H)。13C NMR(101 MHz,CDCl3)δ164.29,156.68,154.55,143.71,133.34,129.18,126.64,125.47,125.14,120.71,83.99,82.31,80.56,70.85,70.54,70.34,69.37,67.03,37.13,28.34。
化合物10的合成。得到黄色固体,产率为88%。HRMS(ESI+):m/zC19H24FN3O3(M+H)+362.187 5,362.192 3;m/zC19H24FN3O3(M+Na)+384.169 4,384.171 2。1H NMR(400 MHz,CDCl3)δ8.57(s,2H),7.34(d,J=8.2 Hz,2H),6.97(d,J=16.4 Hz,1H),6.71(d,J=16.4 Hz,1H),6.59(d,J=8.2 Hz,2H),4.61(t,J=4.0 Hz,1H),4.54(t,J=4.9 Hz,2H),4.49(t,J=4.0 Hz,1H),3.99(s,1H),3.89(t,J=4.9 Hz,2H),3.78(t,J=4.1 Hz,1H),3.78-3.65(m,5H),2.86(s,3H)。13C NMR(101 MHz,CDCl3)δ163.80,156.14,149.42,130.14,127.83,25.95,125.64,116.30,112.38,83.99,82.31,70.83,70.52,70.32,69.40,66.87,30.54。
化合物11的合成。得到白色固体,产率为77%。HRMS(ESI+):m/zC24H32FN3O5(M+H)+462.239 9,462.246 7;m/zC24H32FN3O5(M+Na)+484.221 8,484.229 2。1H NMR(400 MHz,CDCl3)δ8.63(s,2H),7.46(d,J=8.3 Hz,2H),7.25(s,1H),7.05(d,J=16.4 Hz,1H),6.90(d,J=16.5 Hz,1H),4.62(t,J=4.0 Hz,1H),4.56(t,J=4.9 Hz,2H),4.50(t,J=4.0 Hz,1H),3.91(t,J=4.9 Hz,2H),3.79(t,J=4.2 Hz,1H),3.77-3.67(m,5H),3.28(s,3H),1.47(s,9H)。13C NMR(101 MHz,CDCl3)δ164.28,156.68,154.55,143.70,133.33,129.17, 126.63,125.46,125.13,120.71,83.99,82.31,80.56,70.85,70.53,70.34,9.36,67.03,37.13,28.34。
化合物12的合成。得到黄色固体,产率为81%。HRMS(ESI+):m/zC19H24FN3O3(M+H)+362.187 5,362.191 3;m/zC19H24FN3O3(M+Na)+384.169 4, 384.171 0。1H NMR(400 MHz,CDCl3)δ8.57(s,2H),7.34(d,J=8.7 Hz,2H),6.97(d,J=16.4 Hz,1H),6.71(d,J=16.4 Hz,1H),6.59(d,J=8.7 Hz,2H),4.62(t,J=4.1 Hz,1H),4.54(t,J=4.8 Hz,2H),4.50(t,J=4.1 Hz,1H),3.97(s,1H),3.90(t,J=4.9 Hz,2H),3.78(t,J=4.2 Hz,1H),3.78-3.67(m,5H),2.86(s,3H)。13C NMR(101 MHz,CDCl3)δ163.79,156.13,149.43,130.15,127.83,125.95,125.63,116.30,112.37,83.99,82.31,70.83,70.52,70.32,69.40,66.87,30.53。
2.1.318F-SPm2和18F-SPm5的放化合成
从[18F]F-起,至纯化结束,18F-SPm2和18F-SPm5放化合成总时间分别为170和190 min,衰减校正后的放化产率分别为20%和15%,放化纯度均大于99%,比活度均约10 GBq/mol。18F-SPm2和18F-SPm5保留时间均为8.4 min(如图5),与相应的参比化合物19F-SPm2和19F-SPm5一致。
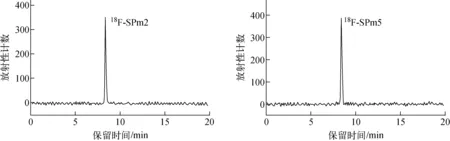
图5 18F-SPm2和18F-SPm5的HPLC谱图Fig.5 HPLC chromatograms of 18F-SPm2 and 18F-SPm5
2.2 18F-SPm2和18F-SPm5的脂水分配系数
18F-SPm2和18F-SPm5的脂水分配系数(LogP)分别为2.04和1.84,说明18F-Spm2和18F-Spm5具有适宜的亲脂性。
2.3 18F-SPm2和18F-SPm5的体外稳定性
18F-SPm2和18F-SPm5在生理盐水中室温放置3 h后的HPLC谱图见图6。由图6可知,18F-SPm2和18F-SPm5在生理盐水中室温放置3 h后,放化纯度仍大于99%,说明两者在生理盐水中的稳定性良好。

图6 18F-SPm2和18F-SPm5在生理盐水中室温放置3 h后的HPLC谱图Fig.6 HPLC chromatograms of 18F-SPm2 and 18F-SPm5 incubated in normal saline for 3 h at room temperature
2.4 体外荧光染色
每张切片染色后用靶向于Aβ的近红外染料DANIR-3b(1 μmol/L)染色定位[16],体外荧光染色结果如图7所示。由图7可知,19F-SPm2和19F-SPm5均能标记出Aβ沉积的位置,但是与DANIR-3b相比,清晰度较差,说明虽然19F-SPm2和19F-SPm5与Aβ具有一定的亲和性和选择性,但18F-SPm2和18F-SPm5可能不是理想的Aβ显像剂。
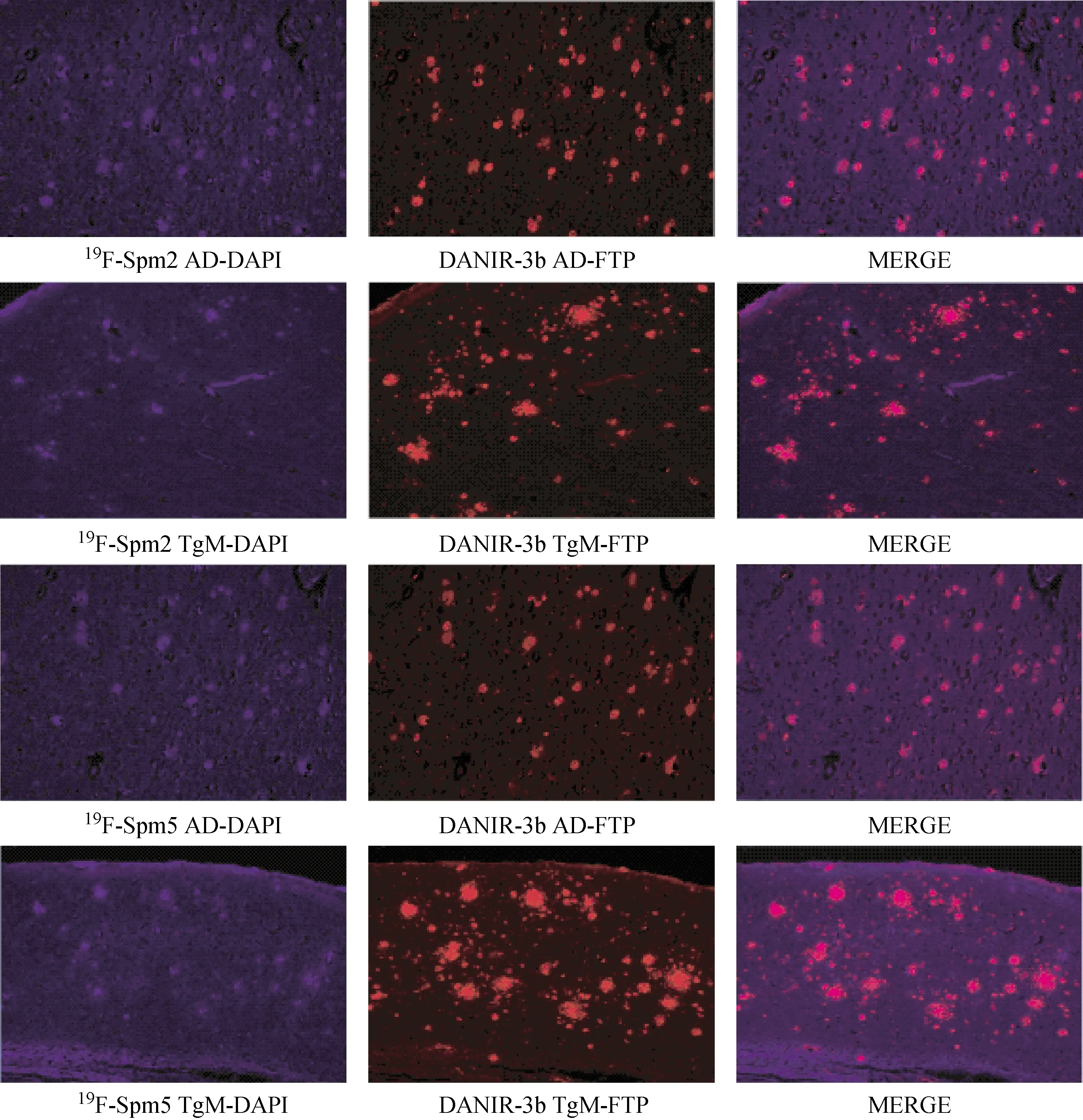
图7 体外荧光染色结果Fig.7 Results of in vitro fluorescent staining
2.5 体外竞争结合
体外竞争结合实验采用125I-IMPY为放射性配基,Aβ1-42聚集体为受体蛋白,相关竞争结合曲线示于图8,结果表明19F-SPm2和19F-SPm5对125I-IMPY与Aβ1-42聚集体的结合均能产生抑制作用,经过定量计算得到两者的Ki值分别为246.6 nmol/L和318.2 nmol/L,表明19F-SPm2和19F-SPm5对Aβ1-42聚集体的亲和力较弱。
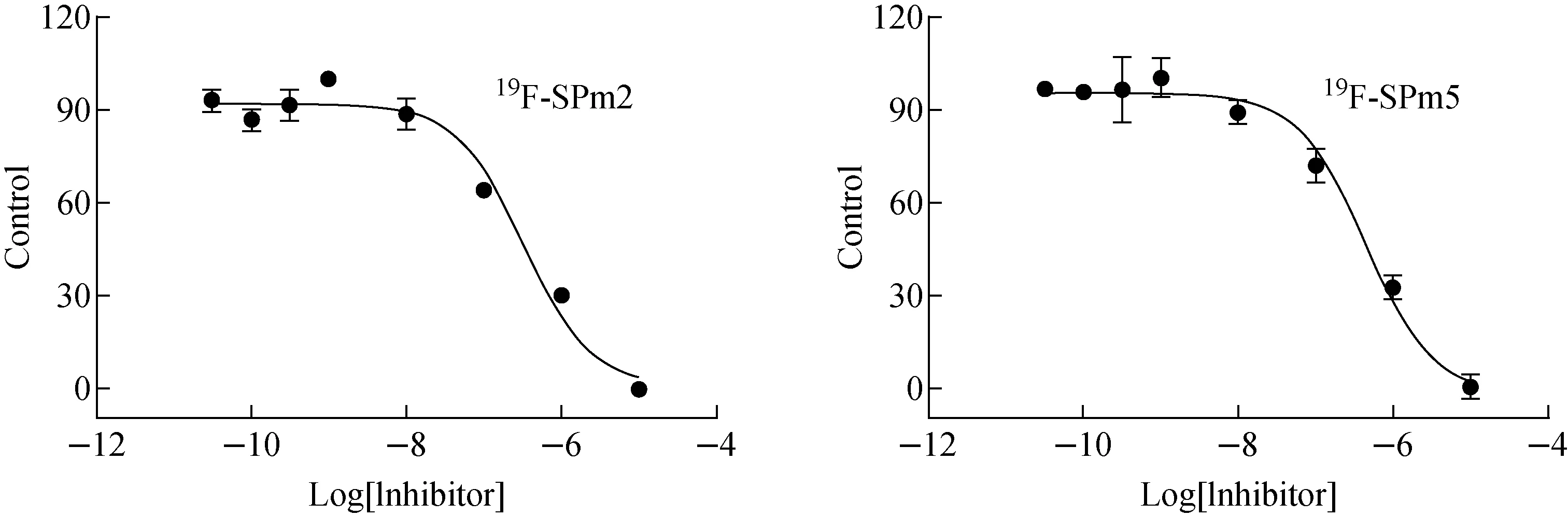
图8 相关竞争结合曲线Fig.8 Competitive binding curves
2.6 体内生物分布
18F-SPm2和18F-SPm5在正常小鼠体内生物分布如图9所示。18F-SPm2在注射后5 min时,肝、肾和肠放射性摄取率分别为32.73%ID/g、11.77%ID/g和15.85%ID/g,分别为血液放射性摄取率的5.83、2.10和2.83倍;18F-SPm5在注射后5 min时,肝、肾和肠放射性摄取率分别为24.42%ID/g、10.92%ID/g和9.83%ID/g,分别为血液放射性摄取率的5.90、2.64和2.37倍;说明18F-SPm2和18F-SPm5体内吸收迅速,除主要经肝代谢外,还经肾和肠等代谢。
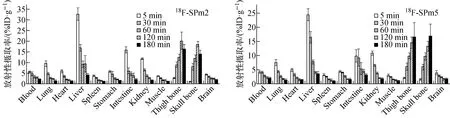
图9 18F-SPm2和18F-SPm5在正常小鼠体内的生物分布Fig.9 Biodistribution of 18F-SPm2 and 18F-SPm5 in normal mice (n=4,
18F-SPm2在注射后5 min时,血和脑放射性摄取率分别为5.61%ID/g和4.29%ID/g,注射后60 min时分别为3.19%ID/g和2.58%ID/g,脑/血比分别为0.76和0.81,5 min和60 min脑放射性摄取比为1.66;18F-SPm5在注射后5 min时,血和脑放射性摄取值分别为4.14%ID/g和3.91%ID/g,注射后60 min时分别为2.83%ID/g和2.28%ID/g,脑/血比分别为0.94和0.81,5 min和60 min脑放射性摄取比为1.71;说明正常脑组织对18F-SPm2和18F-SPm5的放射性摄取能力较弱且清除较慢。另外,虽然18F-SPm2和18F-SPm5在骨中的初始放射性摄取水平较低,但随着时间的延长,腿骨和头骨中放射性摄取率均明显增加,说明18F-SPm2和18F-SPm5在体内存在明显脱氟现象,这会严重影响18F-SPm2和18F-SPm5作为Aβ显像剂的应用。
3 结论
本工作合成了两种18F标记的苯乙烯基嘧啶化合物18F-SPm2和18F-SPm5,两者放化纯度均大于99%,亲脂性和体外稳定性良好,体外实验表明19F-SPm2和19F-SPm5虽然能选择性结合Aβ,但对Aβ亲和力较弱,体内实验表明18F-SPm2和18F-SPm5的正常脑放射性摄取能力较弱且清除较慢,而且存在明显脱氟现象,这些结果都说明18F-SPm2和18F-SPm5不是理想的Aβ显像剂,也说明两种分子的设计存在缺陷。另外,苯乙烯基嘧啶结构中的二价键是否会受光作用影响、是否存在异构体等因素也可能对研究结果产生影响,应当纳入考虑。针对两者缺点的分子结构改造研究工作正在进行中。
