64Cu-NOTA-NOC的制备及体内生物分布初步研究
2021-08-19赵海龙李泽全罗田伟黄旭虎陈孟毅史旭东邓雪松李洪玉
赵海龙,李泽全,罗田伟,黄旭虎,王 宁,陈孟毅, 许 林,史旭东,邓雪松,李洪玉
(1.原子高科股份有限公司,北京 102413;2.中国医学科学院 医学实验动物研究所,北京 100021)
神经内分泌肿瘤(neuroendocrine neoplasms, NENs)是一类起源于干细胞且具有神经内分泌标记物、能够产生生物活性胺和(或)多肽激素的肿瘤[1-2]。在神经内分泌肿瘤(胃肠胰神经内分泌肿瘤、垂体瘤和嗜铬细胞瘤等)和一些神经系统肿瘤(神经母细胞瘤和脑膜瘤等)的细胞上常有生长抑素受体(somatostatin receptor, SSTR)的过度表达[3-5]。生长抑素(somatostatin, SST)类似物能够特异性地靶向SSTR过度表达的肿瘤细胞[6],这一特性可被用于肿瘤的诊断和治疗,放射性药物的研究主要集中在SST八肽类似物(以下简称八肽)方面。近年来,FDA先后批准四种基于SST八肽的放射性药物(68Ga-DOTATATE、177Lu-DOTATATE、68Ga-DOTATOC及64Cu-DOTATATE),用于神经内分泌肿瘤的诊断和治疗[4,7]。NOC也是一种SST八肽,2017年,Esposito等[8]对64Cu-DOTA-NOC进行了PET/CT显像研究,结果显示其可以准确检测出胰岛素瘤患者的病灶部位。
64Cu为新型医用正电子核素,半衰期为12.7 h,通过电子俘获、β-和β+方式衰变[4,9]。64Cu发射低能正电子,端点能量为0.653 MeV,与18F的最大正电子能量(0.634 MeV)相近;由于PET扫描图像的分辨率取决于核素的正电子能量,以及由此导致的组织穿透范围(直到电子湮灭),因此64Cu所得PET图像的分辨率几乎可与18F的图像相媲美[10-11]。因64Cu具有良好的核物理性质、优良的化学配位能力以及可通过回旋加速器获得高比活度产品的特点,物理半衰期较长使其在临床PET显像的应用方面独具优势,近年来,已逐渐成为放射性药物领域的研究热点之一。随着64Cu-DOTATATE的新近获批[7],64Cu标记药物必将受到越来越多的关注。目前,对64Cu-八肽的研究主要集中于DOTATATE[3,12],其标记反应条件较为剧烈,需95 ℃、反应15 min且需要对产物进行纯化。据文献报道[13],64Cu与螯合基团NOTA能够在温和的条件下进行反应,但64Cu对NOTA-NOC的标记尚未见文献报道。
本文利用正电子核素64Cu对NOTA-NOC进行放射性标记,对64Cu-NOTA-NOC的制备、质控分析、稳定性研究及生物学评价进行初步研究,为开发64Cu标记的SST类似物药物用于SSTR阳性肿瘤诊断和治疗提供参考。
1 实验仪器及材料
1.1 主要仪器
CRC-55TW活度计:美国Capintec公司;2470全自动伽马计数器:美国Perkin Elmer公司;MiliQ-Reference超纯水机:密理博(中国)有限公司;LC-20AT高效液相色谱仪:Iertsil ODS-SP C18色谱柱(4.6 mm×250 mm,5 μm),日本岛津公司;Bioscan色谱仪伽马计数器:德国Eckertk Ziegler公司;ME204电子天平:梅特勒-托利多;VORTEX3螺旋振荡器:德国IKA公司;干式恒温金属浴:上海净信实业发展有限公司;雷磁PHS-3E pH计:上海仪电科学仪器股份有限公司;Inveon MM PET/CT:西门子。
1.2 主要试剂
NOTA-NOC:纯度>95%,ABX公司;64CuCl2溶液:64Cu放射性核纯度>99.9%,0.01 mol/L HCl溶液,pH 2.0~2.2,原子高科股份有限公司;乙酸(Metals basis)、乙酸钠(Metals basis):Alfa Aesar公司;乙腈:色谱纯,德国Merck。
1.3 实验动物
正常昆明(KM)小鼠,6~8周,18~22 g,SPF级,雄性,15只,北京华阜康生物科技股份有限公司,实验动物许可证号SCXK(京)2019-0008;荷BON-1胰腺癌裸鼠,10~12周,18~23 g,肿瘤大小0.5~1 cm3,雄性,18只,大江康泰(北京)生物科技有限公司,实验动物许可证号SYXK(京)2017-0023。
2 实验方法
2.1 64Cu-NOTA-NOC制备
取NOTA-NOC(结构示于图1)多肽,使用乙酸/乙酸钠缓冲溶液(pH=4.8)配制成0.68 g/L(摩尔浓度为0.5 mmol/L)溶液。取48 μL(24 μmol)NOTA-NOC溶液置于EP管内,加入20 μL64CuCl2溶液(3.7~7.4 MBq/μL),涡旋混匀后(反应液pH为4.5~4.7),将EP管放置于干式加热器的加热孔内,在25 ℃条件下孵育(500 转/min);15 min后,取出EP管;反应液用乙酸/醋酸钠溶液(pH=4.8)稀释至所需浓度,经0.22 μm微孔滤膜过滤,待用。
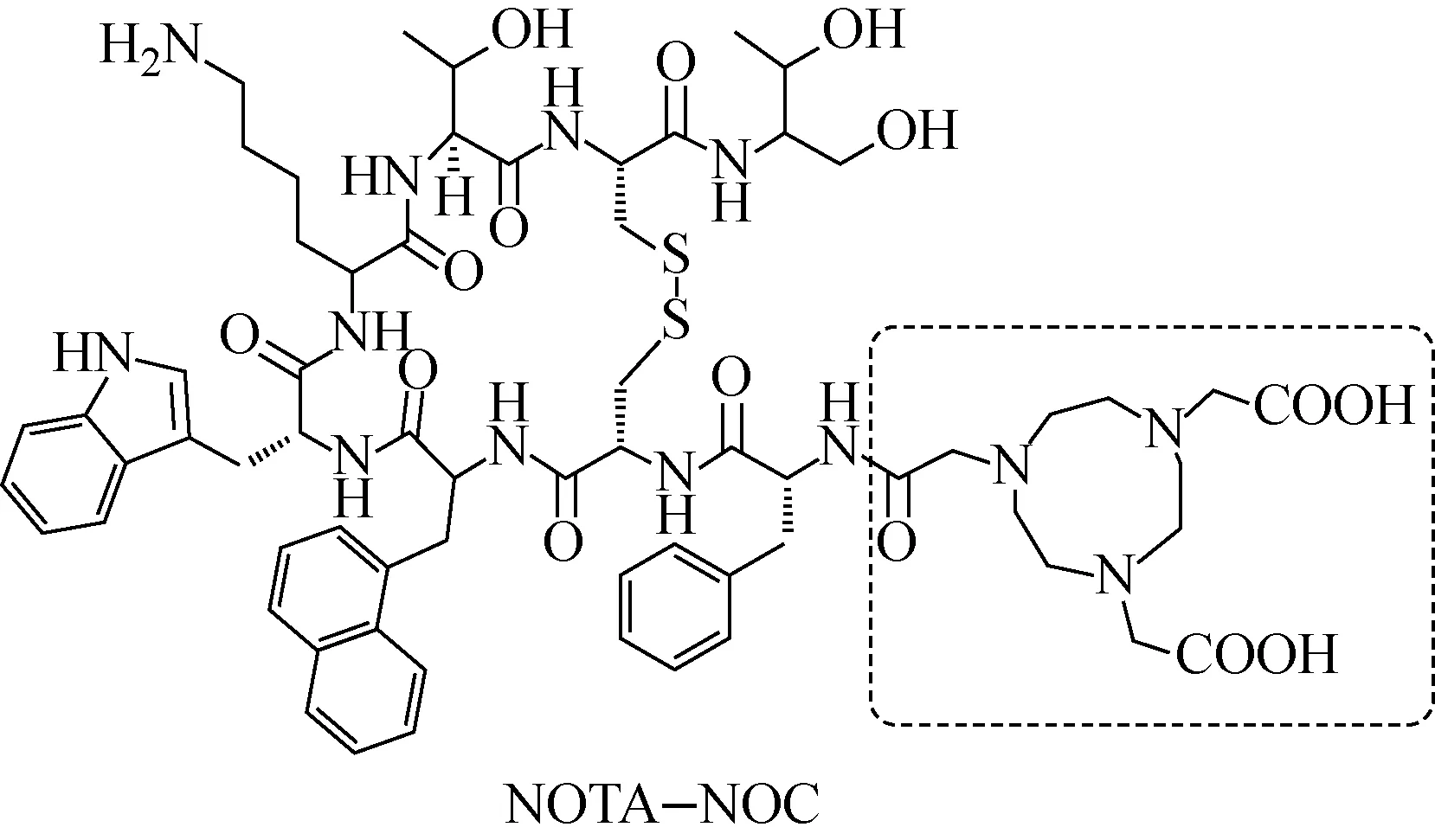
图1 NOTA-NOC的结构Fig.1 The structure of NOTA-NOC
2.2 64Cu-NOTA-NOC的质控分析
HPLC分析采用Shimadzu LC-20AT system高效液相仪,ODS-SP C18 柱(4.6 mm×250 mm,5 μm),流动相A:0.1%TFA/水;流动相B:0.1%TFA/乙腈。洗脱梯度:0~10 min,20%~80%流动相B;10~13 min,80%~80%流动相B;13~15 min,80%~20%流动相B,测定放化纯度,观察放射性峰的保留时间。
2.3 体外稳定性
2.3.1PBS缓冲体系中的稳定性 将64Cu-NOTA-NOC(18~28 MBq)经PBS(pH=7.4,0.2 mL)缓冲溶液稀释后,37 ℃温育,分别于2、12、24 h取反应液,采用HPLC测定其放化纯度。
2.3.2胎牛血清中的稳定性 取64Cu-NOTA-NOC(30 μL,18~36 MBq)加入到10%胎牛血清溶液(0.5 mL)中,在37 ℃温育,分别于2、12、24 h取反应液,加入乙腈(100 μL),涡旋混匀,离心,取上清液,采用HPLC测定其放化纯度。
2.4 脂水分配系数
将相同体积的正辛醇和磷酸缓冲溶液(pH=7.4)(0.5 mL:0.5 mL)加入到1.5 mL EP管中,再将64Cu-NOTA-NOC(约3.7 MBq,3 μL)溶于上述溶液中。盖好后充分震荡5 min,在离心机中离心分层5 min,转速为2 000 r/min。分别取有机相和水相各100 μL于放免管中,在井型γ探测器中分别测量其放射性计数,采用logP=log(γ正辛醇/γ缓冲液)计算脂水分配系数,重复操作3次,取平均值为该标记物的脂水分配系数。
2.5 正常KM小鼠的生物分布
正常KM小鼠(雄性,18~22 g)15只,实验前未禁食,随机分为3组,每只尾静脉注射10 μCi/0.1 mL(多肽的量约为4×10-11mol)的64Cu-NOTA-NOC,在注射后1、4、24 h断颈处死、同时取血,取不同脏器称重并测量放射性计数,计算每克组织的放射性摄取率(%ID/g)。
2.6 荷瘤动物的生物分布
荷BON-1胰腺癌的裸鼠(雄性,18~22 g)16只,实验前未禁食,随机分为4组,每只尾静脉注射10 μCi/0.1 mL(多肽的量约为4×10-11mol)的64Cu-NOTA-NOC,在注射后1、2、4、24 h断颈处死、同时取血,取不同脏器称重并测量放射性计数,计算每克组织的放射性摄取率(%ID/g)。
2.7 动物PET/CT显像
荷BON-1胰腺癌裸鼠分两组,实验前未禁食,分别经尾静脉注射64Cu-NOTA-NOC(400-425 μCi/0.1 mL,约1.6×10-9mol)、64Cu-NOTA-NOC+阻断剂(blocker,DOTATATE,150 μg),采用混合气体麻醉法对裸鼠麻醉,分别在给药后的1、4和8 h进行PET/CT显像,图像采集时间为15 min。扫描结束后,使用filtered back projection(FBP)算法对图像进行重建,使用西门子的Inveon Research Workplace 2.0工作站对肿瘤和主要器官进行定量分析。
3 结果与讨论
3.1 标记与质控
64Cu-NOTA-NOC及NOTA-NOC的液相图示于图2。64Cu-NOTA-NOC的标记率在室温反应15 min时即可高于95%。标记物64Cu-NOTA-NOC为无色透明溶液,64Cu2+的保留时间为3.11 min,目标化合物64Cu-NOTA-NOC的保留时间为10.40 min(其前体化合物NOTA-NOC保留时间为9.98 min),放化纯度大于95%,可不经纯化直接用于下一步相关研究。
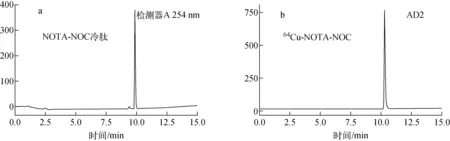
图2 NOTA-NOC的HPLC分析图(a)及64Cu-NOTA-NOC的Radio-HPLC分析图(b)Fig.2 HPLC chromatography of NOTA-NOC (a) and Radio-HPLC chromatography of 64Cu-NOTA-NOC (b)
3.2 体外稳定性
64Cu-NOTA-NOC在PBS缓冲溶液和10%胎牛血清中的稳定性结果示于图3。37 ℃下,在PBS缓冲溶液和10%胎牛血清中孵育24 h,放化纯度均大于95%,均未见有明显的游离64Cu2+出现,说明其在PBS缓冲溶液和10%胎牛血清中具有较好的稳定性。
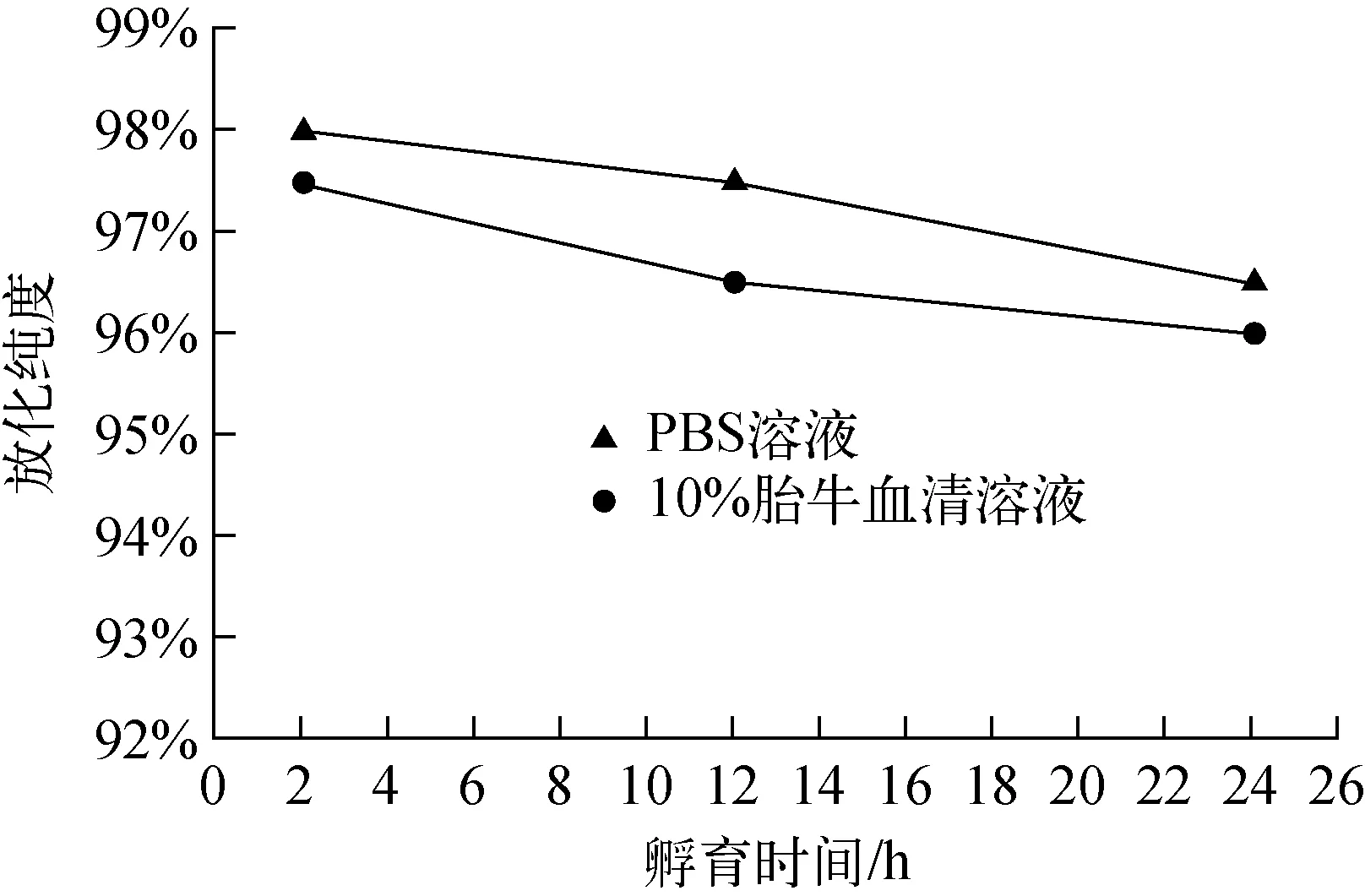
图3 64Cu-NOTA-NOC在PBS缓冲溶液 和10%胎牛血清中的稳定性结果Fig.3 Radiochemistry purity of 64Cu-NOTA-NOC in two systems
3.3 脂水分配系数
对64Cu-NOTA-NOC的脂水分配系数进行测定,根据所测得的数据计算得64Cu-NOTA-NOC的脂水分配系数为-1.12±0.005 6(n=3),表明该配合物具有亲水性。
3.4 正常KM小鼠生物分布
64Cu-NOTA-NOC在正常KM小鼠体内的生物分布结果列于表1。由表1可知,64Cu-NOTA-NOC在肾脏中摄取较高,表明该配合物主要经肾脏代谢。同时在胃、胰腺中也具有较高的摄取,这可能与这些组织和器官内SSTR2受体表达水平较高有关。1 h时64Cu-NOTA-NOC在肾、胃及胰腺的放射性摄取率为(11.53±0.94) %ID/g、(10.52±1.31) %ID/g和(7.44±1.30) %ID/g。此外,通过表1可以看出64Cu-NOTA-NOC在正常KM小鼠体内的代谢较快,相比于1 h时相,4 h时,除大肠外其他器官放射性摄取率均明显下降。

表1 64Cu-NOTA-NOC在正常KM小鼠中的 生物分布Table 1 Biodistribution of 64Cu-NOTA-NOC in normal KM mice n=5)
2018年杨志课题组[3]报道了64Cu-DOTATATE的研究结果,结果显示64Cu-DOTATATE在Balb/c小鼠体内肾脏、肝脏摄取较高,并随着时间延长而降低,说明其主要经肾脏、肝脏代谢,同时在胃、小肠、大肠中也具有较高的放射性摄取。本研究中64Cu-NOTA-NOC在正常KM小鼠体内的代谢行为与64Cu-DOTATATE相类似。
3.5 荷瘤动物的生物分布
64Cu-NOTA-NOC在荷BON-1胰腺癌裸鼠体内的生物分布结果列于表2,由表2可知,64Cu-NOTA-NOC在血液中清除较快,1 h时(1.87±0.23)%ID/g ,2 h时(0.89±0.13)%ID/g。64Cu-NOTA-NOC在肾脏中的放射性摄取较高,1、2、4 h的放射性摄取率分别为(22.16±3.65)%ID/g、(16.93±0.81)%ID/g、(3.92±0.48)%ID/g,表明该化合物主要经肾脏代谢,与正常KM小鼠体内的代谢相一致。在胃、胰腺等器官和组织中也具有较高的放射性摄取,1 h时64Cu-NOTA-NOC在胃、胰腺的放射射性摄取率为(19.93±6.13)%ID/g和(10.09±2.11)%ID/g。
从表2可以看出,1、4 h时,荷瘤鼠肺部对64Cu-NOTA-NOC的放射性摄取率分别为(9.37±2.69)%ID/g、(3.76±0.41)%ID/g,而在正常KM小鼠体内,1、4 h时,64Cu-NOTA-NOC在肺部的放射性摄取率分别为(14.27±2.59)%ID/g和(9.05±1.68)%ID/g(见表1)。荷瘤鼠肺部和正常KM小鼠肺部对64Cu-NOTA-NOC的放射性摄取表现出较大的差异性,这可能与小鼠的种属差异有关。除肺部外,64Cu-NOTA-NOC在荷瘤鼠体内的分布和代谢特点基本与正常KM小鼠相一致。64Cu-NOTA-NOC在肿瘤中也表现出较高的放射性摄取率,1、2 h分别为(3.74±1.23)%ID/g和(4.80±0.92)%ID/g;注射后4 h,64Cu-NOTA-NOC在肿瘤中的放射性摄取率下降,但肿瘤/血和肿瘤/肌肉的摄取比仍较高。在1、2、4及24 h四个时间点中,肿瘤/血和肿瘤/肌肉的摄取比在2 h时最高,分别为5.36和10.38。该研究中靶与非靶的摄取比高于杨志课题组[3]报道的64Cu-DOTATATE在荷PANC-1胰腺癌裸鼠中靶与非靶的比(1、10 h的肿瘤/血摄取比分别为(0.80±0.05)、(1.30±0.09),1、10 h的肿瘤/肌肉摄取比分别为(1.23±0.11)、(1.89±0.09)。
表2 64Cu-NOTA-NOC在荷BON-1胰腺癌裸鼠中的生物分布Table 2 Biodistribution of 64Cu-NOTA-NOC in nude mice bearing BON-1 tumor n=4)
3.6 动物PET/CT显像
64Cu-NOTA-NOC在荷BON-1胰腺癌裸鼠体内的PET/CT显像结果示于图4。给药后1 h,64Cu-NOTA-NOC在肿瘤中出现放射性浓聚,而加入阻断剂后,肿瘤摄取明显降低,提示肿瘤对64Cu-NOTA-NOC的摄取具有特异性。对64Cu-NOTA-NOC及64Cu-NOTA-NOC+Block的显像结果进行定量计算(见表3),结果显示,64Cu-NOTA-NOC在小鼠体内代谢较快;1 h时64Cu-NOTA-NOC在肿瘤中摄取率最高,为7.7%ID/g,而64Cu-NOTA-NOC+Block在1 h时肿瘤摄取率为0.94%ID/g,提示64Cu-NOTA-NOC能够特异性的靶向肿瘤部位。与此同时64Cu-NOTA-NOC在膀胱、胆囊及胃中的摄取均较高,其中膀胱、胆囊在1 h时,摄取率最高,分别为28.1%ID/g和7.2%ID/g。
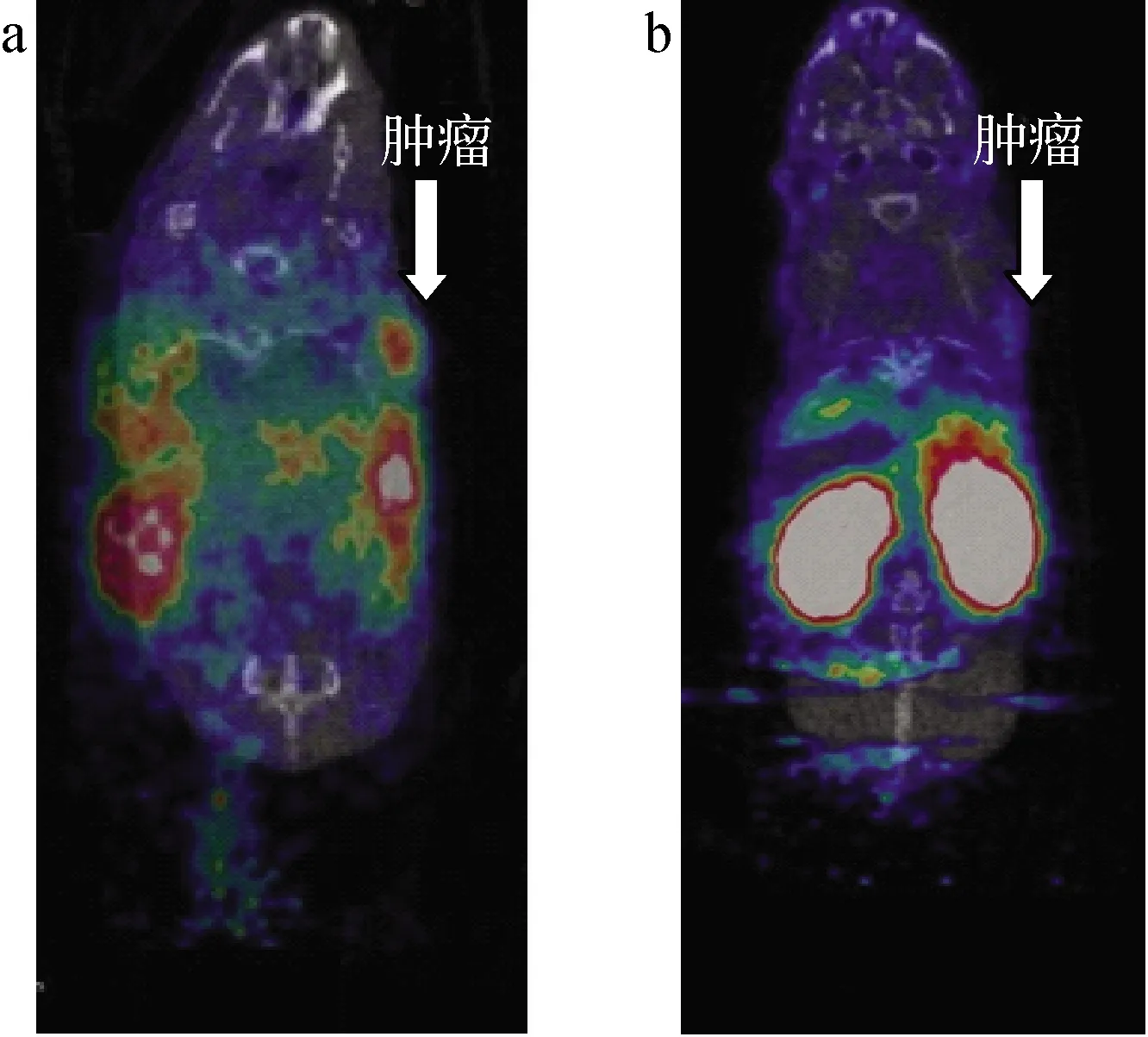
图4 荷BON-1胰腺癌裸鼠注射 64Cu-NOTA-NOC(a)与64Cu-NOTA-NOC+ Blocker(b)后1 h的PET/CT显像结果Fig.4 PET/CT images of nude mice bearing BON-1 tumor injected with 64Cu-NOTA -NOC (a) and 64Cu-NOTA-NOC (b) acquired at 1 h
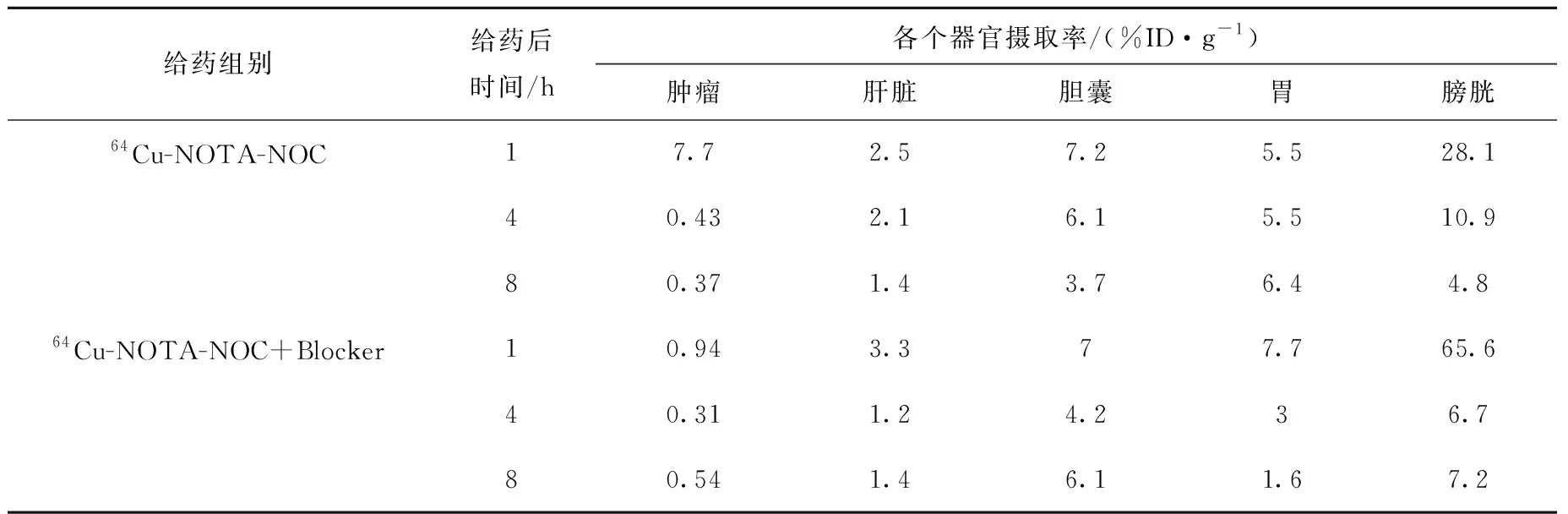
表3 64Cu-NOTA-NOC及阻断实验中荷BON-1胰腺癌裸鼠的各个器官摄取率Table 3 Organ uptakes of 64Cu-NOTA-NOC in nude mice bearing BON-1 tumor with or without co-injection of blocker DOTATATE (150 μg) at 1 h, 4 h, 8 h
4 小结
本文对64Cu-NOTA-NOC的制备、质控分析、体外稳定性及生物学分布进行了初步研究。64Cu对NOTA-NOC的标记能够在温和的反应条件下高标记率的完成,在室温条件下,反应15 min即可实现95%以上的标记率。64Cu-NOTA-NOC在缓冲溶液及10%胎牛血清中37℃孵育24 h,放化纯度均大于95%,表明具有较好的体外稳定性;动物体内主要经肾脏代谢,符合八肽类化合物在生物体内的代谢行为。64Cu-NOTA-NOC在动物体内清除较快,在胰腺癌肿瘤组织中有较高摄取,能够获得清晰的PET/CT图像,肿瘤/血和肿瘤/肌肉放射性摄取比于注后1、2和4 h均较高。初步的研究结果表明,64Cu-NOTA-NOC具有较好的体内外性质,具有用于胰腺癌诊断的潜质,后期将针对动物模型、给药量等因素开展进一步研究。
