丙酸盐对大鼠心肌梗死后心脏重构的保护作用
2021-08-19李棣文
李棣文 谢 轲 徐 辽 刘 育
在全球范围内心脏骤停是成年人死亡的主要原因,绝大多数心脏骤停发生在患有心肌梗死(myocardial infarction,MI)的患者中[1]。交感神经系统活性和迷走神经系统活性在MI后室性心律失常及心力衰竭的发生、发展中发挥着重要作用[2]。因此调节自主神经系统可成为预防心肌梗死后结构重构和电重构的重要手段。丙酸盐是由人体肠道菌群产生的一种短链脂肪酸(short chain fatty acids,SCFAs),它与自主神经系统的活性具有一定的相关性,既往研究发现,SCFAs对肠道内迷走神经末梢有直接作用,可直接激活迷走神经的传入神经纤维调节血压,保护心功能[3,4]。本研究旨在讨论丙酸盐是否能够通过自主神经系统改善左心室心功能及抑制心肌梗死后室性心律失常的发生。
材料与方法
1.实验动物与分组:健康雄性SD大鼠60只,体质量为200~250g,由湖南斯莱克景达公司提供(实验动物许可证号:SCXK湘2016-0002)。大鼠随机分为3组:①对照组(n=20),正常饲养,持续28天;②MI组(模型组,n=20),结扎冠状动脉前降支建立心肌梗死模型,正常饲养,持续28天;③MI+丙酸盐组(丙酸盐组,n=20),心肌梗死模型建立后,每日饮水中添加丙酸盐250ml(200mmol/L),持续28天。
2.心肌梗死模型的建立:使用3%戊巴比妥钠(30mg/kg)腹腔注射将大鼠麻醉。胸部碘伏常规消毒,切开皮肤后夹断第3~4肋骨,暴露心脏,结扎冠状动脉左前降支。心电图Ⅰ、aVL导联ST段明显持续性抬高,结扎处以下左心室心肌颜色变白、收缩运动明显减弱,代表结扎成功。结扎完毕后逐层缝合切口,待动物自主呼吸恢复后拔除气管插管。
3.无创血压监测:所有动物于造模后第28天在基础状态下使用无创血压仪测量收缩压、舒张压、平均动脉压以及心率并记录。仪器预热20min后,将大鼠装入固定盒内固定后放入动物固定架,大鼠尾部通过加压套插入至接近尾根部,使鼠尾刚好处于脉搏传感器的“脉搏信号传感片”上方,并使传感片紧贴鼠尾下方的尾动脉,待大鼠脉搏稳定后进行血压测量。
4.超声心动图测量心脏结构和功能:所有动物于术后28天使用心脏超声仪测量心脏结构和功能。采用Vivid7多功能超声诊断仪(美国GE公司)行经胸廓的二维和多普勒超声心动图检查,测量左心室舒张末期内径(LVEDd)、左心室舒张末期容积(LVEDV)、左心室射血分数(LVEF)和左心室缩短分数(LVFS)。
5.电生理检测:(1)T波峰-末间期(Tpeak-Tend):检测大鼠取平卧位,使用LEAD7000多导记录仪记录体表心电图,选取Ⅱ导联图形进行Tpeak-Tend分析。测量T波的顶点至T波末尾的时间即为Tpeak-Tend。(2)有效不应期(ERP):将刺激电极置于梗死周边区、心底部、左心室游离壁测定ERP。所有刺激发放为电压3V时长2ms矩形方波,刺激电压为2倍起搏阈值。每8个S1后发放1个S2刺激,S1S2配对间期从100ms开始,以10ms步长递减,到达心室ERP后从上1个配对间期以2ms步长递减,直至到达ERP。心室ERP的离散度用变异系数(CV)评价,即为上述6个测量部位的标准差/均数。(3)心室颤动阈值(VFT):刺激电极于右心室心间部施加刺激(单次刺激5s,间隔2s),以每次增加1V的速度递增,则能诱发心室颤动的最低电压为心室颤动阈值。
6.心率变异率(HRV):分析所有动物于术后28天记录5min体表心电图进行HRV分析以下变量:高频成分(high-frequency,HF)(0.75~2.50Hz)、低频成分(low-frequency,LF)(0.20~0.75Hz)及LF/HF。

结 果
1.各组大鼠血流动力学、左心室结构和功能的比较:与对照组比较,模型组大鼠心率明显升高,左心室射血分数、左心室缩短分数显著下降,LVEDV及LVEDd显著上升;与模型组比较,丙酸盐组心率明显降低,左心室射血分数、左心室缩短分数显著上升,LVEDV及LVEDd显著下降(表1)。
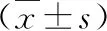
表1 3组大鼠心率、血压及左心室结构和功能的比较
2.各组大鼠电生理指标的比较:与对照组比较,模型组左心室游离壁ERP有下降趋势,差异无统计学意义,CV-ERP显著增加,VFT显著下降,Tpeak-Tend间期显著延长;与模型组比较,丙酸盐组心底部及左心室游离壁ERP显著延长,CV-ERP显著减小,VFT显著增加,Tpeak-Tend间期显著缩短(表2)。
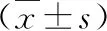
表2 3组大鼠的电生理指标的比较
3.各组大鼠心率变异性的比较:与对照组比较,模型组的LF及LF/HF显著增加,HF显著降低;与模型组比较,丙酸盐组的LF、LF/HF显著降低,HF显著升高(表3)。
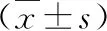
表3 3组大鼠的心率变异性的比较
讨 论
本研究发现,丙酸盐可以明显改善MI大鼠结构重构和电重构,即改善大鼠左心室结构和功能、延长ERP、减少CV-ERP、增加VFT、延长Tpeak-Tend间期。心率和心率变异性结果提示其作用可能与自主神经系统的调控有关。
既往研究发现,发生MI后,患者仍有心力衰竭和心源性猝死的风险,严重的左心室收缩功能下降和室性心律失常是MI患者心源性猝死的主要原因[5]。这些患者的心力衰竭表型是由心室结构重构所引起的,其中包括胶原蛋白沉积、纤维化、肥大以及心室结构的改变,深刻影响着心室功能和患者的预后[6]。室性心率失常的发生主要与MI后电重构有关[7]。多项研究结果显示自主神经系统的失衡(如交感神经的过度激活)是导致上述病理变化的重要因素[8,9]。因此,抑制交感神经系统、激活迷走神经系统目前已成为预防该不良后果的手段和方式,如β-肾上腺素能受体拮抗剂药物的使用、左侧星状神经节化学消融、迷走神经刺激(VNS)等[10,11]。SCFAs由人体肠道菌群通过发酵饮食中不易消化的碳水化合物产生,主要包含乙酸盐、丙酸盐和丁酸盐,其调节宿主生物学反应的机制主要是通过G蛋白偶联受体(GPCR)进行信号转导,包括GPR41和GPR43,这些受体在肠道系统中高度表达[12,13]。研究发现,SCFAs可通过激活GPR41来刺激肠道迷走神经传入神经元,调节胃肠激素的分泌、抑制食物摄取以改善肥胖,或者影响大脑活动及相关神经精神疾病,如抑郁症、帕金森病等[14~16]。在心血管疾病中,既往研究证明,丙酸盐也可通过结合GPR41直接作用于肠道内迷走神经末梢、激活迷走神经传入神经纤维来降低血压,从而保护心脏功能[17,18]。
本研究发现,与模型组比较,丙酸盐组大鼠左心室射血分数、左心室缩短分数显著上升,LVEDV及LVEDd显著下降,说明丙酸盐可改善MI大鼠左心室结构和功能,在缓解MI后心脏结构重构上发挥重要作用。为了探索丙酸盐是否对MI后电重构有一定的影响,本研究分别检测了各组大鼠的VFT、心室复极离散度以及不同部位的ERP并计算了CV-ERP,其中Tpeak-Tend间期可代表心室复极离散度。笔者发现,与对照组比较,模型组大鼠ERP有下降趋势,CV-ERP显著增加、VFT显著下降、Tpeak-Tend间期则显著延长,但模型组大鼠上述指标均可以得到明显改善。因此,丙酸盐可以明显改善MI后心室电生理性质,具有潜在的抗室性心律失常的作用。
心率变异性(HRV)可评估自主神经系统功能和心血管疾病患者的风险[19]。既往研究发现,HRV异常的MI患者死亡风险会大大增加,同时它与MI后室性心律失常的发生、发展关系密切[20]。在本实验中笔者监测了各组大鼠的LF、HF及LF/HF,分别可作为交感神经活性、迷走神经活性及交感迷走神经平衡的相关参数[21]。结果显示,与对照组比较,模型组的LF及LF/HF显著增加,HF显著降低。连续使用丙酸盐28天后可以显著增加HF,降低LF及LF/HF。由此可推测,丙酸盐可能具有激活迷走神经系统、改善由慢性心肌梗死带来的交感与迷走神经不平衡的作用。
心率(HR)可作为评估MI患者长期预后和MI后HF病死率的指标[22]。既往研究发现,在MI后随访的晚期阶段(MI后1~2个月),HR升高会引起心排出量的下降,HR降低则可伴随着心肌收缩力、舒张力、射血分数及LVEDV的改善[23]。本研究结果显示,与模型组比较,丙酸盐组的心率显著下降。既往研究提示,迷走神经在调节心率方面发挥主要作用,因此这一发现可进一步支持丙酸盐可能影响了迷走神经,从而改善慢性MI后心功能和预后。
本研究存在的不足:①本研究仅提示了丙酸盐作用于迷走神经系统产生对心肌梗死后心脏重构的良性影响,其具体机制和相关分子信号通路尚不清楚;②本研究未进一步探讨丙酸盐对心脏重构影响机制中除神经调控以外的机制;③本研究未评估丙酸盐发挥作用的最佳剂量。
综上所述,本研究表明,丙酸盐可改善大鼠心肌梗死后心脏重构,其机制可能与调节心脏自主神经平衡有关。
